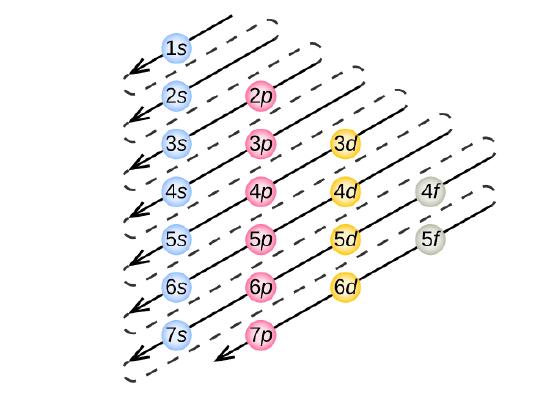
The Aufbau Principle
Pro určení elektronové konfigurace pro konkrétní atom můžeme „sestavit“ struktury v pořadí atomových čísel. Počínaje vodíkem a pokračujíce napříč periodami periodické tabulky přidáváme k jádru vždy jeden proton a jeden elektron do příslušné podskupiny, dokud nepopíšeme elektronové konfigurace všech prvků. Tento postup se nazývá princip Aufbau, z německého slova Aufbau („stavět“). Každý přidaný elektron obsadí podpouzdro s nejnižší dostupnou energií (v pořadí znázorněném na obrázku \(\PageIndex{3}\)) s ohledem na omezení daná povolenými kvantovými čísly podle Pauliho vylučovacího principu. Elektrony vstupují do vyšších energetických slupek až poté, co jsou naplněny nižší energetické slupky. Obrázek \(\PageIndex{3}\) znázorňuje tradiční způsob, jak si zapamatovat pořadí zaplnění atomových orbitalů.
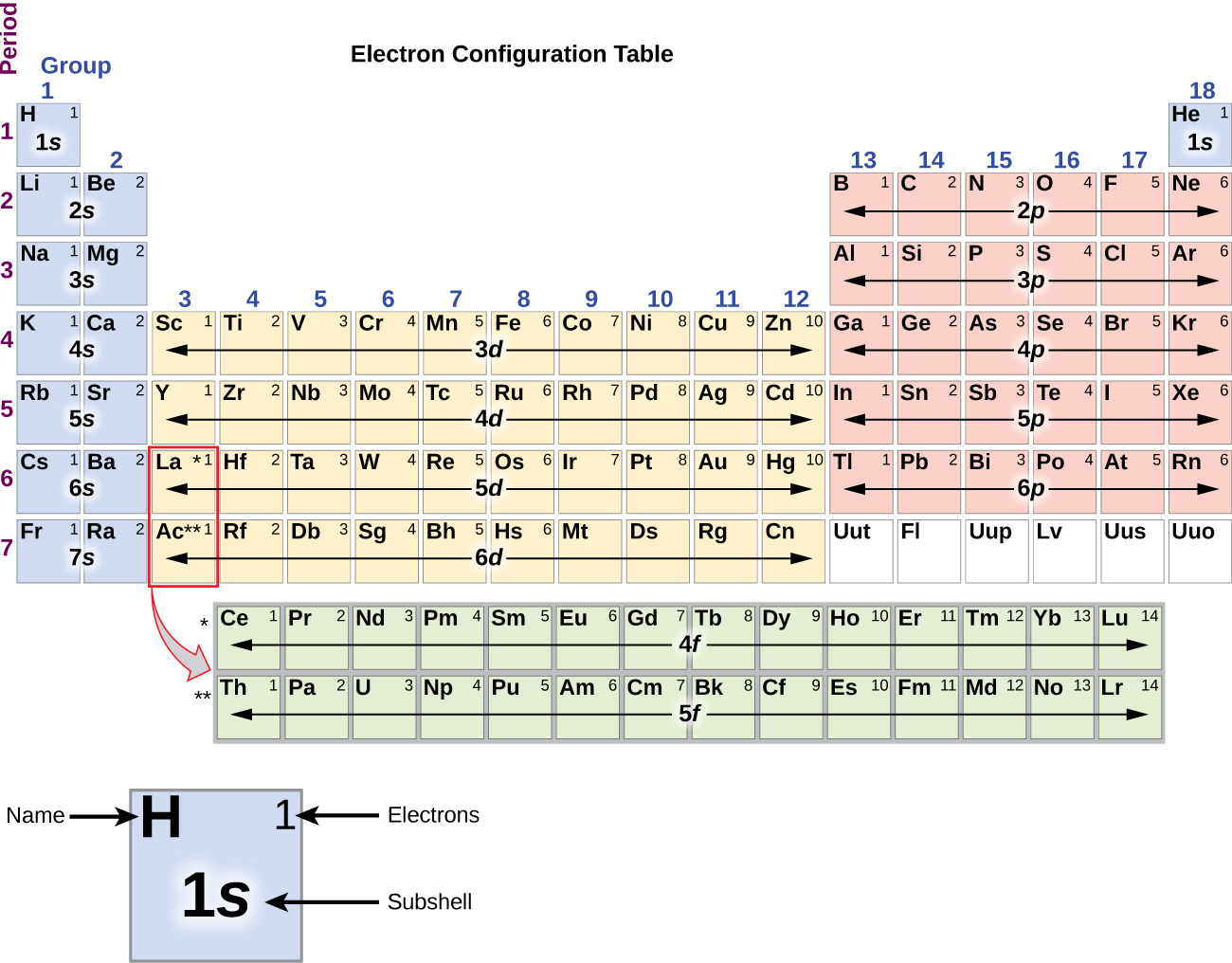
Protože uspořádání periodické tabulky je založeno na elektronových konfiguracích, obrázek \(\PageIndex{4}\) poskytuje alternativní metodu pro určení elektronové konfigurace. Pořadí plnění jednoduše začíná u vodíku a zahrnuje jednotlivé podskupiny, jak postupujete v rostoucím pořadí Z. Například po vyplnění bloku 3p až po Ar uvidíme, že orbital bude 4s (K, Ca), následovaný orbitaly 3d.
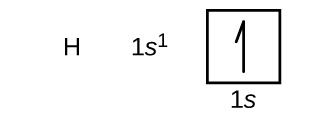
Nyní sestrojíme elektronovou konfiguraci základního stavu a orbitální diagram pro vybrané atomy v první a druhé periodě periodické tabulky. Orbitální diagramy jsou obrazová znázornění elektronové konfigurace, která zobrazují jednotlivé orbitaly a párové uspořádání elektronů. Začneme s jedním atomem vodíku (atomové číslo 1), který se skládá z jednoho protonu a jednoho elektronu. Podle obrázku \(\PageIndex{3}\) nebo \(\PageIndex{4}\) bychom očekávali, že elektron se bude nacházet v orbitalu 1s. Podle konvence se hodnota \(m_s=+\dfrac{1}{2}\) obvykle vyplňuje jako první. Elektronová konfigurace a orbitální diagram jsou:
Po vodíku následuje vzácný plyn helium, který má atomové číslo 2. Atom helia obsahuje dva protony a dva elektrony. První elektron má stejná čtyři kvantová čísla jako elektron atomu vodíku (n = 1, l = 0, ml = 0, \(m_s=+\dfrac{1}{2}\)). Druhý elektron také přechází do orbitalu 1s a vyplňuje tento orbital. Druhý elektron má stejná kvantová čísla n, l a ml, ale musí mít opačné spinové kvantové číslo, \(m_s=-\dfrac{1}{2}\). To je v souladu s Pauliho vylučovacím principem: Žádné dva elektrony v témže atomu nemohou mít stejný soubor čtyř kvantových čísel. Pro orbitální diagramy to znamená, že do každého políčka jdou dvě šipky (představující dva elektrony v každém orbitalu) a šipky musí směřovat opačným směrem (představující párové spiny). Elektronová konfigurace a orbitální diagram helia jsou:
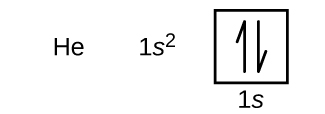
V atomu helia je zcela zaplněna slupka n = 1.
Dalším atomem je alkalický kov lithium s atomovým číslem 3. První dva elektrony v lithiu zaplňují orbital 1s a mají stejné sady čtyř kvantových čísel jako dva elektrony v heliu. Zbývající elektron musí obsadit orbital s další nejnižší energií, orbital 2s (obrázek \(\PageIndex{3}\) nebo \(\PageIndex{4}\)). Elektronová konfigurace a orbitální diagram lithia jsou tedy:
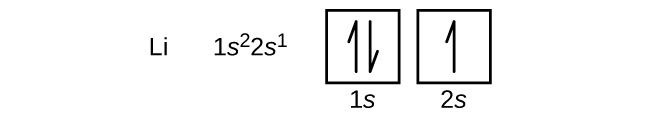
Atom kovu alkalických zemin berylia s atomovým číslem 4 obsahuje čtyři protony v jádře a čtyři elektrony obklopující jádro. Čtvrtý elektron vyplňuje zbývající prostor v orbitalu 2s.
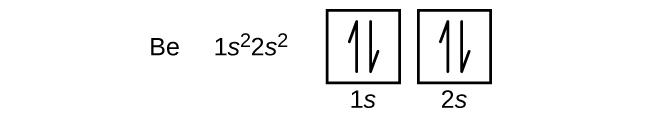
Atom boru (atomové číslo 5) obsahuje pět elektronů. Slupka n = 1 je vyplněna dvěma elektrony a tři elektrony obsadí slupku n = 2. V tomto případě se jedná o dva elektrony. Protože každá slupka s může obsahovat pouze dva elektrony, musí pátý elektron obsadit další energetickou hladinu, což bude orbital 2p. Existují tři degenerované orbitaly 2p (ml = -1, 0, +1) a elektron může obsadit kterýkoli z těchto p orbitalů. Při kreslení orbitálních diagramů zahrnujeme prázdné rámečky, abychom znázornili všechny prázdné orbitaly ve stejné podskupině, kterou vyplňujeme.
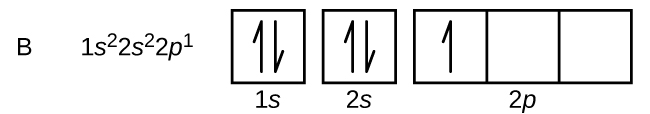
Uhlík (atomové číslo 6) má šest elektronů. Čtyři z nich vyplňují orbitaly 1s a 2s. Zbývající dva elektrony obsazují 2p podkuličku. Nyní máme na výběr, zda zaplníme jeden z orbitalů 2p a elektrony spárujeme, nebo zda ponecháme elektrony nespárované ve dvou různých, ale degenerovaných orbitalech p. V tomto případě se jedná o dva různé orbitaly. Orbitaly jsou zaplněny podle Hundova pravidla: konfigurace s nejnižší energií pro atom s elektrony v sadě degenerovaných orbitalů je ta, která má maximální počet nespárovaných elektronů. Dva elektrony v orbitalech 2p uhlíku mají tedy stejná kvantová čísla n, l a ms a liší se kvantovým číslem ml (v souladu s Pauliho vylučovacím principem). Elektronová konfigurace a orbitální diagram pro uhlík jsou:
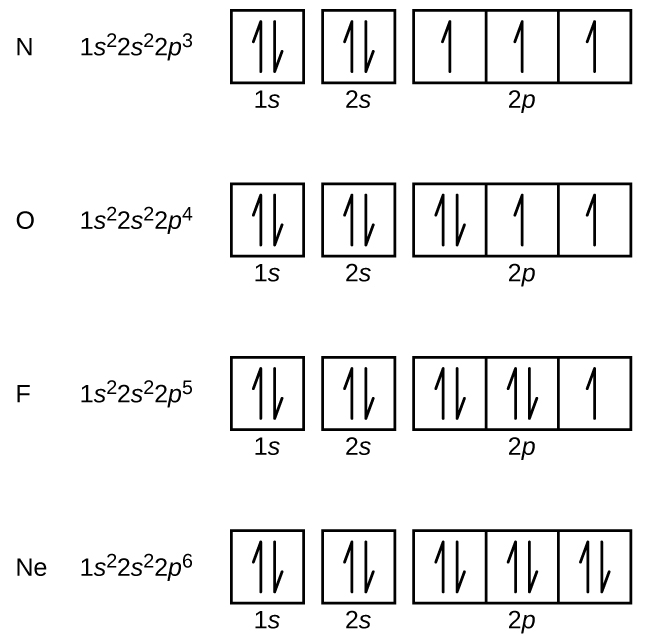
Dusík (atomové číslo 7) vyplňuje 1s a 2s slupky a v souladu s Hundovým pravidlem má v každém ze tří 2p orbitalů jeden elektron. Tyto tři elektrony mají nespárovaný spin. Kyslík (atomové číslo 8) má pár elektronů v některém z orbitalů 2p (elektrony mají opačné spiny) a jeden elektron v každém ze zbývajících dvou. Fluor (atomové číslo 9) má pouze jeden orbital 2p obsahující nespárovaný elektron. Všechny elektrony ve vzácném plynu neonu (atomové číslo 10) jsou spárované a všechny orbitaly v slupkách n = 1 a n = 2 jsou zaplněné. Elektronové konfigurace a orbitální diagramy těchto čtyř prvků jsou:
Sodík alkalického kovu (atomové číslo 11) má o jeden elektron více než atom neonu. Tento elektron musí přejít do nejnižšího dostupného energetického subshellu, orbitalu 3s, čímž vzniká konfigurace 1s22s22p63s1. Elektrony obsazující vnější orbital(y) slupky (nejvyšší hodnota n) se nazývají valenční elektrony a elektrony obsazující vnitřní orbitaly slupky se nazývají elektrony jádra ( Obrázek \PageIndex5\PageIndex5). Protože elektronové slupky jádra odpovídají elektronovým konfiguracím vzácných plynů, můžeme elektronové konfigurace zkrátit tak, že napíšeme vzácný plyn, který odpovídá elektronové konfiguraci jádra, spolu s valenčními elektrony ve zhuštěném tvaru. Pro náš příklad sodíku představuje symbol jádrové elektrony, (1s22s22p6) a naše zkrácená nebo zhuštěná konfigurace je 3s1.

Podobně lze zkrácenou konfiguraci lithia znázornit jako 2s1, kde představuje konfiguraci atomu helia, která je totožná s konfigurací zaplněného vnitřního obalu lithia. Zápis konfigurací tímto způsobem zdůrazňuje podobnost konfigurací lithia a sodíku. Oba atomy, které patří do rodiny alkalických kovů, mají pouze jeden elektron ve valenční slupce s mimo zaplněný soubor vnitřních slupek.
\}\,2s^1\\ \ce{Na:}\,3s^1\]
Kov alkalických zemin hořčík (atomové číslo 12) se svými 12 elektrony v konfiguraci 3s2 je analogický svému členu rodiny beryllia, 2s2. Oba atomy mají mimo své zaplněné vnitřní slupky zaplněnou podslupku s. Hliník (atomové číslo 13) s 13 elektrony a elektronovou konfigurací 3s23p1 je analogický svému rodinnému příslušníkovi bóru, 2s22p1.
Elektronové konfigurace křemíku (14 elektronů), fosforu (15 elektronů), síry (16 elektronů), chloru (17 elektronů) a argonu (18 elektronů) jsou elektronovými konfiguracemi svých vnějších slupek analogické odpovídajícím členům rodiny uhlíku, dusíku, kyslíku, fluoru a neonu, v tomto pořadí, s tím rozdílem, že hlavní kvantové číslo vnější slupky těžších prvků se zvýšilo o jedna na n = 3. Obrázek \(\PageIndex{6}\) ukazuje elektronovou konfiguraci s nejnižší energií nebo v základním stavu pro tyto prvky a také pro atomy všech známých prvků.
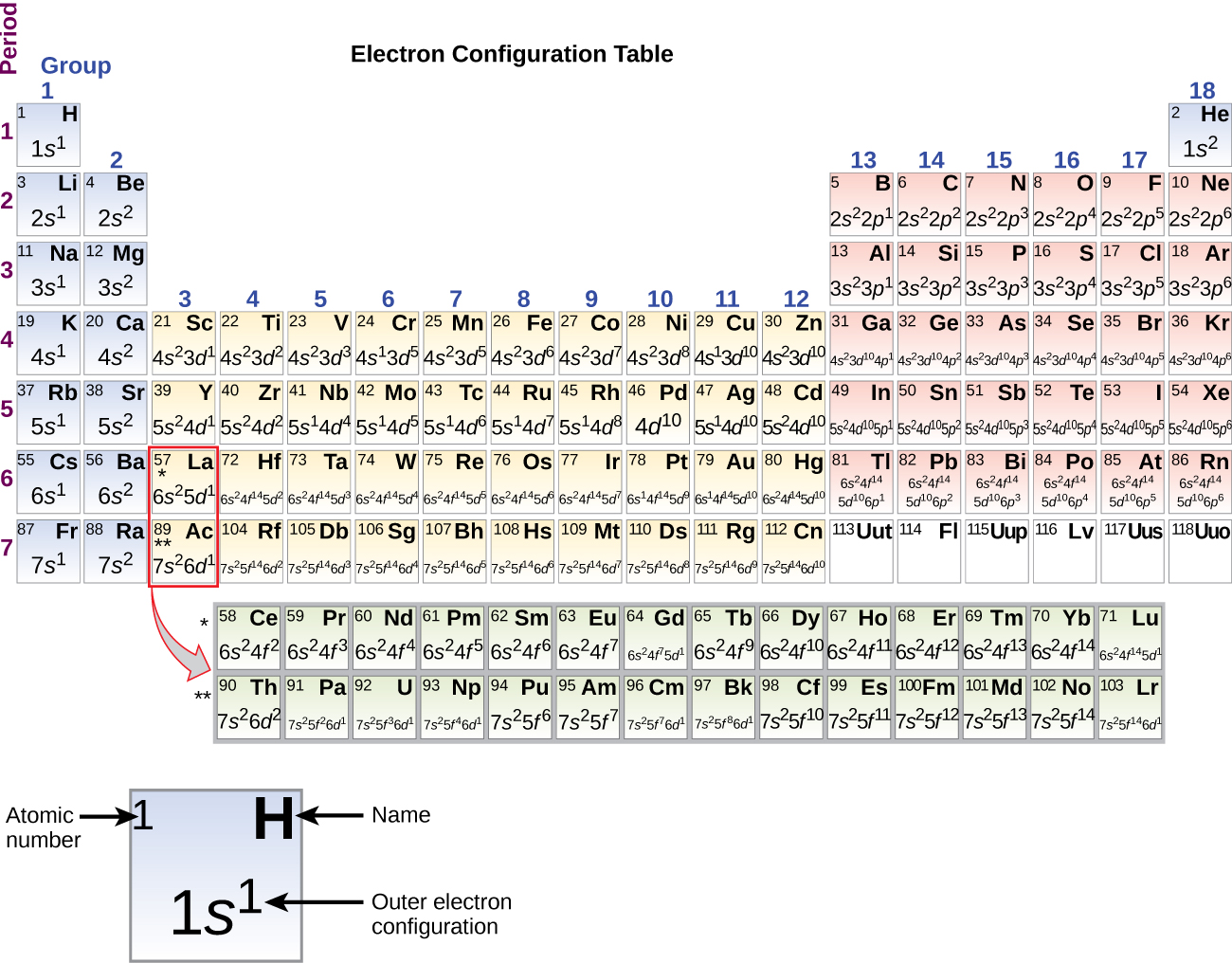
Když se dostaneme k dalšímu prvku v periodické tabulce, alkalickému kovu draslíku (atomové číslo 19), mohli bychom očekávat, že začneme přidávat elektrony do 3. podpouzdra. Všechny dostupné chemické a fyzikální důkazy však ukazují, že draslík je na tom podobně jako lithium a sodík a že další elektron se nepřidává na hladinu 3d, ale naopak na hladinu 4s (obrázek \(\PageIndex{3}\) nebo \(\PageIndex{4}\). Jak již bylo řečeno, orbital 3d bez radiálních uzlů má vyšší energii, protože je méně pronikavý a více chráněný před jádrem než orbital 4s, který má tři radiální uzly. Draslík má tedy elektronovou konfiguraci 4s1. Draslík tedy svou konfigurací valenčního obalu odpovídá Li a Na. Přidáním dalšího elektronu se doplní podskupina 4s a vápník má elektronovou konfiguraci 4s2. Tím má vápník elektronovou konfiguraci vnějšího obalu odpovídající konfiguraci berylia a hořčíku.
Začínáme-li u přechodného kovu skandia (atomové číslo 21), přidávají se postupně další elektrony do 3d podobalu. Tato podpouzdra jsou naplněna do své kapacity 10 elektrony (nezapomeňte, že pro l = 2 , existuje 2l + 1 = 5 hodnot ml, což znamená, že existuje pět d orbitalů, které mají dohromady kapacitu 10 elektronů). Jako další se zaplní podpouzdro 4p. Všimněte si, že pro tři řady prvků, od skandia (Sc) přes měď (Cu), yttrium (Y) přes stříbro (Ag) a lutecium (Lu) až po zlato (Au), se do slupky (n – 1) vedle slupky n postupně přidává celkem 10 elektronů d, aby tato slupka (n – 1) měla 8 až 18 elektronů. U dvou řad, lanthanu (La) přes lutecium (Lu) a aktinia (Ac) přes lawrencium (Lr), se do (n – 2) slupky postupně přidává 14 f elektronů (l = 3, 2l + 1 = 7 ml hodnot; tedy sedm orbitalů s celkovou kapacitou 14 elektronů), čímž se tato slupka dostane z 18 elektronů na celkem 32 elektronů.
Příklad \(\PageIndex{1}\): Kvantová čísla a elektronové konfigurace
Jaká je elektronová konfigurace a orbitální diagram pro atom fosforu? Jaká jsou čtyři kvantová čísla pro poslední přidaný elektron?
Řešení
Atomové číslo fosforu je 15. Jaké je atomové číslo fosforu? Atom fosforu tedy obsahuje 15 elektronů. Pořadí zaplnění energetických hladin je 1s, 2s, 2p, 3s, 3p, 4s, … . Patnáct elektronů atomu fosforu se zaplní až po orbital 3p, který bude obsahovat tři elektrony:
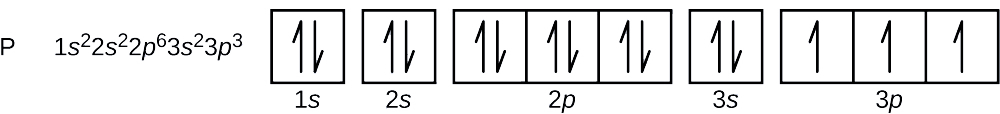
Poslední přidaný elektron je elektron 3p. Proto je n = 3 a pro orbital typu p platí, že l = 1. Hodnota ml může být -1, 0 nebo +1. Tři p orbitaly jsou degenerované, takže kterákoli z těchto hodnot ml je správná. Pro nepárové elektrony konvence přiřazuje hodnotu \(+\dfrac{1}{2}\) pro spinové kvantové číslo; tedy \(m_s=+\dfrac{1}{2}\).
Cvičení \(\PageIndex{1}\)
Identifikujte atomy z daných elektronových konfigurací:
- 4s23d5
- 5s24d105p6
Odpověď a
Mn
Odpověď b
Xe
Periodická tabulka může být mocným nástrojem při předpovídání elektronové konfigurace prvku. Najdeme však výjimky z pořadí zaplnění orbitalů, které jsou znázorněny na obrázku \(\PageIndex{3}\) nebo \(\PageIndex{4}\). Například elektronové konfigurace přechodných kovů chromu (Cr; atomové číslo 24) a mědi (Cu; atomové číslo 29) nejsou takové, jaké bychom očekávali. Obecně se takové výjimky týkají podoblastí s velmi podobnou energií a malé vlivy mohou vést ke změnám v pořadí zaplnění.
V případě Cr a Cu jsme zjistili, že zpola zaplněné a zcela zaplněné podoblasti zřejmě představují podmínky preferované stability. Tato stabilita je taková, že elektron se přesune z orbitalu 4s do orbitalu 3d, aby získal dodatečnou stabilitu zpola zaplněné 3d podpouzdra (u Cr) nebo zaplněného 3d podpouzdra (u Cu). Vyskytují se i další výjimky. Například u niobu (Nb, atomové číslo 41) se předpokládá elektronová konfigurace 5s24d3. Experimentálně jsme zjistili, že jeho elektronová konfigurace v základním stavu je ve skutečnosti 5s14d4. Toto pozorování můžeme zdůvodnit tím, že odpuzování elektronů při párování elektronů v orbitalu 5s je větší než energetická mezera mezi orbitaly 5s a 4d. Neexistuje žádná jednoduchá metoda, jak předpovědět výjimky pro atomy, u nichž je velikost odpuzování mezi elektrony větší než malé rozdíly v energiích mezi subshelly
.