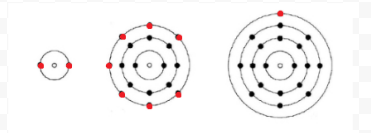
Lewis brugte simple diagrammer (nu kaldet Lewis-diagrammer) til at holde styr på, hvor mange elektroner der var til stede i den yderste, eller valensskal, på et givet atom. Atomets kerne, dvs. kernen sammen med de indre elektroner, er repræsenteret ved det kemiske symbol, og kun valenselektronerne er tegnet som prikker, der omgiver det kemiske symbol. Således kan de tre atomer, der er vist i figur 1 fra Elektroner og valens, repræsenteres ved følgende Lewis-diagrammer:

Hvis atomet er et ædelgasatom, er to alternative fremgangsmåder mulige. Enten kan vi betragte atomet som havende nul valenselektroner, eller vi kan betragte den yderste fyldte skal som valensskal. De tre første ædelgasser kan således skrives som:
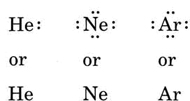
Eksempel \(\PageIndex{1}\): Lewis-strukturer
Tegn Lewis-diagrammer for et atom af hvert af de følgende grundstoffer: Li, N, F, Na
Løsning
Vi finder ud fra det periodiske system på forsiden af omslaget, at Li har atomnummer 3. Det indeholder således tre elektroner, en mere end ædelgassen He. Det betyder, at den yderste, eller valensskal, kun indeholder én elektron, og Lewis-diagrammet er
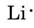
Følge samme ræsonnement har N syv elektroner, fem flere end He, mens F har ni elektroner, syv flere end He, hvilket giver
![]()
Na har ni flere elektroner end He, men otte af dem er i kernen, hvilket svarer til de otte elektroner i den yderste skal hos Ne. Da Na kun har 1 elektron mere end Ne, er dets Lewis-diagram
![]()
Bemærk ud fra det foregående eksempel, at alkalimetallernes Lewis-diagrammer er identiske bortset fra deres kemiske symboler. Dette stemmer fint overens med den meget ensartede kemiske opførsel af alkalimetallerne. På samme måde ser Lewis-diagrammer for alle grundstoffer i andre grupper, som f.eks. de alkaliske jordarter eller halogener, ens ud.
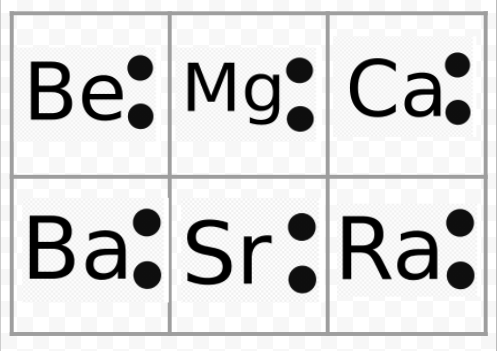
Lewis-diagrammerne kan også bruges til at forudsige grundstoffernes valenser. Lewis foreslog, at antallet af valenser for et atom var lig med antallet af elektroner i dets valensskal eller med antallet af elektroner, som skulle tilføjes til valensskallen for at opnå den elektroniske skalstruktur for den næste ædelgas. Som et eksempel på denne idé kan man betragte grundstofferne Be og O. Deres Lewis-diagrammer og ædelgasserne He og Ne er

Sammenligner man Be med He, ser man, at førstnævnte har to flere elektroner og derfor burde have en valens på 2. Grundstoffet O kunne forventes at have en valens på 6 eller en valens på 2, da det har seks valenselektroner – to mindre end Ne. Ved hjælp af de valensregler, der er udviklet på denne måde, kunne Lewis redegøre for den regelmæssige stigning og nedgang i de små bogstaver for forbindelserne i den tabel, der findes i afsnittet om valens, og som er gengivet her. Desuden var han i stand til at forklare mere end 50 % af formlerne i tabellen. (De formler, der stemmer overens med hans idéer, er skraveret i farve i tabellen. Du kan med fordel henvise til denne tabel nu og kontrollere, at nogle af de angivne formler følger Lewis’ regler). Lewis’ succes i denne forbindelse gav en klar indikation af, at elektronerne var den vigtigste faktor for at holde atomerne sammen, når molekyler blev dannet.
På trods af disse succeser er der også vanskeligheder at finde i Lewis’ teorier, især for grundstoffer ud over calcium i det periodiske system. Grundstoffet Br (Z = 35) har f.eks. 17 flere elektroner end ædelgassen Ar (Z = 18). Dette får os til at konkludere, at Br har 17 valenselektroner, hvilket gør det vanskeligt at forklare, hvorfor Br ligner Cl og F så meget, selv om disse to atomer kun har syv valenselektroner.
| Element | Atomvægt | Hydrogen Forbindelser | Syreforbindelser | Klorforbindelser | ||
|---|---|---|---|---|---|---|
| Vækststof | 1.01 | H2 | H2O, H2O2 | HCl | ||
| Helium | 4.00 | Ingen dannet | Ingen dannet | Ingen dannet | ||
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl | ||
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 | ||
| Bor | Boron | 10.81 | B2H6 | B2H6 | B2O3 | BCl3 |
| Kulstof | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 | ||
| Stickstof | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 | ||
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 | ||
| Fluorin | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 | ||
| Neon | 20.18 | Ingen dannet | Ingen dannet | Ingen dannet | ||
| Natrium | 22.99 | NaH | Na2O, Na2O2 | NaCl | ||
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 | ||
| Aluminium | 26.98 | AlH3 | Al2O3 | AlCl3 | ||
| Silicium | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 | ||
| Phosphor | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 | ||
| Svovl | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 | ||
| Chlor | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 | ||
| Kalium | 39.10 | KH | K2, K2O2, KO2 | KCl | ||
| Argon | 39.95 | None formed | None formed | None formed | ||
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 | ||
| Scandium | 44.96 | Relatively Unstable | Sc2O3 | ScCl3 | ||
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 | ||
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 | ||
| Chromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributors
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff og Adam Hahn.