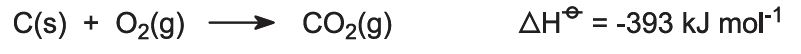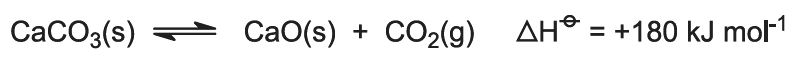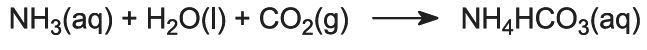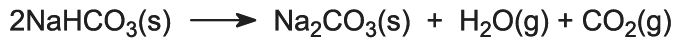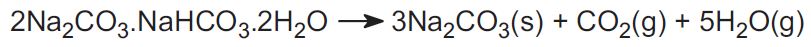- Anvendelser af natriumcarbonat
- Årlig produktion af natriumcarbonat
- Fremstilling af natriumcarbonat
- (a) Fra natriumchlorid og calciumcarbonat
- (1) Ammoniakering af saltvand
- (2) Dannelse af calciumoxid og kuldioxid
- (3) Solvay-tårnet
- (4) Udskillelse af fast natriumhydrogencarbonat
- (5) Dannelse af natriumcarbonat
- (6) Dannelse af calciumhydroxid
- (7) Regenerering af ammoniak
- (b) Fra trona- og nahcolitmalm
Anvendelser af natriumcarbonat
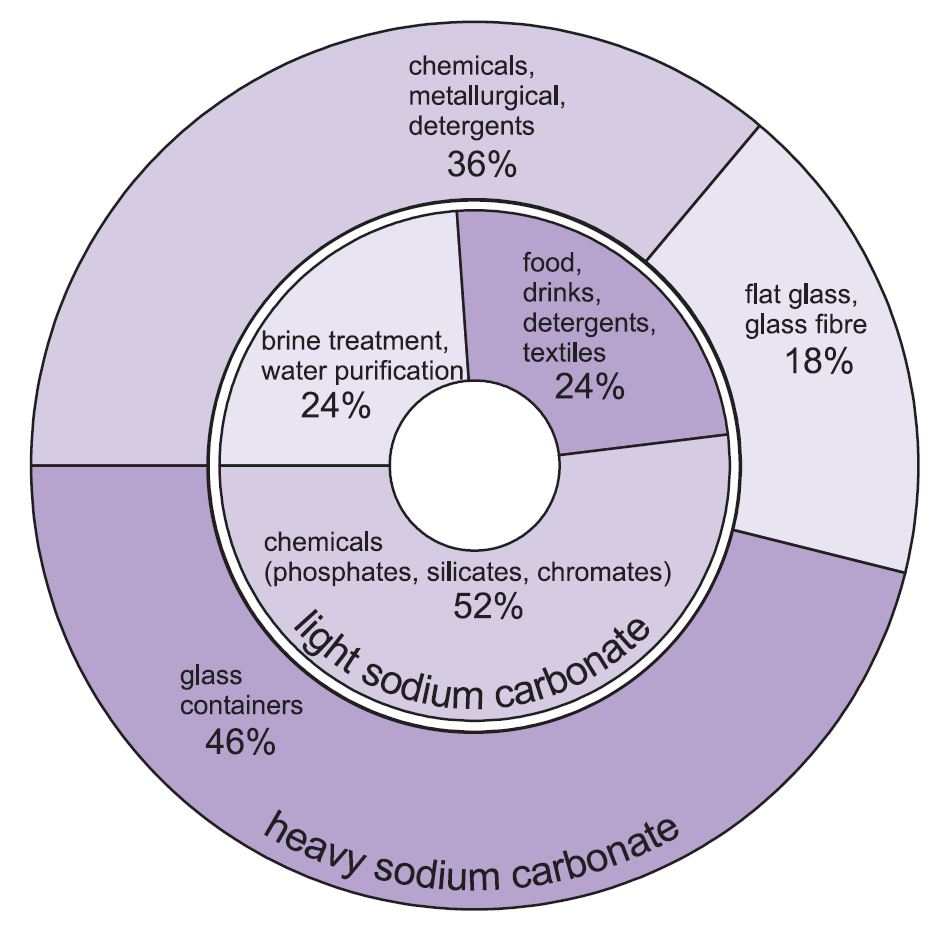
Der anvendes to former for natriumcarbonat (soda) – tungt og let. Den lette form fremstilles først, og en del omdannes derefter til den tunge form. Let natriumcarbonat indeholder mindre end 0,5 % natriumklorid. Tungt natriumcarbonat fremstilles ved at hydrere let natriumcarbonat til monohydrat (Na2CO3.H2O) og derefter dehydrere det for at give et produkt med en øget krystalstørrelse og massefylde.
De to kvaliteter har forskellige anvendelsesmuligheder.
De vigtigste anvendelser af tung natriumcarbonat er som fast stof, især ved fremstilling af glas, hvor det bruges som flusmiddel ved smeltning af silica (sand).
Anvendelserne for let natriumcarbonat er traditionelt, hvor kemikaliet er nødvendigt i opløsning.
Figur 1 Anvendelser af både tung og let natriumcarbonat.
Overordnet set anvendes ca. 50 % af den samlede produktion af natriumcarbonat til fremstilling af glas, 18 % til fremstilling af andre kemikalier og 10 % i sæbe og rengøringsmidler.
Årlig produktion af natriumcarbonat
Kina er verdens største producent af natriumcarbonat og tegner sig for 46% af verdensproduktionen og USA for 23%. (IHS Markit, 2015)
| Verden | 52 mio. tons1,2 |
| Kina | 25 mio. tons3 |
| USA. | 12 mio. tons1 |
| Europa | 11 mio. tons |
| Rusland | 0.71 mio. tons4 |
Data fra:
1. 2018 Elements of the Business of Chemistry, American Chemistry Council.
2. Heraf er 14,7 tons udvundet. Langt størstedelen udvindes i USA (11,7 mio. tons) og Tyrkiet (2 mio. tons). Resten fremstilles af natriumklorid og calciumcarbonat.
3. IHS Markit, 2015
4. Federal State Statistics Service: Russiske Føderation 2011
Fremstilling af natriumcarbonat
Der er to hovedkilder til natriumcarbonat:
a) fra salt og calciumcarbonat (via ammoniak sodaprocessen (Solvay))
b) fra natriumcarbonat- og hydrogencarbonatmalme (trona og nahcolit)
(a) Fra natriumchlorid og calciumcarbonat
Den samlede reaktion kan betragtes som mellem calciumcarbonat og natriumchlorid:
Kalciumcarbonat er imidlertid for uopløseligt til at reagere med en saltopløsning. I stedet fremstilles produktet gennem en række syv trin.
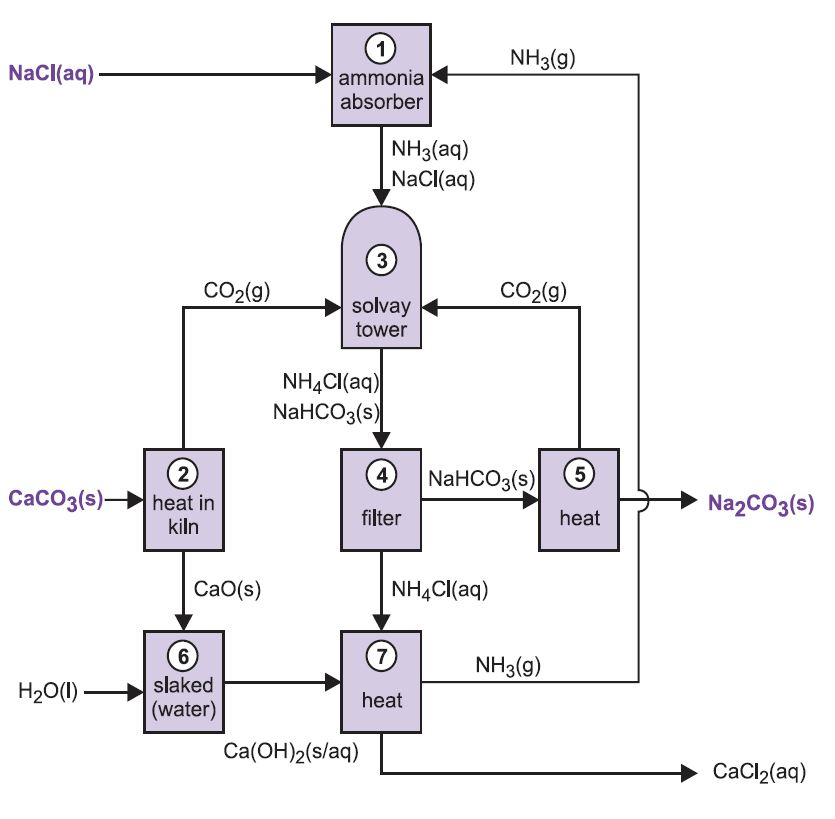
Processen er kendt som ammoniak-soda-processen eller Solvay-processen, opkaldt efter den belgiske industrikemiker, der tog patent på den i 186I.
De forskellige trin i Solvay-processen er indbyrdes forbundne, som det fremgår af nedenstående diagram og beskrivelse.
Figur 2 De forskellige faser i Solvay-processen.
(1) Ammoniakering af saltvand
Ammoniakgas absorberes i koncentreret saltvand for at give en opløsning, der indeholder både natriumklorid og ammoniak. Der er Na+(aq), Cl-(aq), NH4+(aq), OH-(aq) ioner og NH3(aq) til stede.
(2) Dannelse af calciumoxid og kuldioxid
Kovne fodres med en blanding af kalksten og koks (13:1 efter masse). Kokken brænder i en modstrøm af forvarmet luft:
Forbrændingsvarmen hæver ovnens temperatur, og kalkstenen nedbrydes:
Gassen, der indeholder ca. 40 % kuldioxid, frigøres for kalkstøv og sendes til karboniseringstårnene (Solvay). Restproduktet, calciumoxid, anvendes til ammoniakgenvinding (se trin 7 nedenfor).
(3) Solvay-tårnet
Dette er den vigtigste fase i processen. Den ammoniakholdige saltlage fra trin (1) ledes ned gennem Solvay-tårnet, mens kuldioxid fra trin (2) og (5) ledes op gennem det. Solvay-tårnet er højt og indeholder et sæt svampeformede baffler, der bremser og opdeler væskestrømmen, således at kuldioxiden effektivt kan absorberes af opløsningen. Kuldioxid reagerer ved opløsningen med den opløste ammoniak og danner ammoniumhydrogencarbonat:
Løsningen indeholder nu ionerne Na+(aq), Cl-(aq), NH4+(aq) og HCO3-(aq). Af de fire stoffer, der kan dannes ved forskellige kombinationer af disse ioner, er natriumhydrogencarbonat (NaHCO3) det mindst opløselige. Det udfældes som et fast stof i den nederste del af tårnet, som afkøles. Nettoprocessen er:
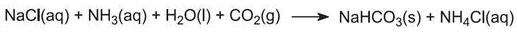
En suspension af fast natriumhydrogencarbonat i en opløsning af ammoniumchlorid løber ud af tårnets bund.
(4) Udskillelse af fast natriumhydrogencarbonat
Suspensionen filtreres for at adskille det faste natriumhydrogencarbonat fra ammoniumchloridopløsningen, som derefter anvendes i trin (7).
(5) Dannelse af natriumcarbonat
Natriumhydrogencarbonatet opvarmes i roterende ovne ved 450 K, så det nedbrydes til natriumcarbonat, vand og kuldioxid:
Koldioxiden sendes tilbage til Solvay-tårnet til brug i trin (3). Produktet af processen, vandfri natriumcarbonat, fås som et fint hvidt pulver, kendt som let natriumcarbonat.
(6) Dannelse af calciumhydroxid
De to sidste trin, (6) og (7), vedrører regenerering af ammoniak fra ammoniumchlorid (fremstillet i trin 3). Den ubrændte kalk fra trin (2) slukkes med overskydende vand, hvorved der dannes kalkmælk:
(7) Regenerering af ammoniak
Denne calciumhydroxid-suspension blandes med den ammoniumchloridopløsning, der er tilbage fra trin (4), og opvarmes:
Ammoniakken genvindes således og sendes tilbage til trin (1). Calciumchlorid er det eneste biprodukt i hele processen.
Den samlede proces er elegant. I teorien er de eneste råmaterialer kalksten og saltvand. Der er uundgåeligt tab af ammoniak, og dette tab kompenseres ved at tilsætte ekstra forsyninger, som det kræves i trin (1).
(b) Fra trona- og nahcolitmalm
Solvay-processen anvendes ikke i USA. I stedet anvender industrien to malme, og dette tegner sig for ca. 30% af verdens produktion. Den ene er trona, som findes i store mængder i Wyoming. Trona har formlen:
Malmen udvindes som et fast stof og opvarmes for at drive kuldioxid væk, så man får natriumcarbonat:
Den anden malm er nahcolit, som er natriumhydrogencarbonat. Ved opvarmning danner den natriumcarbonat.