Lewis egyszerű diagramokat (ma Lewis-diagramoknak nevezzük őket) használt arra, hogy számon tartsa, hány elektron van jelen egy adott atom legkülső, vagy valenciahéjában. Az atom magját, azaz az atommagot a belső elektronokkal együtt a kémiai jel ábrázolja, és csak a valenciaelektronokat rajzolja a kémiai jelet körülvevő pontokként. Így az Elektronok és valencia az 1. ábrán látható három atomot a következő Lewis-diagramokkal lehet ábrázolni:
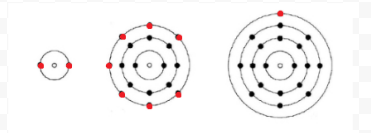

Ha az atom nemesgázatom, két alternatív eljárás lehetséges. Vagy úgy tekintjük, hogy az atomnak nulla valenciaelektronja van, vagy a legkülső kitöltött héjat tekintjük valenciahéjnak. Az első három nemesgáz így írható fel:
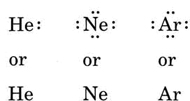
Példa \(\PageIndex{1}\): Lewis-szerkezetek
Rajzoljuk meg a Lewis-diagramokat az alábbi elemek egy-egy atomjára: A címlapon található periódusos rendszerből megtudjuk, hogy a Li atomszáma 3. Tehát három elektront tartalmaz, eggyel többet, mint a He nemesgázé. Ez azt jelenti, hogy a legkülső, vagyis a valenciahéj csak egy elektront tartalmaz, és a Lewis-diagram
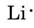
Az N-nek ugyanezt az érvelést követve hét elektronja van, öt elektronnal több, mint He-nek, míg az F-nek kilenc elektronja van, héttel több, mint He-nek, így
![]()
Na-nak kilenc elektronja van, mint He-nek, de ebből nyolc a magban van, ami megfelel a Ne legkülső héjában lévő nyolc elektronnak. Mivel a Na-nak csak eggyel több elektronja van, mint a Ne-nek, Lewis-diagramja
![]()
Az előző példából észrevehetjük, hogy az alkálifémek Lewis-diagramjai a kémiai jelek kivételével azonosak. Ez szépen összhangban van az alkálifémek nagyon hasonló kémiai viselkedésével. Hasonlóképpen a többi csoportba tartozó elemek, például az alkáliföldfémek vagy a halogének Lewis-diagramjai is ugyanúgy néznek ki.
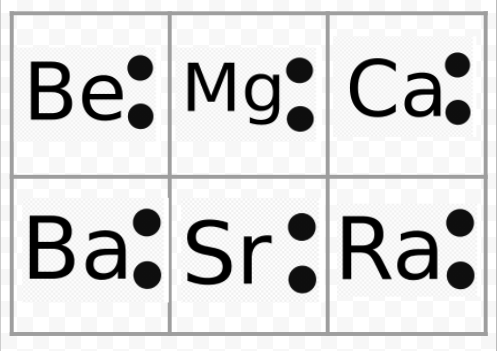
A Lewis-diagramok az elemek valenciájának előrejelzésére is használhatók. Lewis azt javasolta, hogy egy atom valenciáinak száma megegyezik a valenciahéjban lévő elektronok számával, illetve azon elektronok számával, amelyeket hozzá kell adni a valenciahéjhoz ahhoz, hogy a következő nemesgáz elektronhéjszerkezetét elérjük. Ennek az elképzelésnek a példájaként tekintsük a Be és az O elemeket. Lewis-diagramjaik, valamint a He és Ne nemesgázokéi a következők

A Be és He összehasonlításakor azt látjuk, hogy az előbbinek két elektronnal több van, ezért a valenciája 2-nek kellene lennie. Az O elemtől 6-os vagy 2-es valenciát várhatnánk, mivel hat valenciaelektronja van – kettővel kevesebb, mint a Ne-nek. Az így kidolgozott valencia-szabályok segítségével Lewis képes volt megmagyarázni a vegyületek indexeinek szabályos növekedését és csökkenését a Valencia fejezetben található és itt reprodukált táblázatban. Ezenkívül a táblázatban szereplő képletek több mint 50 százalékát meg tudta magyarázni. (A táblázatban színnel árnyékoltuk azokat, amelyek megegyeznek az elképzeléseivel. Érdemes most megnézni ezt a táblázatot, és ellenőrizni, hogy a jelzett képletek némelyike követi-e Lewis szabályait). Lewis sikere ezzel kapcsolatban egyértelmű jelét adta annak, hogy a molekulák kialakulásakor az elektronok a legfontosabb tényezők az atomok összetartásában.
A sikerek ellenére Lewis elméleteiben nehézségeket is találunk, különösen a periódusos rendszerben a kalciumon túli elemek esetében. A Br elem (Z = 35) például 17 elektronnal többel rendelkezik, mint a nemesgáz Ar (Z = 18). Ez arra enged következtetni, hogy a Br-nek 17 valenciaelektronja van, ami megnehezíti annak magyarázatát, hogy a Br miért hasonlít annyira a Cl-re és az F-re, holott e két atomnak csak hét valenciaelektronja van.
| Elem | Atomsúly | Hidrogén. Vegyületek | Az oxigén vegyületek | Klór vegyületek |
|---|---|---|---|---|
| Hidrogén | 1.01 | H2 | H2O, H2O2 | HCl |
| Hélium | 4.00 | Nem keletkezett | Nem keletkezett | Nem keletkezett |
| Lítium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Berillium | 9.01 | BeH2 | BeO | BeCl2 |
| Bór | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogén | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Nem keletkezett | Nem keletkezett | Nem keletkezett |
| Nátrium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnézium | 24.31 | MgH2 | MgO | MgCl2 |
| Alumínium | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silícium | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Foszfor | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Kén | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Klór | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Kálium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | Nem képződött | Nem képződött | Nem képződött |
| Kalcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Szkandium | 44.96 | Viszonylag instabil | Sc2O3 | ScCl3 |
| Titán | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanádium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Króm | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Munkatársak
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff és Adam Hahn.