A felépítés elve
Az elektronkonfiguráció meghatározásához bármely atom esetében “felépíthetjük” a szerkezeteket az atomszámok sorrendjében. A hidrogénnel kezdve, és folytatva a periódusos rendszer periódusain keresztül, egyszerre egy-egy protont adunk az atommaghoz és egy-egy elektront a megfelelő alhéjhoz, amíg le nem írtuk az összes elem elektronkonfigurációját. Ezt az eljárást Aufbau-elvnek nevezzük, a német Aufbau (“felépíteni”) szóból. Minden egyes hozzáadott elektron a rendelkezésre álló legalacsonyabb energiájú alhéjban foglal helyet (a \(\PageIndex{3}\) ábra szerinti sorrendben), a megengedett kvantumszámok által a Pauli-kizárási elvnek megfelelően előírt korlátozásokkal. Az elektronok csak akkor lépnek be a magasabb energiájú alhéjakba, ha az alacsonyabb energiájú alhéjak már teljesen megteltek. Az \(\PageIndex{3}\) ábra szemlélteti az atomi pályák kitöltési sorrendjének hagyományos módon történő felidézését.
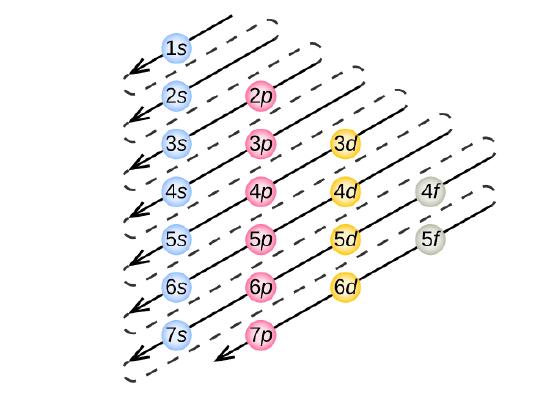
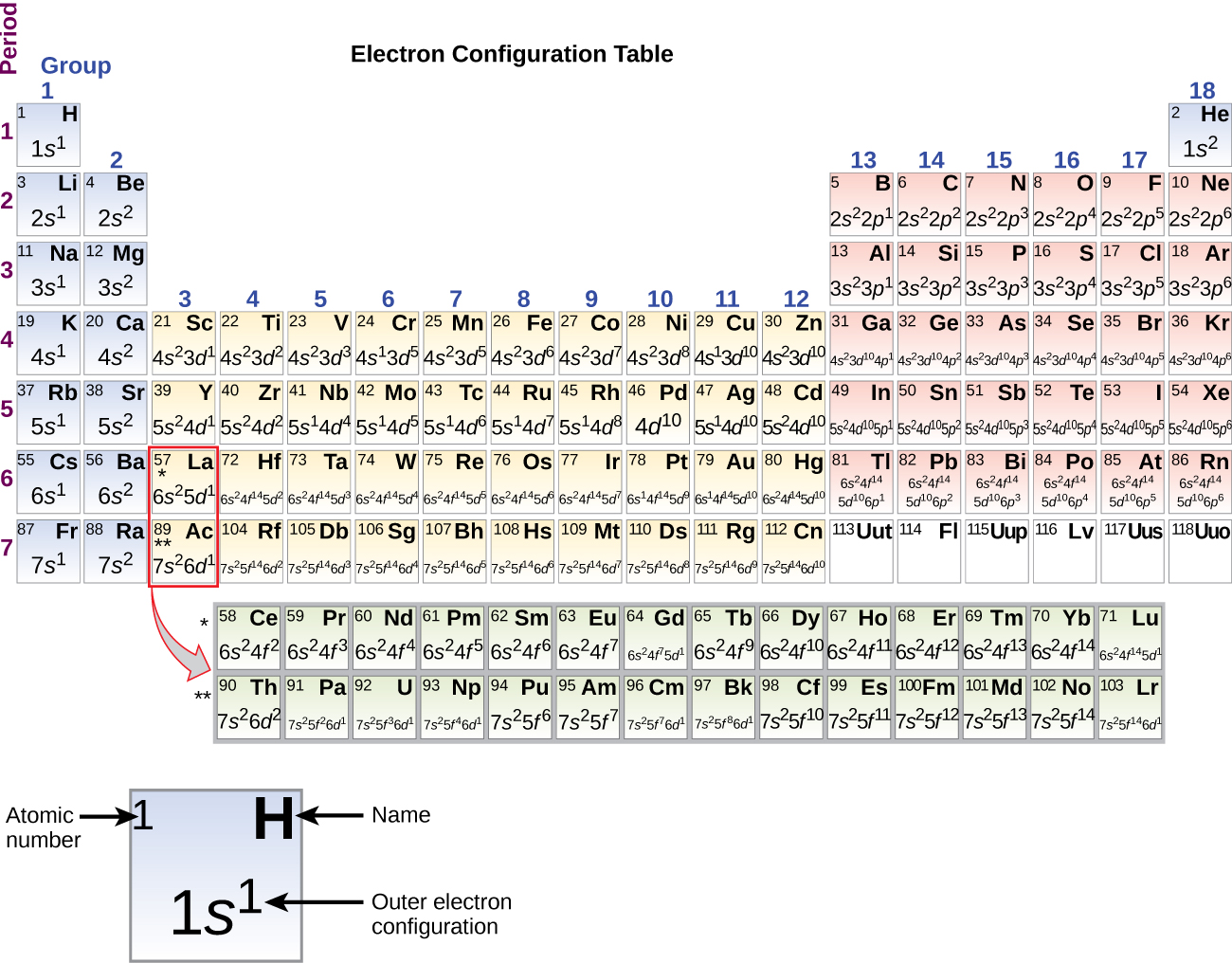
Mivel a periódusos rendszer elrendezése az elektronkonfigurációkon alapul, a \(\PageIndex{4}\) ábra egy alternatív módszert kínál az elektronkonfiguráció meghatározására. A kitöltési sorrend egyszerűen a hidrogénnel kezdődik, és a növekvő Z sorrendben haladva minden alhéjra kiterjed. Például a 3p blokk Ar-ig történő kitöltése után azt látjuk, hogy a 4s orbitál lesz (K, Ca), majd a 3d orbitálok következnek.
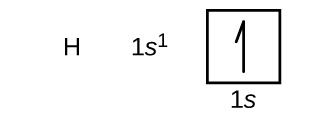
A következőkben a periódusos rendszer első és második periódusában található atomok egy válogatásának alapállapotbeli elektronkonfigurációját és orbitális diagramját fogjuk megalkotni. Az orbitális diagramok az elektronkonfiguráció képi ábrázolásai, amelyek megmutatják az egyes pályákat és az elektronok párosodási elrendeződését. Egyetlen hidrogénatomból (1-es atomi szám) indulunk ki, amely egy protonból és egy elektronból áll. A \(\PageIndex{3}\) vagy a \(\PageIndex{4}\) ábra alapján az elektront az 1s pályán találjuk. A konvenció szerint általában a \(m_s=+\dfrac{1}{2}\) értéket töltjük ki először. Az elektronkonfiguráció és a pályadiagram a következő:
A hidrogén után a hélium nemesgáz következik, amelynek az atomszáma 2. A héliumatom két protont és két elektront tartalmaz. Az első elektronnak ugyanaz a négy kvantumszáma, mint a hidrogénatom elektronjának (n = 1, l = 0, ml = 0, \(m_s=+\dfrac{1}{2}\)). A második elektron szintén az 1s orbitálisba kerül, és kitölti azt. A második elektron n, l és ml kvantumszámai megegyeznek, de a spin kvantumszámának ellentétesnek kell lennie, \(m_s=-\dfrac{1}{2}\). Ez összhangban van a Pauli-féle kizárási elvvel: ugyanabban az atomban két elektron nem rendelkezhet ugyanazzal a négy kvantumszámmal. Az orbitális diagramok esetében ez azt jelenti, hogy minden egyes dobozba két nyíl kerül (ami két elektront jelent minden egyes orbitálisban), és a nyilaknak ellentétes irányba kell mutatniuk (ami a páros spint jelenti). A hélium elektronkonfigurációja és orbitális diagramja a következő:
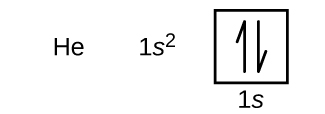
A hélium atomban az n = 1 héj teljesen ki van töltve.
A következő atom az alkálifém lítium, amelynek az atomszáma 3. A lítium első két elektronja az 1s orbitált tölti ki, és ugyanolyan négyes kvantumszámkészlettel rendelkezik, mint a hélium két elektronja. A fennmaradó elektronnak a következő legalacsonyabb energiájú orbitált, a 2s orbitált kell elfoglalnia (\(\PageIndex{3}\) vagy \(\PageIndex{4}\) ábra). Így a lítium elektronkonfigurációja és pályadiagramja:
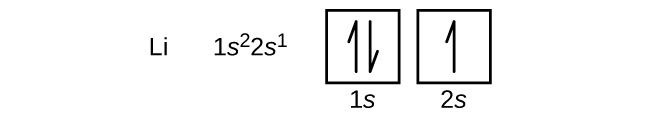
A 4-es atomi számú alkáliföldfém berillium atomja négy protont tartalmaz az atommagban és négy elektront az atommag körül. A negyedik elektron kitölti a 2s orbitálisban megmaradt helyet.
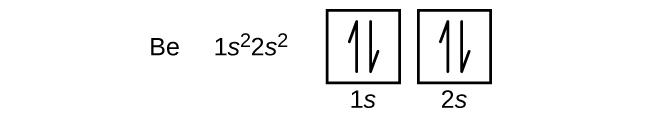
A bór (atomi száma 5) atomja öt elektront tartalmaz. Az n = 1 héjat két elektron tölti ki, és három elektron foglalja el az n = 2 héjat. Mivel bármelyik s alhéjban csak két elektron lehet, az ötödik elektronnak a következő energiaszintet kell elfoglalnia, ami egy 2p orbitális lesz. Három degenerált 2p pálya van (ml = -1, 0, +1), és az elektron bármelyik p pályát elfoglalhatja. Az orbitális diagramok rajzolásakor üres dobozokat veszünk fel, hogy ábrázoljuk az esetleges üres pályákat ugyanabban az alhéjban, amelyet kitöltünk.
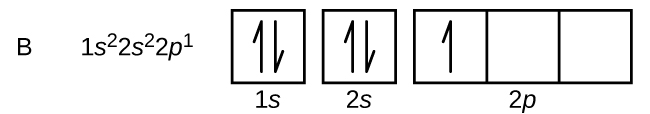
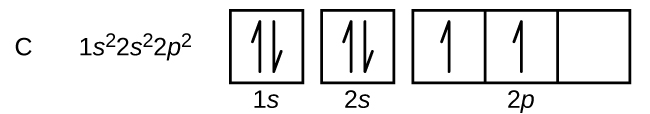
A szén (6-os atomi szám) hat elektronnal rendelkezik. Ezek közül négy tölti ki az 1s és 2s pályákat. A maradék két elektron a 2p alhéjat foglalja el. Most választhatunk, hogy kitöltjük az egyik 2p pályát és párosítjuk az elektronokat, vagy párosítatlanul hagyjuk az elektronokat két különböző, de degenerált p pályán. A pályák kitöltése a Hund-szabály szerint történik: az elfajzott pályákon belüli elektronokkal rendelkező atom legalacsonyabb energiájú konfigurációja az, amelyik a legnagyobb számú párosítatlan elektronnal rendelkezik. Így a szén 2p pályáin lévő két elektron n, l és ms kvantumszáma azonos, ml kvantumszámuk viszont különbözik (a Pauli-féle kizárási elvnek megfelelően). A szén elektronkonfigurációja és pályadiagramja a következő:
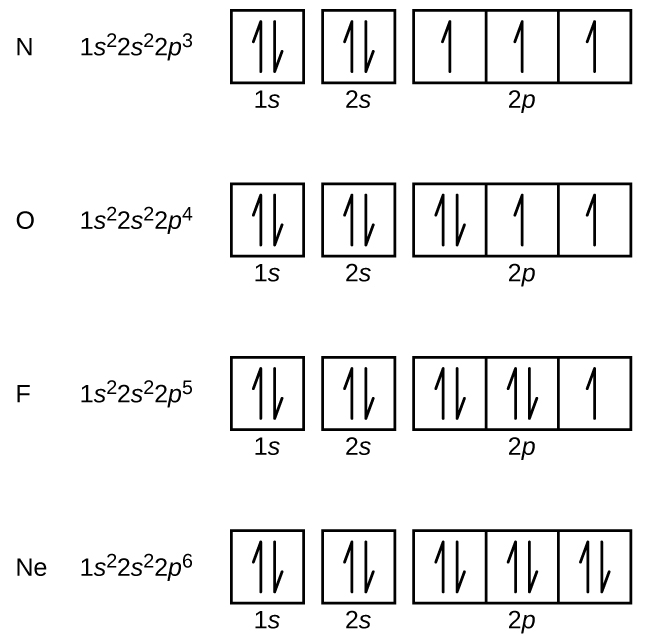
A nitrogén (7-es atomi szám) kitölti az 1s és 2s alhéjakat, és a Hund-szabálynak megfelelően mindhárom 2p pályán van egy-egy elektronja. Ez a három elektron párosítatlan spinnel rendelkezik. Az oxigén (8-as atomi szám) a 2p pályák bármelyikén egy elektronpárral rendelkezik (az elektronoknak ellentétes spinjük van), a másik kettőn pedig egy-egy elektron található. A fluornak (9-es atomi szám) csak egy olyan 2p pályája van, amely párosítatlan elektront tartalmaz. A nemesgáz neon (10-es atomi szám) összes elektronja páros, és az n = 1 és az n = 2 héj összes pályája betöltött. E négy elem elektronkonfigurációi és pályadiagramjai:
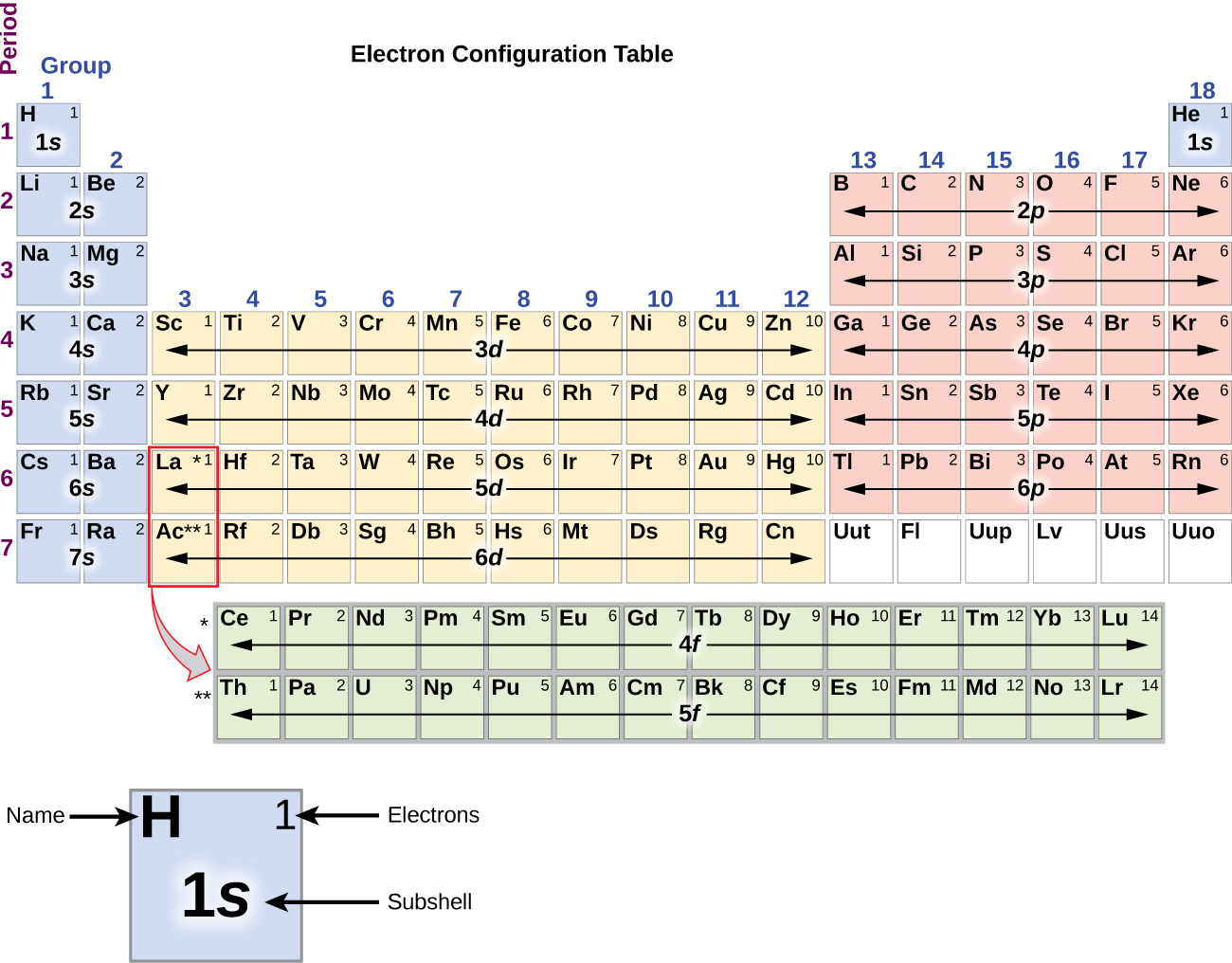
A nátrium alkálifém (11-es atomi szám) eggyel több elektronnal rendelkezik, mint a neonatom. Ennek az elektronnak a rendelkezésre álló legalacsonyabb energiájú alhéjba, a 3s orbitálisba kell kerülnie, ami 1s22s22p63s1 konfigurációt ad. A legkülső héjpálya(ka)t (n legnagyobb értéke) elfoglaló elektronokat valenciaelektronoknak, a belső héjpályákat elfoglaló elektronokat pedig magelektronoknak nevezzük ( \PageIndex5\PageIndex5 ábra). Mivel a magelektronhéjak megfelelnek a nemesgázok elektronkonfigurációinak, az elektronkonfigurációkat úgy rövidíthetjük le, hogy a magelektronkonfigurációnak megfelelő nemesgázt a valenciaelektronokkal együtt, sűrített formában írjuk. A nátrium példánk esetében a magelektronokat jelképező szimbólum (1s22s22p6), a rövidített vagy sűrített konfigurációnk pedig 3s1.

Hasonlóképpen a lítium rövidített konfigurációja 2s1-ként ábrázolható, ahol a héliumatom konfigurációját jelenti, amely megegyezik a lítium töltött belső héjának konfigurációjával. A konfigurációk ilyen módon történő leírása a lítium és a nátrium konfigurációinak hasonlóságát hangsúlyozza. Mindkét, az alkálifémek családjába tartozó atomnak csak egy elektronja van a kitöltött belső héjakon kívül egy valencia s alhéjon.
\}\}\,2s^1\\\ \ce{Na:}\,3s^1\]
A magnézium alkáliföldfém (12-es atomszám), amelynek 12 elektronja 3s2 konfigurációban van, analóg a családtag berillium 2s2 konfigurációjával. Mindkét atomnak van egy kitöltött s alhéj a kitöltött belső héjon kívül. Az alumínium (13-as atomi szám) 13 elektronjával és 3s23p1 elektronkonfigurációjával analóg családtagjával, a bórral (2s22p1).
A szilícium (14 elektron), a foszfor (15 elektron), a kén (16 elektron), a klór (17 elektron) és az argon (18 elektron) elektronkonfigurációi külső héjuk elektronkonfigurációját tekintve analógok a megfelelő családtagjaikkal, a szénnel, a nitrogénnel, az oxigénnel, a fluorral, illetve a neonnal, kivéve, hogy a nehezebb elemek külső héjának fő kvantumszáma eggyel nőtt, n = 3-ra. Az \(\PageIndex{6}\) ábra a legalacsonyabb energiájú, azaz alapállapotú elektronkonfigurációt mutatja ezeknek az elemeknek, valamint az egyes ismert elemek atomjainak konfigurációját.
Amikor a periódusos rendszer következő eleméhez, az alkálifém káliumhoz (19-es atomi szám) érkezünk, azt várhatnánk, hogy elkezdünk elektronokat hozzáadni a 3d alhéjhoz. Azonban minden rendelkezésre álló kémiai és fizikai bizonyíték arra utal, hogy a kálium a lítiumhoz és a nátriumhoz hasonlóan nem a 3d szinthez, hanem a 4s szinthez adódik hozzá a következő elektron (\(\(\PageIndex{3}\) vagy \(\(\PageIndex{4}\) ábra). Mint korábban tárgyaltuk, a sugárirányú csomópontok nélküli 3d pálya energiája magasabb, mivel kevésbé átható és jobban le van árnyékolva az atommagtól, mint a három sugárirányú csomóponttal rendelkező 4s szinté. Így a kálium elektronkonfigurációja 4s1. A kálium tehát valenciahéj-konfigurációját tekintve megfelel a Li-nek és a Na-nak. A következő elektron hozzáadódik a 4s alhéj kiegészítéséhez, és a kalciumnak 4s2 elektronkonfigurációja van. Ezzel a kalcium külső héj elektronkonfigurációja a berillium és a magnézium elektronkonfigurációjának felel meg.
Az átmeneti fém szkandiummal (21-es atomi szám) kezdve további elektronokat adunk hozzá egymás után a 3d alhéjhoz. Ezt az alhéjat 10 elektronnal töltik fel a kapacitása erejéig (ne feledjük, hogy l = 2 esetén 2l + 1 = 5 ml érték van, ami azt jelenti, hogy öt d-orbitális van, amelyek együttes kapacitása 10 elektron). A 4p alhéj töltődik ki legközelebb. Vegyük észre, hogy három elemsorozat esetében, a szkandium (Sc) a réz (Cu), az ittrium (Y) az ezüst (Ag) és a lutécium (Lu) az arany (Au) esetében összesen 10 d elektron kerül egymás után az n héj melletti (n – 1) héjba, hogy az (n – 1) héj 8-ról 18 elektronra emelkedjen. Két sorozat esetében, a lantán (La) a lutetiumon (Lu) keresztül és az aktínium (Ac) a lawrenciumon (Lr) keresztül, 14 f elektron (l = 3, 2l + 1 = 7 ml értékek; tehát hét pálya összesen 14 elektron kapacitással) egymás után hozzáadódik az (n – 2) héjhoz, hogy a héj 18 elektronról összesen 32 elektronra emelkedjen.
Példa \(\PageIndex{1}\): Kvantumszámok és elektronkonfigurációk
Milyen a foszforatom elektronkonfigurációja és pályadiagramja? Mi az utolsó hozzáadott elektron négy kvantumszáma?
Megoldás
A foszfor atomszáma 15. Így egy foszforatom 15 elektront tartalmaz. Az energiaszintek kitöltési sorrendje 1s, 2s, 2p, 3s, 3p, 4s, . . . A foszforatom 15 elektronja a 3p orbitálisig töltődik fel, amely három elektront tartalmaz:
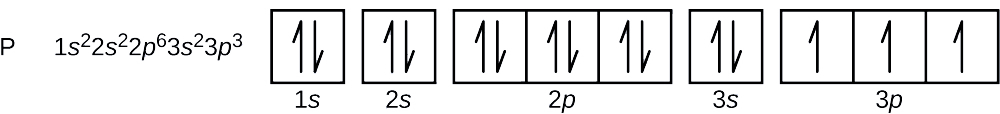
A legutóbb hozzáadott elektron egy 3p elektron. Ezért n = 3, p-típusú orbitál esetén pedig l = 1. Az ml értéke lehet -1, 0 vagy +1 is. A három p-orbitális degenerált, így bármelyik ml-érték helyes. Párosítatlan elektronok esetén a konvenció a spin kvantumszámához \(+\dfrac{1}{2}\) értéket rendel; tehát \(m_s=+\dfrac{1}{2}\).
GYakorlat \(\PageIndex{1}\)
A megadott elektronkonfigurációkból azonosítsuk az atomokat:
- 4s23d5
- 5s24d105p6
Válasz a
Mn
Válasz b
Xe
A periódusos rendszer hatékony eszköz lehet egy elem elektronkonfigurációjának előrejelzésében. Az \(\PageIndex{3}\) vagy \(\PageIndex{4}\) ábrán látható orbitálok kitöltési sorrendje alól azonban találunk kivételeket. Például többek között az átmeneti fémek közül a króm (Cr; 24-es atomi szám) és a réz (Cu; 29-es atomi szám) elektronkonfigurációja nem olyan, mint amilyet várnánk. Az ilyen kivételek általában nagyon hasonló energiájú alhéjakat foglalnak magukban, és kis hatások a kitöltés sorrendjének megváltozásához vezethetnek.
A Cr és a Cu esetében azt találjuk, hogy a félig és teljesen kitöltött alhéjak nyilvánvalóan a preferált stabilitás feltételeit képviselik. Ez a stabilitás olyan, hogy egy elektron a 4s-ből a 3d orbitálisba tolódik, hogy a félig töltött 3d alhéj (Cr-ben) vagy a töltött 3d alhéj (Cu-ban) extra stabilitást nyerjen. Más kivételek is előfordulnak. Például a niobium (Nb, 41-es atomi szám) elektronkonfigurációja 5s24d3. Kísérletileg azt tapasztaljuk, hogy az alapállapotbeli elektronkonfigurációja valójában 5s14d4. Ezt a megfigyelést racionalizálhatjuk azzal, hogy az 5s pályán lévő elektronok párosítása során fellépő elektron-elektron taszítás nagyobb, mint az 5s és 4d pályák közötti energiakülönbség. Nincs egyszerű módszer arra, hogy megjósoljuk a kivételeket olyan atomok esetében, ahol az elektronok közötti taszítások nagysága nagyobb, mint az alhéjak közötti kis energiakülönbségek.