ルイスは、原子の最外殻(価電子帯)にいくつの電子があるかを記録するために、簡単な図(現在はルイス線図と呼ばれる)を使いました。 原子の核と内部の電子を化学記号で表し、価電子だけを化学記号を囲むように点で描いたのである。 したがって、「電子と原子価」の図1に示した3つの原子は、次のルイス図で表すことができる。
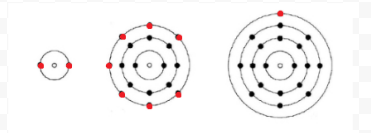

原子が希ガス原子の場合、2つの方法が考えられます。 原子の価電子がゼロであると考えるか、あるいは一番外側の充填殻を価電子殻と見なすかである。 したがって、最初の3つの希ガスは次のように書くことができる:
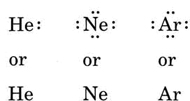
Example(\PageIndex{1}): ルイス構造
次の各元素の原子についてルイス図を描け。 Li, N, F, Na
解答
表紙の周期表から、Liは原子番号3であり、電子が3個あり、希ガスのHeより1個多いことが分かる。 つまり、最外殻(価電子帯)には1個の電子しかなく、ルイス図は
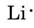
同様の理由で、NはHeより5個多い7個の電子を持ち、FはHeより7個多い9個の電子を持っているので
![]()
NaにはHeより9個多い電子を持っているが、そのうち8個はカーネルにあり、これはNeの最外殻にある8個の電子と対応している。 NaはNeより1個だけ電子が多いので、そのルイス図は
![]()
先の例から、アルカリ金属のルイス図は化学記号を除いて同じであることに気がつきますね。 これはアルカリ金属の化学的挙動が非常に似ていることとよく一致している。 同様に、アルカリ土類やハロゲンなど、他のグループの元素のルイス図もすべて同じです。 上の画像では、アルカリ土類金属はすべて2つの価電子を持ち、それぞれがレウィスドット構造のドットで表されていることがわかります。
ルイス図は、元素の価数を予測するためにも使われることがあります。 ルイスは、原子の価数は価電子帯の電子数、または次の希ガスの電子殻構造を達成するために価電子帯に追加しなければならない電子の数に等しいことを示唆した。 この考え方の例として、BeとOという元素を考えてみましょう。彼らのルイス図と希ガスであるHeとNeのルイス図は

BeとHeを比較すると、前者は電子数が2個多いので価数が2であるべきであることがわかります。 このようにして開発された原子価の規則を用いて、ルイスは原子価の項にある表にある化合物の添え字の規則的な増減を説明することができ、ここに再現した。 さらに彼は、表の中の式の50%以上を説明することができた。 (彼の考えと一致するものは、表の中で色分けされている。 今、その表を参照し、示された公式のいくつかがルイスのルールに従っているかどうかを確認するとよいだろう)。
このような成功にもかかわらず、ルイスの理論には、特に周期表のカルシウムを超える元素について、困難な点も見出される。 たとえば、Br(Z=35)は希ガスのAr(Z=18)よりも17個多く電子を持っている。 このため、Brは17個の価電子を持っていると結論づけられるが、この場合、ClやFは価電子が7個しかないのに、BrがClやFに酷似している理由を説明するのは困難である。
| 元素 | 原子量 | Hydrogen 化合物 | 酸素化合物 | 塩素化合物 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 水素 | 1.01 | H2 | H2O, H2O2 | HCl | ||||||
| Helium | 4.00 | 生成なし | 生成なし | 生成なし | ||||||
| リチウム | 6.94 | LiH | Li2O, Li2O2 | LiCl | ||||||
| Beryllium | 9.ベリリウム | 9.01 | BeH2 | BeO | BeCl2 | |||||
| Boron | 10.81 | B2H6 | B2O3 | BCl3 | ||||||
| Carbon | 12.01 | CH4、C2H6、C3H8 | CO2, CO, C2O3 | CCl4、C2Cl6 | ||||||
| 窒素 | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 | ||||||
| 酸素 | 16.H2O | 16.00 | H2O、H2O2 | O2、O3 | <Cl2O, ClO2、Cl2O7 | |||||
| Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 | ||||||
| Neon | 20.18 | 生成なし | 生成なし | |||||||
| ナトリウム | 22.NaClF3 | 生成なし | 22.99 | NaH | Na2O, Na2O2 | NaCl | ||||
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 | ||||||
| アルミ | 26.98 | AlH3 | Al2O3 | AlCl3 | ||||||
| Silicon | 28.09 | SiH4、Si2H6 | SiO2 | SiCl4、Si2Cl6 | ||||||
| 燐 | 30.97 | PH3、P2H4 | P4O10、P4O6 | PCl3、PCl5、P2Cl4 | ||||||
| Suluf | 32.06 | H2S、H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 | ||||||
| 塩素 | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 | ||||||
| Potassium | 39.HClHClCl2Cl2Photas | KH | K2、K2O2、KO2 | KCl | ||||||
| Argon | 39.95 | 成らず | 成らず | |||||||
| カルシウム | 成らず | CaH2 | CaO, CaO2 | CaCl2 | ||||||
| Scandium | 44.0%。96 | Relatively Unstable | Sc2O3 | ScCl3 | ||||||
| Titanium | 47。90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 | ||||||
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 | ||||||
| クロム | 52.0 | VH2 | クロム | 5.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
寄稿
-
Ed Vitz (Kutztown University)、 John W. John(米国)。 Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
.