The Aufbau Principle
特定の原子の電子配置を決定するには、原子番号順に構造を「構築」すればよいのです。 水素から始まり、周期表の各期間にわたって、すべての元素の電子配置を記述するまで、原子核に陽子を1つずつ、適切な副殻に電子を1つずつ追加していくのです。 この方法は、ドイツ語のAufbau(積み上げる)からAufbauの原理と呼ばれている。 追加された電子は、パウリの排他律によって許容される量子数の制限を受けながら、最もエネルギーの低い部分殻を占めるようになります(図(㊦)の順序)。 電子は低エネルギー側の副殻が満杯になってから高エネルギー側の副殻に入る。 原子軌道の充填順序の覚え方は、図㊤の通りである。 この矢印は、電子配置に適した充填順序で各副殻を導きます。 この図の作り方は簡単です。 s軌道を1列、n殻を1列とすればよい。 p, d, f も同様。量子数で許される軌道だけを入れるようにする(1p, 2d などは入れない)。 最後に、図のように上から下へ斜線を引く。
周期表の配列は電子配置に基づいているので、図(㊦)では別の方法で電子配置を決定している。 充填順序は単純に水素から始まり、Z順に進むと各副殻が含まれます。 例えば、3pブロックをArまで埋めた後、軌道は4s (K, Ca)となり、その後に3d軌道が続くことがわかります。 この周期表は、各副殻の電子配置を示したものである。
ここでは、周期表の第1周期と第2周期にある原子の中から、基底状態の電子配置と軌道図を作成することにします。 軌道図は電子配置を絵で表したもので、個々の軌道と電子の対の配置を表している。 まず、1個の陽子と1個の電子からなる水素原子(原子番号1)から始めます。 図⑭と図⑯のどちらを参照しても、電子は1s軌道にあると考えられます。 慣例として、通常、最初に(m_s=+Θdfrac{1}{2}Θ)の値が埋められます。 電子配置と軌道図は次の通りです:
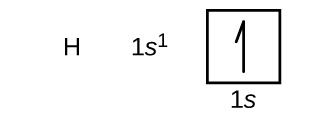
水素に続くのは原子番号2の希ガス、ヘリウムです。 1個目の電子は水素原子の電子と同じ4つの量子数(n=1, l=0, ml=0, \(m_s=+dfrac{1}{2}}) )を持っています。 2個目の電子も1s軌道に入り、その軌道を埋め尽くす。 2番目の電子はn,l,mlの量子数は同じですが、スピン量子数が反対であることが必要で、 \(m_s=-dfrac{1}{2}) となります。 これは、パウリの排他律(同じ原子に存在する2つの電子は同じ4つの量子数を持つことができない)に従っています。 軌道図では、各ボックスに2本の矢印が入り(各軌道の2個の電子を表す)、矢印は反対方向を向いていなければならない(スピンのペアを表す)。 ヘリウムの電子配置と軌道図は次のようになります:
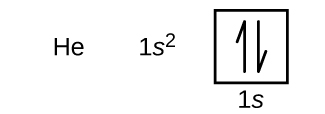
ヘリウム原子のn=1殻は完全に埋まっています。
次の原子は原子番号3のアルカリ金属リチウムで、リチウムの最初の二つの電子は1s軌道を埋め、ヘリウムの二つの電子と同じセットの4量子数を持っています。 残りの電子は、次にエネルギーの低い2s軌道を占めなければなりません(図㊧、㊦)。 したがって、リチウムの電子配置と軌道図は次のようになる:
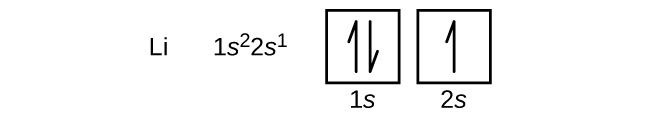
アルカリ土類金属ベリリウムの原子は、原子番号4で、原子核に4個の陽子と原子核を取り巻く4個の電子がある。 2194>
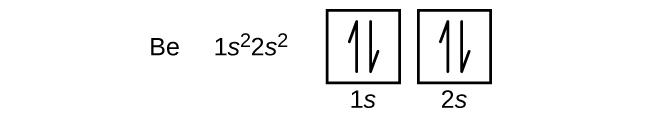
原子番号5のホウ素の原子は、5個の電子を含んでいます。 n=1殻は2個の電子で満たされ、3個の電子がn=2殻を占めることになる。 どのs副殻も2個の電子しか含むことができないので、5個目の電子は次のエネルギー準位を占めなければならず、それは2p軌道となる。 2p軌道には3つの縮退した軌道(ml = -1、0、+1)があり、電子はこれらのp軌道のいずれかを占有することができる。 軌道図を描くときは、充填する部分殻と同じ部分殻に空の軌道があれば、それを表すために空欄を入れます。
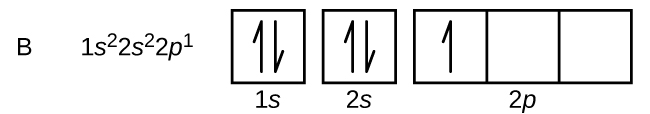
炭素(原子番号6)には6個の電子があります。 そのうち4個は1sと2s軌道を埋めています。 残りの2個の電子は2p副殻を占めます。 2p軌道を埋めて電子を対にするか、対になっていない電子を2つの異なる、しかし縮退したp軌道に残すか、どちらかを選ぶことになります。 縮退した軌道の中で電子を持つ原子にとって最もエネルギーの低い配置は、不対電子の数が最も多い配置である、というフントの法則にしたがって軌道を埋める。 つまり、炭素の2p軌道にある2つの電子は、n、l、msの量子数が同じで、mlの量子数が異なる(パウリの排他律に従う)。 炭素の電子配置と軌道図は次のようになる。
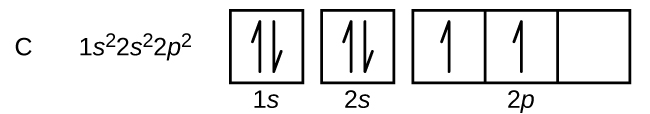
窒素(原子番号7)は1sと2s副殻を満たし、フント則に従って3つの2p軌道にそれぞれ1個の電子を持っている。 この3個の電子はスピンが不対である。 酸素(原子番号8)は、2p軌道のいずれかに2個の電子を持ち(電子は逆スピン)、残りの2個にそれぞれ1個の電子を持つ。 フッ素(原子番号9)は、不対電子を含む2p軌道を1つだけ持っている。 希ガスであるネオン(原子番号10)の電子はすべて対になっており、n=1殻とn=2殻の軌道はすべて埋まっている。 これら4つの元素の電子配置と軌道図は次の通りである:
アルカリ金属のナトリウム(原子番号11)はネオン原子より電子数が1つ多いのです。 この電子は、最もエネルギーの低い 3s 軌道に入る必要があり、1s22s22p63s1 配置となります。 最外殻(nが最も大きい)の軌道を占める電子を価電子、内殻の軌道を占める電子を内殻電子と呼ぶ( 図⑷)。 内殻電子は希ガスの電子配置に対応するため、内殻電子配置に対応する希ガスを価電子とともに凝縮して表記することで電子配置を省略することができる。 ナトリウムの例では、記号は内殻電子を表し、(1s22s22p6)、略記または縮約形は3s1である.

アルカリ土類金属のマグネシウム(原子番号12)は、12個の電子が3s2配置で、同族のベリリウム(2s2)と類似している。 両原子とも内殻の外側にs殻を持つ。 アルミニウム(原子番号13)は13個の電子を持ち、電子配置は3s23p1であり、同族のホウ素(2s22p1)と類似している。
ケイ素(14電子)、リン(15電子)、硫黄(16電子)、塩素(17電子)、アルゴン(18電子)の外殻の電子配置は、重い元素の外殻の主要量子数が1つ増えてn=3になっている以外は、それぞれ同族の炭素、窒素、酸素、フッ素、ネオンと相似形である。 これらの元素の最低エネルギー(基底状態)の電子配置と、既知の各元素の原子の電子配置を図㊤に示す。 この周期表は、各元素の外殻の電子配置を示したものです。
次にアルカリ金属のカリウム(原子番号19)になると、3d殻に電子を追加していくと思われるかもしれません。 しかし、カリウムはリチウムやナトリウムと同じで、次の電子は3d準位に追加されず、4s準位に追加されることが、あらゆる化学的・物理的証拠から示されています(図(㊦)、図(㊧))。 前述したように、半径方向の節がない3d軌道は、半径方向の節が3つある4sに比べて原子核への侵入が少なく、遮蔽されているため、エネルギーが高くなる。 したがって、カリウムの電子配置は4s1である。 したがって、カリウムは価電子帯構成がLiやNaに相当する。 次の電子が加わって4s副殻が完成し、カルシウムの電子配置は4s2となる。
遷移金属スカンジウム(原子番号21)からは、3d副殻に順次電子が追加されるようになりました。 この副殻は10個の電子で満たされます(l = 2の場合、mlの値は2l + 1 = 5であり、合わせて10個の電子を持つ5つのd軌道があることを意味することを思い出してください)。 次に4p副殻が埋まる。 スカンジウム(Sc)から銅(Cu)、イットリウム(Y)から銀(Ag)、ルテチウム(Lu)から金(Au)の3系列の元素では、n殻の隣の(n – 1)殻に合計10個のd電子を順次追加して、(n – 1)殻の電子数を8から18にしていることに注意しましょう。 ランタン(La)~ルテチウム(Lu)、アクチニウム(Ac)~ローレンシウム(Lr)の2系列では、(n – 2)殻にf電子(l = 3, 2l + 1 = 7ml値、つまり7軌道で14電子)14個を順次加えて、18電子から合計32電子にする。 量子数と電子配置
リン原子の電子配置と軌道図はどうなっていますか? また、最後に加わった電子の4つの量子数を答えよ。
解答 リンの原子番号は15である。 したがって、リン原子は15個の電子を含んでいる。 エネルギー準位の充填順序は、1s, 2s, 2p, 3s, 3p, 4s, …である。 リン原子の15個の電子は3p軌道まで充填され、3個の電子を含むことになります:
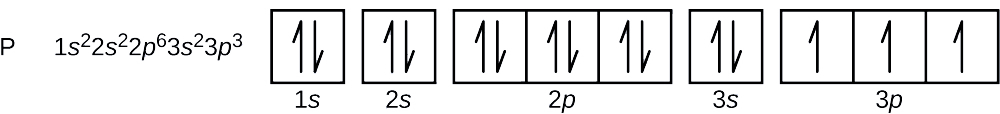
最後に加えられた電子は3p電子となるのです。 したがって、n=3であり、p型軌道の場合、l=1である。 mlの値は-1、0、または+1である可能性があります。 3つのp軌道は縮退しているので、mlの値はどれでも正しい。 不対電子の場合、スピン量子数には慣例的に \(+dfrac{1}{2}) が割り当てられるので、 \(m_s=+dfrac{1}{2}) となります。
Exercise ㊦
与えられた電子配置から原子を同定せよ。
- 4s23d5
- 5s24d105p6
答え a
Mn
答え b
Xe
周期表は元素の電子配置を予想する上で有力なツールとなり得るものです。 しかし、図のような軌道の充填順序の例外も見受けられます。 例えば、遷移金属のクロム(Cr:原子番号24)や銅(Cu:原子番号29)などの電子配置は、私たちが期待するものとは異なっている。 一般に、このような例外は非常に似たエネルギーの部分殻を含んでおり、小さな効果で充填の順番が変わってしまう。
CrとCuの場合、半分充填と完全充填は明らかに好ましい安定性の条件を表していることがわかった。 この安定性は電子が4sから3d軌道にシフトして、半分埋まった3d副殻(Crの場合)または埋まった3d副殻(Cuの場合)の余分な安定性を得るようなものである。 その他の例外もある。 例えば、ニオブ(Nb、原子番号41)の電子配置は5s24d3と予測されています。 しかし、実験的には、ニオブの基底状態の電子配置は5s14d4であることが分かっている。 これは、5s軌道の電子が対になることで生じる電子間反発が、5s軌道と4d軌道の間のエネルギー差よりも大きいためと考えられる。 電子間の反発の大きさが、副殻間のわずかなエネルギー差よりも大きい原子の例外を予測する簡単な方法はない
。