Lewis użył prostych diagramów (obecnie nazywanych diagramami Lewisa), aby śledzić, ile elektronów było obecnych w najbardziej zewnętrznej, lub walencyjnej, powłoce danego atomu. J±dro atomu, tj. j±dro wraz z wewnętrznymi elektronami, jest reprezentowane przez symbol chemiczny, a tylko elektrony walencyjne s± narysowane jako kropki otaczaj±ce symbol chemiczny. Tak więc trzy atomy pokazane na rysunku 1 z książki Electrons and Valence mogą być reprezentowane przez następujące diagramy Lewisa:
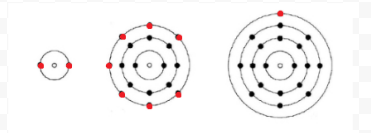

Jeżeli atom jest atomem gazu szlachetnego, możliwe są dwie alternatywne procedury. Albo możemy uznać, że atom ma zero elektronów walencyjnych, albo możemy uznać najbardziej zewnętrzn± wypełnion± powłokę za powłokę walencyjn±. Pierwsze trzy gazy szlachetne mogą być więc zapisane jako:
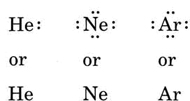
Przykład: Struktury Lewisa
Narysuj diagramy Lewisa dla atomu każdego z następujących pierwiastków: Li, N, F, Na
Rozwiązanie
Z układu okresowego znajdującego się wewnątrz przedniej okładki dowiadujemy się, że Li ma liczbę atomową 3. Zawiera zatem trzy elektrony, o jeden więcej niż gaz szlachetny He. Oznacza to, że najbardziej zewnętrzna lub walencyjna powłoka zawiera tylko jeden elektron, a diagram Lewisa jest
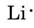
Postępując w ten sam sposób, N ma siedem elektronów, pięć więcej niż He, podczas gdy F ma dziewięć elektronów, siedem więcej niż He, co daje
![]()
Na ma dziewięć elektronów więcej niż He, ale osiem z nich jest w jądrze, co odpowiada ośmiu elektronom w najbardziej zewnętrznej powłoce Ne. Ponieważ Na ma tylko 1 elektron więcej niż Ne, jego diagram Lewisa to
![]()
Zauważ na poprzednim przykładzie, że diagramy Lewisa metali alkalicznych są identyczne z wyjątkiem ich symboli chemicznych. Zgadza się to z bardzo podobnym zachowaniem chemicznym metali alkalicznych. Podobnie, diagramy Lewisa dla wszystkich pierwiastków w innych grupach, takich jak metale ziem alkalicznych lub chlorowce, wyglądają tak samo.
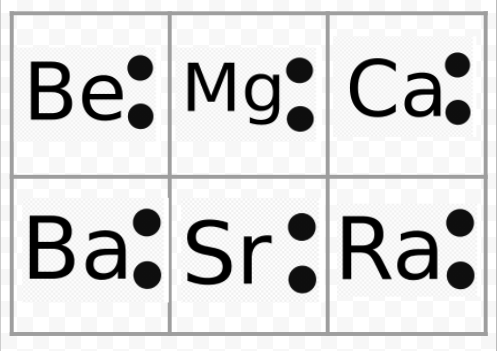
Schematy Lewisa mogą być również wykorzystane do przewidywania wartościowości pierwiastków. Lewis zasugerował, że liczba walencyjności atomu jest równa liczbie elektronów w jego powłoce walencyjnej lub liczbie elektronów, które musiałyby być dodane do powłoki walencyjnej, aby osiągnąć strukturę powłoki elektronicznej następnego gazu szlachetnego. Jako przykład tej idei, rozważmy pierwiastki Be i O. Ich diagramy Lewisa i diagramy gazów szlachetnych He i Ne są

Porównując Be z He, widzimy, że ten pierwszy ma dwa elektrony więcej i dlatego powinien mieć walencję 2. Można by oczekiwać, że pierwiastek O będzie miał walencję 6 lub walencję 2, ponieważ ma sześć elektronów walencyjnych – dwa mniej niż Ne. Używając zasad walencyjnych opracowanych w ten sposób, Lewis był w stanie wyjaśnić regularne zwiększanie i zmniejszanie indeksów związków w tabeli znajdującej się w sekcji Walencja i odtworzonej tutaj. Ponadto był on w stanie wyjaśnić ponad 50 procent wzorów w tabeli. (Te, które zgadzają się z jego pomysłami są cieniowane w kolorze w tabeli. Możesz teraz odwołać się do tej tabeli i sprawdzić, czy niektóre ze wskazanych wzorów są zgodne z regułami Lewisa). Sukces Lewisa w tym związku dał wyraźną wskazówkę, że elektrony były najważniejszym czynnikiem utrzymującym atomy razem, gdy tworzyły się cząsteczki.
Pomimo tych sukcesów, istnieją również trudności, które można znaleźć w teoriach Lewisa, w szczególności dla pierwiastków poza wapniem w układzie okresowym. Element Br (Z = 35), na przykład, ma 17 więcej elektronów niż gaz szlachetny Ar (Z = 18). To prowadzi nas do wniosku, że Br ma 17 elektronów walencyjnych, co sprawia, że niezręcznie jest wyjaśnić, dlaczego Br tak bardzo przypomina Cl i F, mimo że te dwa atomy mają tylko siedem elektronów walencyjnych.
| Element | Waga atomowa | Wodór Związki | Związki tlenu | Związki chloru |
|---|---|---|---|---|
| Wodór | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | Nie powstaje | Nie powstaje | Nie powstaje |
| Lit | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryl | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Węgiel | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Tlen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Nie powstaje | Nie powstaje | Nie powstaje |
| Sód | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnez | 24.31 | MgH2 | MgO | MgCl2 |
| Glin | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Krzem | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Fosfor | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Siarka | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlor | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potas | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | Nie powstaje | Nie powstaje | Nie powstaje |
| Wapń | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relatively Unstable | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Wanad | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chrom | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Wydawcy
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
.