Zasada Aufbau
Aby określić konfigurację elektronową dla każdego konkretnego atomu, możemy „zbudować” struktury w kolejności liczb atomowych. Zaczynając od wodoru i kontynuując przez kolejne okresy układu okresowego, dodajemy po jednym protonie do jądra i po jednym elektronie do odpowiedniej podpowłoki, aż opiszemy konfiguracje elektronowe wszystkich pierwiastków. Procedura ta nazywana jest zasadą Aufbau, od niemieckiego słowa Aufbau („budować”). Każdy dodany elektron zajmuje podpowłokę o najniższej dostępnej energii (w kolejności pokazanej na rysunku), z zastrzeżeniem ograniczeń narzuconych przez dozwolone liczby kwantowe zgodnie z zasadą wykluczania Pauliego. Elektrony wchodzą do podpowłok o wyższej energii dopiero po całkowitym wypełnieniu podpowłok o niższej energii. Rysunek ilustruje tradycyjny sposób zapamiętywania kolejności zapełniania orbitali atomowych.
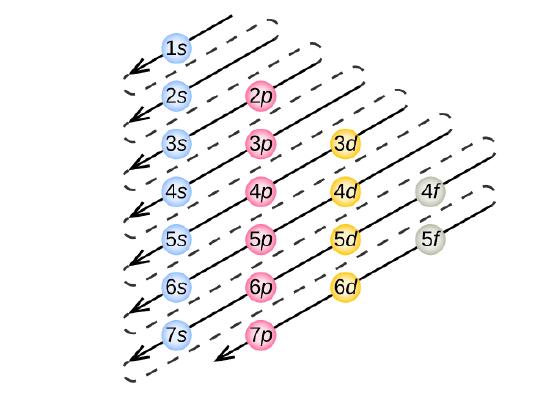
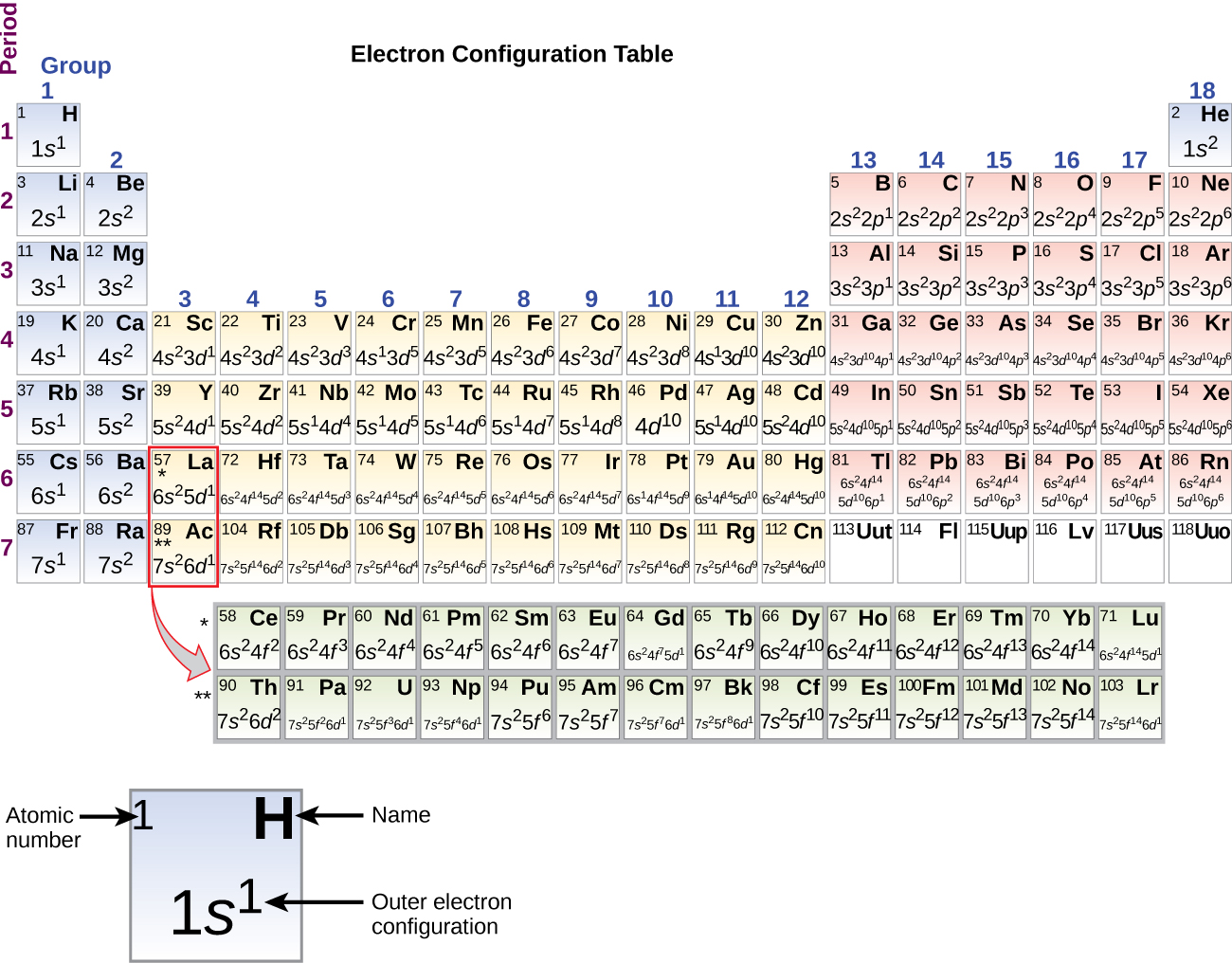
Ponieważ układ okresowy jest oparty na konfiguracjach elektronowych, rysunek przedstawia alternatywną metodę określania konfiguracji elektronowej. Kolejność wypełniania po prostu zaczyna się od wodoru i obejmuje każdą podpowłokę, jak postępować w rosnącej kolejności Z. Na przykład, po wypełnieniu bloku 3p aż do Ar, widzimy, że orbital będzie 4s (K, Ca), a następnie orbitale 3d.
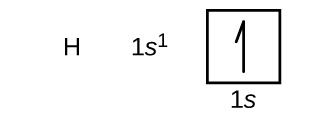
Skonstruujemy teraz konfigurację elektronową stanu podstawowego i diagram orbitalny dla wybranych atomów z pierwszego i drugiego okresu układu okresowego. Diagramy orbitalne są obrazowym przedstawieniem konfiguracji elektronowej, pokazującym poszczególne orbitale i układ par elektronów. Zaczynamy od pojedynczego atomu wodoru (liczba atomowa 1), który składa się z jednego protonu i jednego elektronu. Odnosząc się do rysunku \(\PageIndex{3}) lub \(\PageIndex{4}), spodziewalibyśmy się znaleźć elektron na orbitalu 1s. Zgodnie z konwencją, wartość m_s=+dfrac{1}{2}} jest zwykle wypełniana jako pierwsza. Konfiguracja elektronowa i diagram orbitali są następujące:
Po wodorze występuje gaz szlachetny hel, który ma liczbę atomową 2. Atom helu zawiera dwa protony i dwa elektrony. Pierwszy elektron ma takie same cztery liczby kwantowe jak elektron atomu wodoru (n = 1, l = 0, ml = 0, m_s=+dfrac{1}{2}}). Drugi elektron również trafia na orbital 1s i wypełnia ten orbital. Drugi elektron ma takie same liczby kwantowe n, l i ml, ale musi mieć przeciwną spinową liczbę kwantową, \(m_s=-dfrac{1}{2}}}). Jest to zgodne z zasadą wykluczenia Pauliego: żadne dwa elektrony w tym samym atomie nie mogą mieć tego samego zestawu czterech liczb kwantowych. Dla diagramów orbitalnych oznacza to, że w każde pole wchodzą dwie strzałki (reprezentujące dwa elektrony w każdym orbitalu) i strzałki muszą być skierowane w przeciwnych kierunkach (reprezentujące sparowane spiny). Konfiguracja elektronowa i diagram orbitalny helu są następujące:
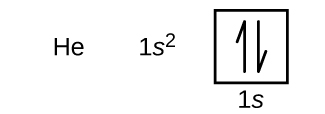
Powłoka n = 1 jest całkowicie wypełniona w atomie helu.
Następnym atomem jest metal alkaliczny lit o liczbie atomowej 3. Pierwsze dwa elektrony w litu wypełniają orbitale 1s i mają takie same zestawy czterech liczb kwantowych jak dwa elektrony w helu. Pozostały elektron musi zajmować orbital o najniższej energii, orbital 2s (rysunek ¨(¨PageIndex{3}¨) lub ¨(¨PageIndex{4}¨)). Tak więc konfiguracja elektronowa i diagram orbitali litu są następujące:
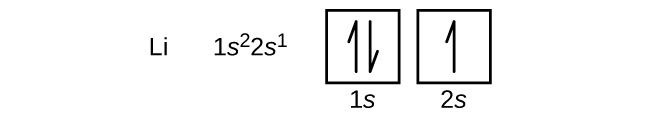
An atom metalu ziem alkalicznych berylu, o liczbie atomowej 4, zawiera cztery protony w jądrze i cztery elektrony otaczające jądro. Czwarty elektron wypełnia pozostałe miejsce na orbitalu 2s.
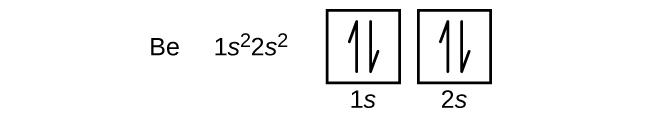
An atom berylu (liczba atomowa 5) zawiera pięć elektronów. Powłoka n = 1 jest wypełniona dwoma elektronami, a trzy elektrony będą zajmować powłokę n = 2. Ponieważ każda podpowłoka s może zawierać tylko dwa elektrony, piąty elektron musi zająć następny poziom energetyczny, który będzie orbitalem 2p. Istnieją trzy zdegenerowane orbitale 2p (ml = -1, 0, +1) i elektron może zająć dowolny z tych orbitali. Rysując diagramy orbitalne, dołączamy puste pola, aby zobrazować wszelkie puste orbitale w tej samej podpowłoce, którą wypełniamy.
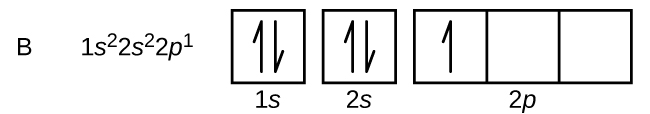
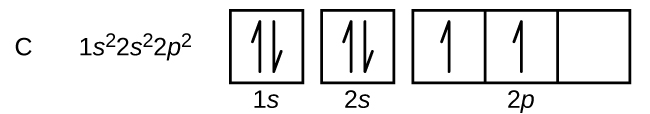
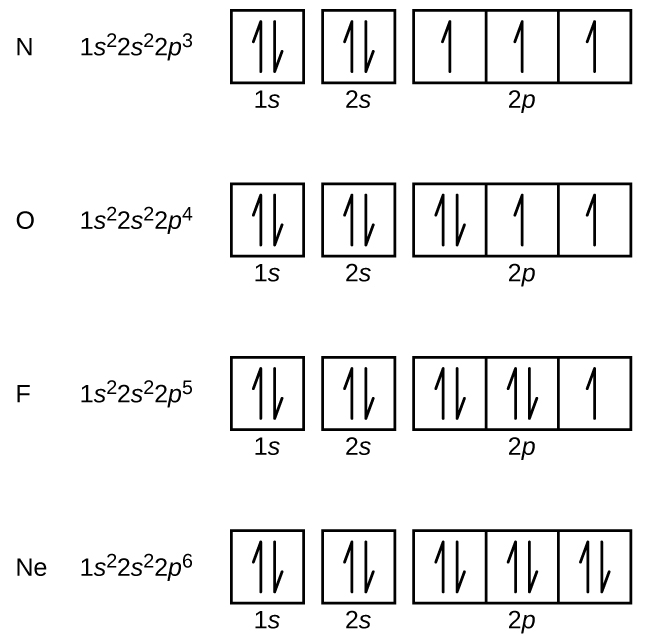
Węgiel (liczba atomowa 6) ma sześć elektronów. Cztery z nich wypełniają orbitale 1s i 2s. Pozostałe dwa elektrony zajmują podpowłoki 2p. Mamy teraz do wyboru wypełnić jeden z orbitali 2p i sparować elektrony lub pozostawić elektrony niesparowane na dwóch różnych, ale zdegenerowanych orbitalach p. Orbitale są zapełniane zgodnie z regułą Hunda: najniżejenergetyczną konfiguracją dla atomu z elektronami wewnątrz zestawu zdegenerowanych orbitali jest ta, która posiada maksymalną liczbę niesparowanych elektronów. Tak więc, dwa elektrony na orbitalach węgla 2p mają identyczne liczby kwantowe n, l, i ms, a różnią się liczbą kwantową ml (zgodnie z zasadą wykluczania Pauliego). Konfiguracja elektronowa i diagram orbitali dla węgla są następujące:
Atrogen (liczba atomowa 7) wypełnia podpowłoki 1s i 2s i ma po jednym elektronie na każdym z trzech orbitali 2p, zgodnie z regułą Hunda. Te trzy elektrony mają niesparowane spiny. Tlen (liczba atomowa 8) ma parę elektronów na jednym z orbitali 2p (elektrony mają przeciwne spiny) i pojedynczy elektron na każdym z dwóch pozostałych. Fluor (liczba atomowa 9) ma tylko jeden orbital 2p zawierający niesparowany elektron. Wszystkie elektrony w gazie szlachetnym neonie (liczba atomowa 10) są sparowane, a wszystkie orbitale w powłokach n = 1 i n = 2 są wypełnione. Konfiguracje elektronowe i diagramy orbitalne tych czterech pierwiastków to:
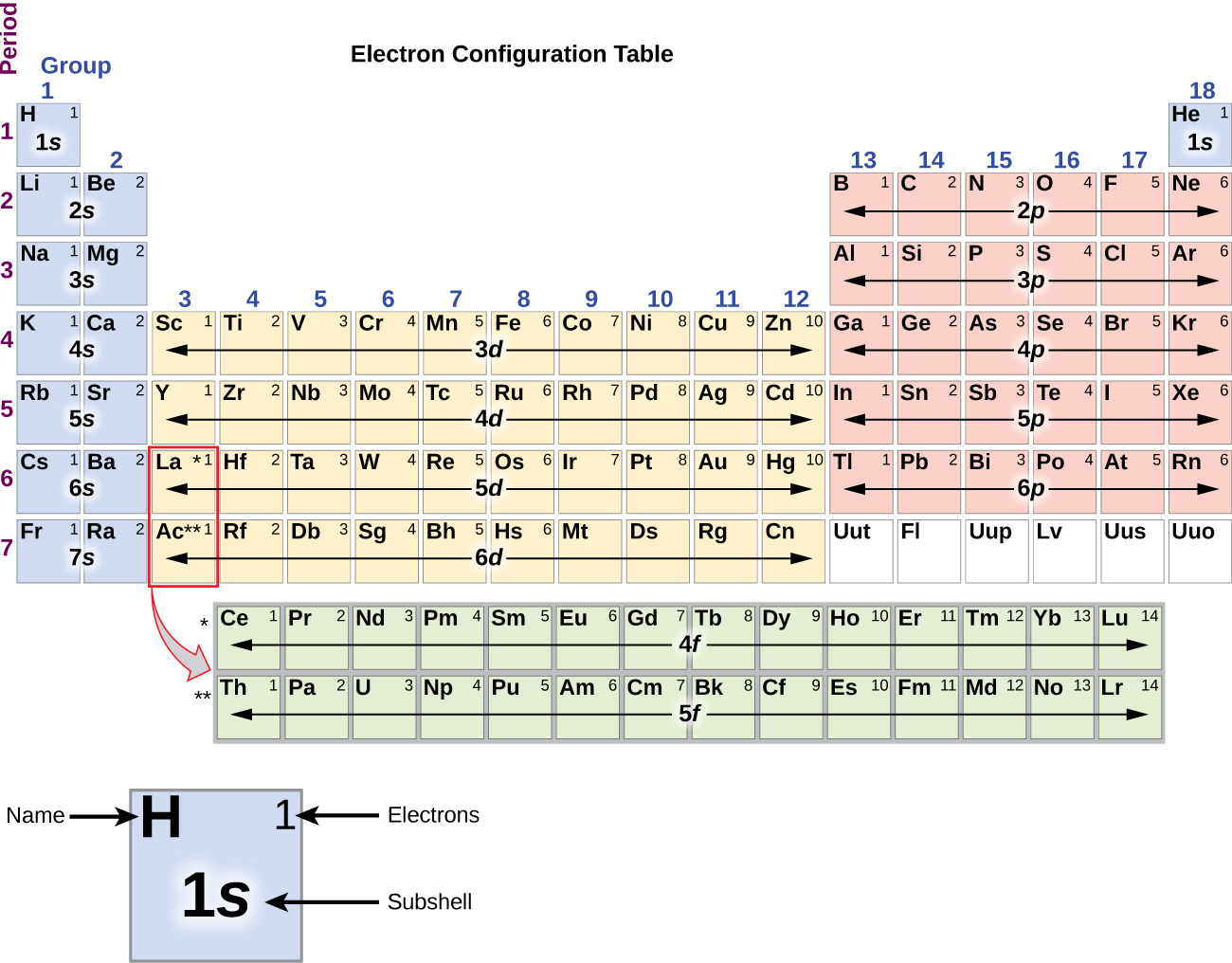
Metal alkaliczny sód (liczba atomowa 11) ma jeden elektron więcej niż atom neonu. Elektron ten musi przejść do najniższej dostępnej podpowłoki energetycznej, orbitalu 3s, co daje konfigurację 1s22s22p63s1. Elektrony zajmuj±ce najbardziej zewnętrzne orbitale powłoki (najwyższa warto¶ć n) s± nazywane elektronami walencyjnymi, a te zajmuj±ce wewnętrzne orbitale powłoki s± nazywane elektronami rdzeniowymi (rysunek 5). Ponieważ powłoki elektronowe rdzenia odpowiadają konfiguracjom elektronowym gazów szlachetnych, możemy skrócić konfiguracje elektronowe pisząc gaz szlachetny, który odpowiada konfiguracji elektronów rdzenia, wraz z elektronami walencyjnymi w skondensowanym formacie. Dla naszego przykładu sodu, symbol reprezentuje elektrony rdzenia, (1s22s22p6) i nasza skrócona lub skondensowana konfiguracja to 3s1.

Podobnie, skrócona konfiguracja litu może być przedstawiona jako 2s1, gdzie reprezentuje konfigurację atomu helu, która jest identyczna z konfiguracją wypełnionej powłoki wewnętrznej litu. Zapisanie konfiguracji w ten sposób podkreśla podobieństwo konfiguracji litu i sodu. Oba atomy, należące do rodziny metali alkalicznych, mają tylko jeden elektron w podpowłoce walencyjnej s poza wypełnionym zestawem powłok wewnętrznych.
Magnez ziem alkalicznych (liczba atomowa 12), ze swoimi 12 elektronami w konfiguracji 3s2, jest analogiczny do członka rodziny berylu, 2s2. Oba atomy mają wypełnioną podpowłokę s poza wypełnionymi powłokami wewnętrznymi. Aluminium (liczba atomowa 13), z 13 elektronów i konfiguracji elektronowej 3s23p1, jest analogiczny do jego członka rodziny bor, 2s22p1.
Konfiguracje elektronowe krzemu (14 elektronów), fosforu (15 elektronów), siarki (16 elektronów), chloru (17 elektronów) i argonu (18 elektronów) są analogiczne w konfiguracjach elektronowych ich zewnętrznych powłok do odpowiadających im członków rodziny odpowiednio węgla, azotu, tlenu, fluoru i neonu, z wyjątkiem tego, że główna liczba kwantowa zewnętrznej powłoki cięższych elementów wzrosła o jeden do n = 3. Rysunek pokazuje najniższą energię lub konfigurację elektronową stanu podstawowego dla tych pierwiastków, jak również dla atomów każdego ze znanych pierwiastków.
Kiedy dochodzimy do następnego pierwiastka w układzie okresowym, metalu alkalicznego potasu (liczba atomowa 19), moglibyśmy oczekiwać, że zaczniemy dodawać elektrony do podpowłoki 3d. Jednakże, wszystkie dostępne dowody chemiczne i fizyczne wskazują, że potas jest jak lit i sód, i że następny elektron nie jest dodawany do poziomu 3d, ale zamiast tego jest dodawany do poziomu 4s (Rysunek \(\PageIndex{3}\) lub \(\PageIndex{4}\). Jak omówiono wcześniej, orbital 3d bez węzłów radialnych ma wyższą energię, ponieważ jest mniej penetrujący i bardziej osłonięty od jądra niż 4s, który ma trzy węzły radialne. Potas ma więc konfigurację elektronową 4s1. Potas odpowiada więc Li i Na w konfiguracji powłoki walencyjnej. Następny elektron jest dodawany w celu uzupełnienia podpowłoki 4s i wapń ma konfigurację elektronową 4s2. To daje wapnia konfiguracji elektronowej zewnętrznej powłoki odpowiadającej berylu i magnezu.
Zaczynając od metalu przejściowego skandu (liczba atomowa 21), dodatkowe elektrony są dodawane sukcesywnie do 3d podpowłoki. Ta podpowłoka jest wypełniona do swojej pojemności 10 elektronami (pamiętajmy, że dla l = 2 , jest 2l + 1 = 5 wartości ml, co oznacza, że jest pięć orbitali d, które mają łączną pojemność 10 elektronów). Następna wypełnia się podpowłoka 4p. Zauważ, że dla trzech serii pierwiastków, skandu (Sc) przez miedź (Cu), itru (Y) przez srebro (Ag) i lutetu (Lu) przez złoto (Au), w sumie 10 elektronów d jest kolejno dodawanych do (n – 1) powłoki obok powłoki n, aby doprowadzić (n – 1) powłoki od 8 do 18 elektronów. Dla dwóch serii, lantanu (La) przez lutet (Lu) i aktynu (Ac) przez lawrencium (Lr), 14 elektronów f (l = 3, 2l + 1 = 7 wartości ml; tak więc, siedem orbitali o łącznej pojemności 14 elektronów) jest kolejno dodawanych do (n – 2) powłoki, aby doprowadzić tę powłokę z 18 elektronów do całkowitej liczby 32 elektronów.
Przykład: Quantum Numbers and Electron Configurations
Jaka jest konfiguracja elektronowa i diagram orbitali dla atomu fosforu? Jakie są cztery liczby kwantowe dla ostatniego dodanego elektronu?
Rozwiązanie
Liczba atomowa fosforu wynosi 15. Zatem atom fosforu zawiera 15 elektronów. Kolejność zapełniania poziomów energetycznych to 1s, 2s, 2p, 3s, 3p, 4s, … . 15 elektronów atomu fosforu wypełni się aż do orbitalu 3p, który będzie zawierał trzy elektrony:
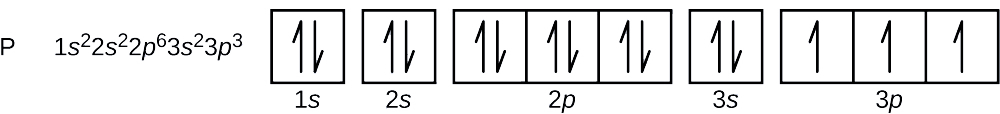
Ostatni dodany elektron jest elektronem 3p. Zatem n = 3, a dla orbitalu typu p, l = 1. Wartość ml może być -1, 0, lub +1. Trzy orbitale p są zdegenerowane, więc każda z tych wartości ml jest poprawna. Dla niesparowanych elektronów, konwencja przypisuje wartość \(+dfrac{1}{2}}\) dla spinowej liczby kwantowej; tak więc \(m_s=+\dfrac{1}{2}\).
Ćwiczenie \(\PageIndex{1}})
Zidentyfikuj atomy na podstawie podanych konfiguracji elektronowych:
- 4s23d5
- 5s24d105p6
Odpowiedź a
Mn
Odpowiedź b
Xe
Układ okresowy może być potężnym narzędziem w przewidywaniu konfiguracji elektronowej pierwiastka. Znajdujemy jednak wyjątki od kolejności wypełniania orbitali, które są pokazane na rysunku \(\PageIndex{3}\) lub \(\PageIndex{4}\). Na przykład, konfiguracje elektronowe metali przejściowych, między innymi chromu (Cr; liczba atomowa 24) i miedzi (Cu; liczba atomowa 29), nie są takie, jakich byśmy oczekiwali. Ogólnie rzecz biorąc, takie wyjątki dotyczą podpowłok o bardzo podobnej energii, a małe efekty mogą prowadzić do zmian w kolejności wypełnienia.
W przypadku Cr i Cu, znajdujemy, że w połowie wypełnione i całkowicie wypełnione podpowłoki najwyraźniej reprezentują warunki preferowanej stabilności. Stabilność ta jest taka, że elektron przesuwa się z 4s do orbitalu 3d, aby uzyskać dodatkową stabilność w połowie wypełnionej podpowłoce 3d (w Cr) lub wypełnionej podpowłoce 3d (w Cu). Inne wyjątki również występują. Na przykład, niob (Nb, liczba atomowa 41) ma według przewidywań konfigurację elektronową 5s24d3. Doświadczalnie obserwujemy, że jego konfiguracja elektronowa w stanie podstawowym jest w rzeczywistości 5s14d4. Możemy zracjonalizować tę obserwację mówiąc, że odpychanie elektronowo-elektronowe doświadczane przez parowanie elektronów na orbitalu 5s jest większe niż różnica energii pomiędzy orbitalami 5s i 4d. Nie ma prostej metody, aby przewidzieć wyjątki dla atomów, gdzie wielkość odpychania pomiędzy elektronami jest większa niż małe różnice w energii pomiędzy podpowłokami.