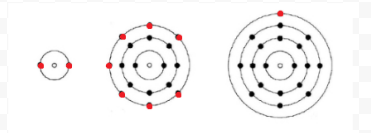
Lewis usou diagramas simples (agora chamados de diagramas de Lewis) para manter um registro de quantos elétrons estavam presentes na casca mais externa, ou valência, de um determinado átomo. O núcleo do átomo, ou seja, o núcleo junto com os elétrons internos, é representado pelo símbolo químico, e apenas os elétrons de valência são desenhados como pontos ao redor do símbolo químico. Assim, os três átomos mostrados na Figura 1 dos elétrons e valência podem ser representados pelos seguintes diagramas de Lewis:

Se o átomo for um átomo de gás nobre, dois procedimentos alternativos são possíveis. Ou podemos considerar que o átomo tem zero elétrons de valência ou podemos considerar a casca de enchimento mais externa como a casca de valência. Os três primeiros gases nobres podem assim ser escritos como:
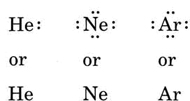
Exemplo {1}(PageIndex{1}}): Lewis Structures
Desenhar diagramas de Lewis para um átomo de cada um dos seguintes elementos: Li, N, F, Na
Solução
Nós encontramos na tabela periódica dentro da tampa frontal que Li tem um número atómico de 3. Assim, ele contém três electrões, um a mais do que o gás nobre He. Isto significa que a casca mais externa, ou valência, contém apenas um elétron, e o diagrama de Lewis é
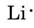
Seguindo o mesmo raciocínio, N tem sete elétrons, cinco a mais que Ele, enquanto F tem nove elétrons, sete a mais que Ele, dando
![]()
Na tem nove elétrons a mais que Ele, mas oito deles estão no núcleo, correspondendo aos oito elétrons da casca mais externa de Ne. Como Na tem apenas mais 1 elétron que Ne, seu diagrama de Lewis é
![]()
Nota do exemplo anterior que os diagramas de Lewis dos metais alcalinos são idênticos, exceto por seus símbolos químicos. Isto concorda bem com o comportamento químico muito semelhante dos metais alcalinos. Da mesma forma, os diagramas de Lewis para todos os elementos de outros grupos, como as terras alcalinas ou halogéneos, têm a mesma aparência.
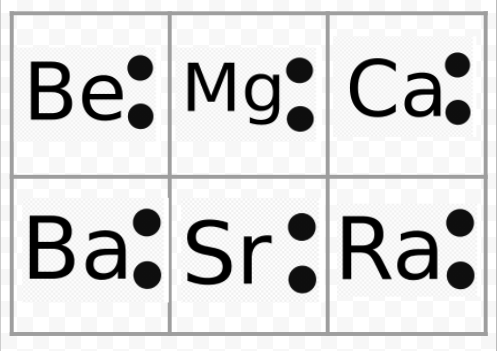
Os diagramas de Lewis também podem ser usados para prever as valências dos elementos. Lewis sugeriu que o número de valências de um átomo era igual ao número de elétrons em sua casca de valência ou ao número de elétrons que teriam que ser adicionados à casca de valência para atingir a estrutura da casca eletrônica do próximo gás nobre. Como exemplo desta idéia, consideremos os elementos Be e O. Seus diagramas de Lewis e os dos gases nobres He e Ne são
Comparando Be com He, vemos que o primeiro tem mais dois elétrons e portanto deveria ter uma valência de 2. O elemento O poderia ter uma valência de 6 ou uma valência de 2 já que tem seis valências de elétrons – dois a menos que Ne. Usando regras de valência desenvolvidas desta forma, Lewis foi capaz de contabilizar o aumento e a diminuição regular das subscrições dos compostos na tabela encontrada na secção Valência, e reproduzida aqui. Além disso, ele foi capaz de responder por mais de 50% das fórmulas da tabela. (As que concordam com suas idéias são sombreadas em cores na tabela. Você pode querer consultar essa tabela agora e verificar se algumas das fórmulas indicadas seguem as regras de Lewis). O sucesso de Lewis nesta conexão deu uma clara indicação de que os elétrons foram o fator mais importante para manter os átomos juntos quando as moléculas se formaram.
Apesar destes sucessos, também há dificuldades nas teorias de Lewis, em particular para elementos além do cálcio na tabela periódica. O elemento Br (Z = 35), por exemplo, tem 17 elétrons a mais do que o gás nobre Ar (Z = 18). Isto nos leva a concluir que o Br tem 17 elétrons de valência, o que torna estranho explicar por que o Br se assemelha tanto ao Cl e ao F, ainda que estes dois átomos tenham apenas sete elétrons de valência.
| Element | Peso Atómico | Hidrogénio Compostos | Compostos de Oxigénio | Compostos de Cloro |
|---|---|---|---|---|
| Hidrogénio | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | Nenhum formado | Nenhum formado | Nenhum formado |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boro | 10.81 | B2H6 | B2O3 | BCl3 |
| Carvão | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogénio | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Nenhuma formada | Nenhuma formada | Nenhum formada |
| Sódio | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnésio | 24.31 | MgH2 | MgO | MgCl2 |
| Alumínio | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silício | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Fósforo | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Sulfur | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Cloro | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potássio | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | Nenhum formado | Nenhum formado | Nenhum formado |
| Cálcio | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relativamente instável | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanádio | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Cromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contribuintes
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, e Adam Hahn.