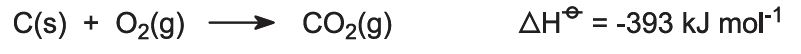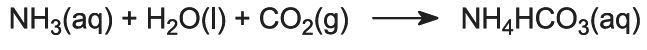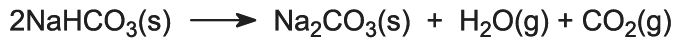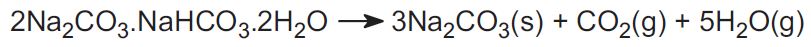- Usos de carbonato de sódio
- Produção anual de carbonato de sódio
- Fabricação de carbonato de sódio
- (a) de cloreto de sódio e carbonato de cálcio
- (1) Amoniação da salmoura
- (2) Formação de óxido de cálcio e dióxido de carbono
- (3) A Torre Solvay
- (4) Separação de hidrocarboneto de sódio sólido
- (5) Formação de carbonato de sódio
- (6) Formação do hidróxido de cálcio
- (7) Regeneração de amônia
- (b) De minérios trona e nahcolite
Usos de carbonato de sódio
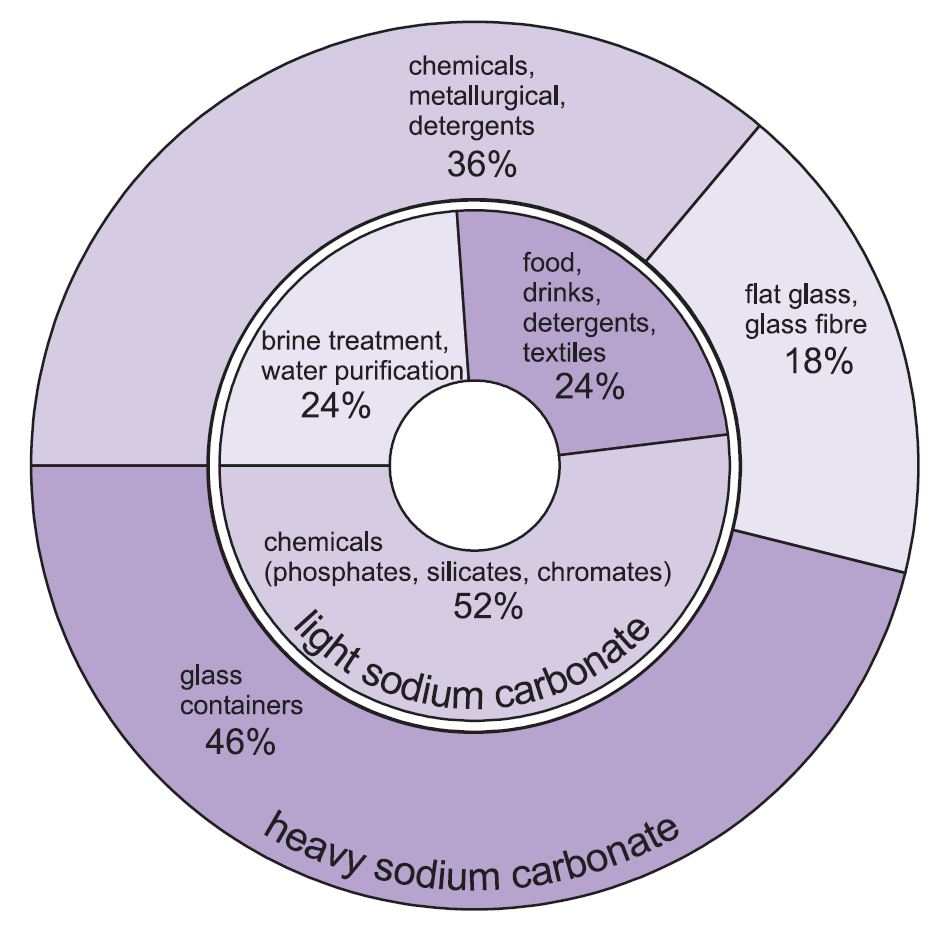
Duas formas de carbonato de sódio (cinza de soda) são usadas -pesado e leve. A forma leve é obtida primeiro e algumas são depois convertidas na forma pesada. O carbonato de sódio leve contém menos de 0,5% de cloreto de sódio. O carbonato de sódio pesado é obtido hidratando o carbonato de sódio leve ao monohidrato (Na2CO3.H2O) e depois desidratando-o para dar um produto com maior tamanho e densidade de cristal.
Os dois graus têm usos diferentes.
Os principais usos do carbonato de sódio pesado são como um sólido, particularmente na fabricação de vidro, onde é usado como um fluxo na fusão da sílica (areia).
Os usos do carbonato de sódio leve são tradicionalmente onde o produto químico é necessário em solução.
Figure 1 Usos do carbonato de sódio leve e pesado.
Overtudo, cerca de 50% da produção total de carbonato de sódio é usado para fazer vidro, 18% para fazer outros produtos químicos e 10% em sabões e detergentes.
Produção anual de carbonato de sódio
China é o maior produtor mundial de carbonato de sódio, sendo responsável por 46% da produção mundial e 23% dos Estados Unidos. (IHS Markit, 2015)
| Mundo | 52 milhões de toneladas1,2 |
| China | 25 milhões de toneladas3 |
| U.S. | 12 milhões de toneladas1 |
| Europa | 11 milhões de toneladas |
| Rússia | 0.71 milhões de toneladas4 |
Dados de:
1. 2018 Elementos do Negócio de Química, American Chemistry Council.
2. Destes, 14,7 toneladas são extraídas. A grande maioria é minerada nos EUA (11,7 milhões de toneladas) e na Turquia (2 milhões de toneladas). O resto é feito de cloreto de sódio e carbonato de cálcio.
3. IHS Markit, 2015
4. Federal State Statistics Service: Federação Russa 2011
Fabricação de carbonato de sódio
Existem duas fontes principais de carbonato de sódio:
a) de sal e carbonato de cálcio (através do processo de soda de amônia (Solvay))
b) de carbonato de sódio e minérios de hidrogênio-carbonato de sódio (trona e nahcolita)
(a) de cloreto de sódio e carbonato de cálcio
A reação geral pode ser considerada como entre o carbonato de cálcio e o cloreto de sódio:
No entanto, o carbonato de cálcio é demasiado insolúvel para reagir com uma solução de sal. Em vez disso, o produto é obtido por uma série de sete etapas.
O processo é conhecido como o processo de amoníaco soda ou processo Solvay, com o nome do químico industrial belga que o patenteou em 186I.
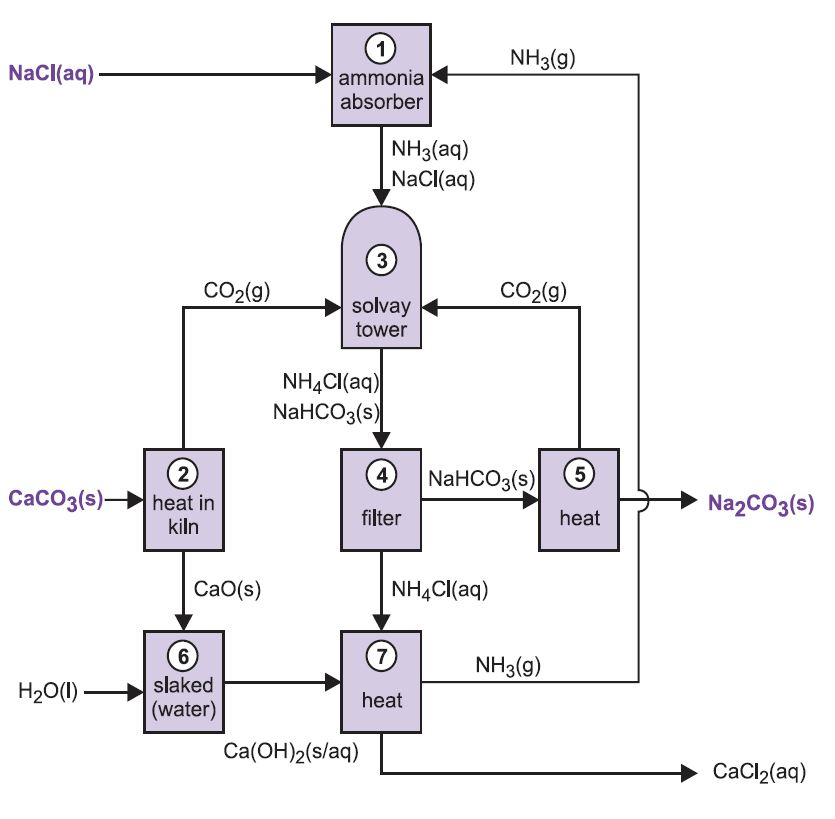
As várias etapas do processo Solvay estão interligadas como pode ser visto no diagrama e descrição abaixo.
Figure 2 Diferentes estágios do processo Solvay.
(1) Amoniação da salmoura
O gás amônia é absorvido em salmoura concentrada para dar uma solução contendo tanto cloreto de sódio quanto amônia. Na+(aq), Cl-(aq), NH4+(aq), íons OH-(aq) e NH3(aq) estão presentes.
(2) Formação de óxido de cálcio e dióxido de carbono
Os fornos são alimentados com uma mistura calcário/coque (13:1 por massa). O coque queima em contracorrente de ar pré-aquecido:
O calor da combustão aumenta a temperatura do forno e o calcário decompõe-se:
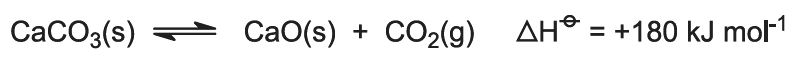
O gás, contendo aproximadamente 40% de dióxido de carbono, é liberado do pó de cal e enviado para as torres carbonatadoras (Solvay). O resíduo, óxido de cálcio, é utilizado na recuperação de amônia (ver passo 7 abaixo).
(3) A Torre Solvay
Esta é a etapa chave no processo. A salmoura amoníaca do passo (1) é passada para baixo através da Torre Solvay enquanto o dióxido de carbono dos passos (2) e (5) é passado para cima. A Solvay Tower é alta e contém um conjunto de deflectores em forma de cogumelo para abrandar e quebrar o fluxo de líquido de modo a que o dióxido de carbono possa ser absorvido eficientemente pela solução. O dióxido de carbono, ao dissolver, reage com o amoníaco dissolvido para formar hidrogenocarbonato de amónio:
A solução contém agora iões Na+(aq), Cl-(aq), NH4+(aq) e HCO3-(aq). Das quatro substâncias que poderiam ser formadas por diferentes combinações destes íons, o hidrogenocarbonato de sódio (NaHCO3) é o menos solúvel. Ele precipita-se como um sólido na parte inferior da torre, que é resfriada. O processo líquido é:
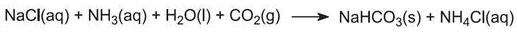
Uma suspensão de hidrogenocarbonato de sódio sólido numa solução de cloreto de amónio é escoada da base da torre.
(4) Separação de hidrocarboneto de sódio sólido
A suspensão é filtrada para separar o hidrogenocarboneto de sódio sólido da solução de cloreto de amónio, que é depois utilizada na fase (7).
(5) Formação de carbonato de sódio
O hidrogenocarbonato de sódio é aquecido em fornos rotativos a 450 K para que se decomponha em carbonato de sódio, água e dióxido de carbono:
O dióxido de carbono é enviado de volta para a Torre Solvay para uso no passo (3). O produto do processo, carbonato de sódio anidro, é obtido como um pó branco fino conhecido como carbonato de sódio leve.
(6) Formação do hidróxido de cálcio
Os dois últimos estágios, (6) e (7), estão relacionados com a regeneração do amoníaco a partir do cloreto de amônio (feito no passo 3). O calcário rápido do passo (2) é batido com água em excesso dando leite de cal:
>
(7) Regeneração de amônia
Esta suspensão de hidróxido de cálcio é misturada com a solução de cloreto de amônio deixada do passo (4) e aquecida:
A amônia é assim recuperada, e enviada de volta ao passo (1). O cloreto de cálcio é o único subproduto de todo o processo.
O processo geral é um processo elegante. Em teoria, as únicas matérias primas são o calcário e a salmoura. Inevitavelmente, há perdas de amônia, e estas são compensadas pela adição de suprimentos extras, como requerido no passo (1).
(b) De minérios trona e nahcolite
O processo Solvay não é usado nos EUA. Em vez disso, a indústria usa dois minérios e isto representa cerca de 30% da produção mundial. Um é o trona, encontrado em grandes quantidades no Wyoming. Trona tem a fórmula:
O minério é extraído como um sólido e aquecido para expulsar o dióxido de carbono, para produzir carbonato de sódio:
O outro minério é a nahcolita que é o hidrogenocarbonato de sódio. Ao aquecê-lo forma carbonato de sódio.