Lewis a folosit diagrame simple (numite acum diagrame Lewis) pentru a ține evidența numărului de electroni prezenți în învelișul cel mai exterior, sau de valență, al unui anumit atom. Miezul atomului, adică nucleul împreună cu electronii interiori, este reprezentat prin simbolul chimic, iar numai electronii de valență sunt desenate ca puncte care înconjoară simbolul chimic. Astfel, cei trei atomi prezentați în figura 1 din Electrons and Valence pot fi reprezentați prin următoarele diagrame Lewis:
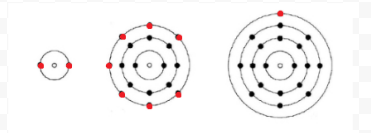

Dacă atomul este un atom de gaz nobil, sunt posibile două proceduri alternative. Fie putem considera că atomul are zero electroni de valență, fie putem considera că învelișul cel mai exterior umplut este învelișul de valență. Primele trei gaze nobile pot fi astfel scrise ca:
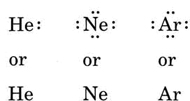
Exemplu \(\PageIndex{1}\): Structuri Lewis
Desenați diagramele Lewis pentru un atom din fiecare dintre următoarele elemente: Li, N, F, Na
Soluție
Din tabelul periodic din interiorul copertei primare aflăm că Li are numărul atomic 3. El conține astfel trei electroni, cu unul mai mult decât gazul nobil He. Aceasta înseamnă că învelișul cel mai exterior, sau de valență, conține doar un singur electron, iar diagrama Lewis este
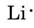
Potrivit aceluiași raționament, N are șapte electroni, cu cinci mai mulți decât He, în timp ce F are nouă electroni, cu șapte mai mulți decât He, rezultând
![]()
Na are cu nouă electroni mai mult decât He, dar opt dintre ei sunt în nucleu, corespunzând celor opt electroni din învelișul cel mai exterior al lui Ne. Deoarece Na are doar un singur electron în plus față de Ne, diagrama sa Lewis este
![]()
Observați din exemplul precedent că diagramele Lewis ale metalelor alcaline sunt identice, cu excepția simbolurilor lor chimice. Acest lucru concordă foarte bine cu comportamentul chimic foarte asemănător al metalelor alcaline. În mod similar, diagramele Lewis pentru toate elementele din alte grupe, cum ar fi pământurile alcaline sau halogenii, arată la fel.
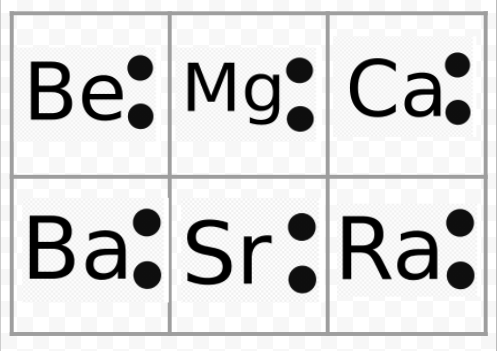
Diagramele Lewis pot fi folosite și pentru a prezice valențele elementelor. Lewis a sugerat că numărul de valențe ale unui atom este egal cu numărul de electroni din învelișul de valență al acestuia sau cu numărul de electroni care ar trebui adăugați în învelișul de valență pentru a obține structura electronică a învelișului următorului gaz nobil. Ca exemplu al acestei idei, considerăm elementele Be și O. Diagramele lor Lewis și cele ale gazelor nobile He și Ne sunt

Comparând Be cu He, vedem că primul are cu doi electroni mai mult și, prin urmare, ar trebui să aibă o valență de 2. Elementul O s-ar putea aștepta să aibă o valență de 6 sau o valență de 2, deoarece are șase electroni de valență – cu doi mai puțin decât Ne. Folosind regulile de valență dezvoltate în acest fel, Lewis a putut explica creșterea și scăderea regulată a subscriptelor compușilor din tabelul din secțiunea Valență, reprodus aici. În plus, a reușit să explice mai mult de 50% din formulele din tabel. (Cele care sunt în acord cu ideile sale sunt umbrite în culori în tabel. Este posibil să doriți să vă referiți acum la acel tabel și să verificați dacă unele dintre formulele indicate respectă regulile lui Lewis). Succesul lui Lewis în această privință a dat o indicație clară că electronii sunt cel mai important factor care ține atomii împreună atunci când se formează moleculele.
În ciuda acestor succese, există și dificultăți care pot fi găsite în teoriile lui Lewis, în special pentru elementele de dincolo de calciu din tabelul periodic. Elementul Br (Z = 35), de exemplu, are cu 17 electroni mai mulți decât gazul nobil Ar (Z = 18). Acest lucru ne conduce la concluzia că Br are 17 electroni de valență, ceea ce face dificilă explicarea faptului că Br seamănă atât de mult cu Cl și F, deși acești doi atomi au doar șapte electroni de valență.
| Element | Putere atomică | Hidrogenul Compuși | Compuși ai clorului | |||
|---|---|---|---|---|---|---|
| Hidrogen | 1.01 | H2 | H2O, H2O2 | HCl | ||
| Heliu | 4.00 | Nu s-a format | Nu s-a format | Nu s-a format | ||
| Litiu | 6.94 | LiH | Li2O, Li2O2 | LiCl | ||
| Beriliu | 9.01 | BeH2 | BeO | BeCl2 | ||
| Boron | 10.81 | B2H6 | B2O3 | BCl3 | ||
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 | ||
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 | ||
| Oxigen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 | ||
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 | ||
| Neon | 20.18 | Nu s-a format | Nu s-a format | Nu s-a format | ||
| Sodiu | 22.99 | NaH | Na2O, Na2O2 | NaCl | ||
| Magneziu | 24.31 | MgH2 | MgO | MgCl2 | ||
| Aluminiu | 26.98 | AlH3 | Al2O3 | AlCl3 | ||
| Siliciu | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 | ||
| Fosfor | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 | ||
| Sulfur | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 | ||
| Clor | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 | ||
| Potasiu | 39.10 | KH | K2, K2O2, KO2 | KCl | ||
| Argon | 39.95 | Nu s-a format | Nu s-a format | Nu s-a format | ||
| Calciu | 40.08 | CaH2 | CaO, CaO2 | CaCl2 | ||
| Scandiu | 44.96 | Relativ instabil | Sc2O3 | ScCl3 | ||
| Titaniu | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 | ||
| Vanadiu | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 | ||
| Cromul | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contribuitori
-
Ed Vitz (Universitatea Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff și Adam Hahn.