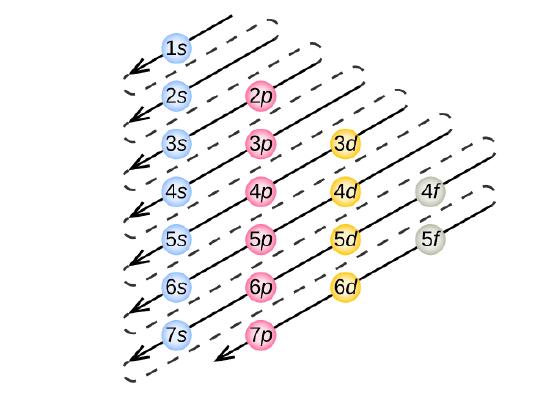
Principiul Aufbau
Pentru a determina configurația electronică pentru un anumit atom, putem „construi” structurile în ordinea numerelor atomice. Începând cu hidrogenul și continuând de-a lungul perioadelor tabelului periodic, adăugăm câte un proton la nucleu și câte un electron la subshell-ul corespunzător până când am descris configurațiile electronice ale tuturor elementelor. Această procedură se numește principiul Aufbau, de la cuvântul german Aufbau („a construi”). Fiecare electron adăugat ocupă subshell-ul de cea mai joasă energie disponibilă (în ordinea prezentată în figura \(\PageIndex{3}\)), sub rezerva limitărilor impuse de numerele cuantice permise conform principiului de excludere Pauli. Electronii intră în subînvelișurile de energie superioară numai după ce subînvelișurile de energie inferioară au fost umplute până la capacitate. Figura \(\(\PageIndex{3}\) ilustrează modul tradițional de a reține ordinea de umplere a orbitalilor atomici.
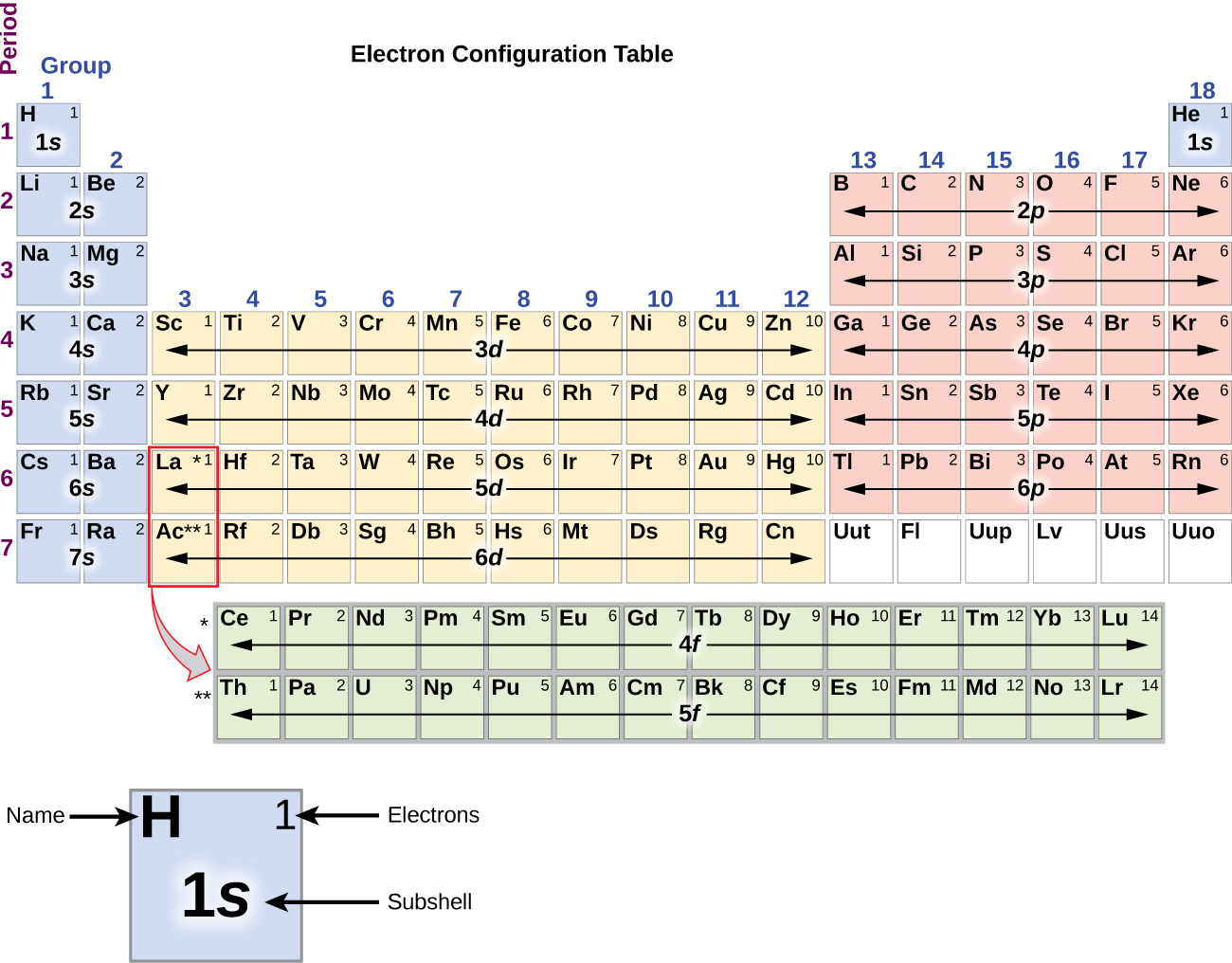
Din moment ce aranjamentul tabelului periodic se bazează pe configurațiile electronice, figura \(\PageIndex{4}\) oferă o metodă alternativă pentru determinarea configurației electronice. Ordinea de umplere începe pur și simplu de la hidrogen și include fiecare subshell pe măsură ce se avansează în ordinea Z crescătoare. De exemplu, după umplerea blocului 3p până la Ar, vedem că orbitalul va fi 4s (K, Ca), urmat de orbitalii 3d.
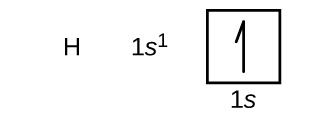
În continuare vom construi configurația electronică în starea fundamentală și diagrama orbitală pentru o selecție de atomi din prima și a doua perioadă a tabelului periodic. Diagramele orbitale sunt reprezentări picturale ale configurației electronice, arătând orbitalii individuali și aranjamentul de împerechere al electronilor. Începem cu un singur atom de hidrogen (număr atomic 1), care constă dintr-un proton și un electron. Dacă ne referim fie la figura \(\PageIndex{3}\), fie la figura \(\PageIndex{4}\), ne așteptăm să găsim electronul în orbitalul 1s. Prin convenție, valoarea \(m_s=+\dfrac{1}{2}\) este de obicei completată prima. Configurația electronică și diagrama orbitală sunt:
După hidrogen se află gazul nobil heliu, care are un număr atomic de 2. Atomul de heliu conține doi protoni și doi electroni. Primul electron are aceleași patru numere cuantice ca și electronul atomului de hidrogen (n = 1, l = 0, ml = 0, \(m_s=+\dfrac{1}{2}\)). Al doilea electron intră, de asemenea, în orbitalul 1s și umple acel orbital. Al doilea electron are aceleași numere cuantice n, l și ml, dar trebuie să aibă numărul cuantic de spin opus, \(m_s=-\dfrac{1}{2}\). Acest lucru este în concordanță cu principiul de excludere Pauli: nu pot exista doi electroni în același atom care să aibă același set de patru numere cuantice. Pentru diagramele orbitale, acest lucru înseamnă că în fiecare căsuță intră două săgeți (reprezentând doi electroni în fiecare orbital), iar săgețile trebuie să fie îndreptate în direcții opuse (reprezentând spini pereche). Electronul rămas trebuie să ocupe orbitalul de energie imediat inferioară, orbitalul 2s (Figura \(\PageIndex{3}\) sau \(\PageIndex{4}\)). Astfel, configurația electronică și diagrama orbitală a litiului sunt:
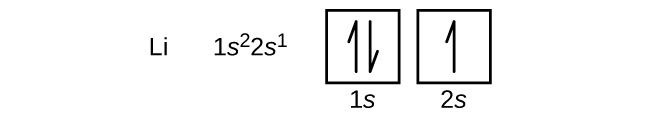
Un atom de beriliu, metal alcalino-pământean, cu un număr atomic de 4, conține patru protoni în nucleu și patru electroni în jurul nucleului. Cel de-al patrulea electron umple spațiul rămas în orbitalul 2s.
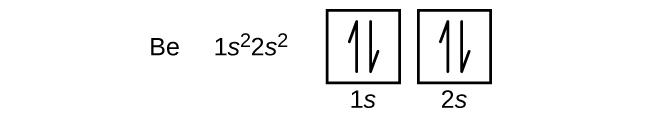
Un atom de bor (număr atomic 5) conține cinci electroni. Învelișul n = 1 este umplut cu doi electroni, iar trei electroni vor ocupa învelișul n = 2. Deoarece orice subshell s poate conține doar doi electroni, cel de-al cincilea electron trebuie să ocupe următorul nivel energetic, care va fi un orbital 2p. Există trei orbitali 2p degenerate (ml = -1, 0, +1), iar electronul poate ocupa oricare dintre acești orbitali p. Atunci când desenăm diagrame orbitale, includem căsuțe goale pentru a reprezenta orice orbitali goi din aceeași subshell pe care o umplem.
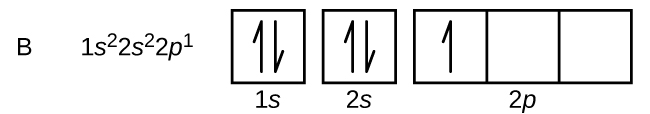
Carbonul (număr atomic 6) are șase electroni. Patru dintre ei umplu orbitalii 1s și 2s. Cei doi electroni rămași ocupă subshell-ul 2p. Avem acum posibilitatea de a alege între a umple unul dintre orbitalii 2p și de a împerechea electronii sau de a lăsa electronii neîmperecheați în doi orbitali p diferiți, dar degenerate. Orbitalii sunt ocupați așa cum este descris de regula lui Hund: configurația cu cea mai mică energie pentru un atom cu electroni într-un set de orbitali degenerate este cea care are numărul maxim de electroni neperecheați. Astfel, cei doi electroni din orbitalii 2p ai carbonului au numere cuantice n, l și ms identice și diferă prin numărul lor cuantic ml (în conformitate cu principiul de excludere Pauli). Configurația electronică și diagrama orbitală pentru carbon sunt:
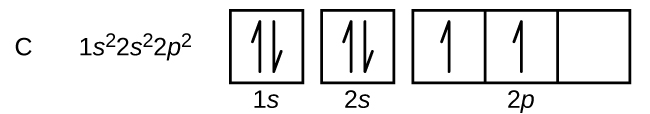
Nitrogenul (număr atomic 7) umple subshell-urile 1s și 2s și are câte un electron în fiecare dintre cei trei orbitali 2p, în conformitate cu regula lui Hund. Acești trei electroni au spini neperecheați. Oxigenul (număr atomic 8) are o pereche de electroni în oricare dintre orbitalii 2p (electronii au spini opuși) și un singur electron în fiecare dintre ceilalți doi. Fluorul (număr atomic 9) are un singur orbital 2p care conține un electron neperecheat. Toți electronii din gazul nobil neon (număr atomic 10) sunt împerecheați, iar toți orbitalii din învelișurile n = 1 și n = 2 sunt plini. Configurațiile electronice și diagramele orbitale ale acestor patru elemente sunt:
Metal alcalin sodiu (număr atomic 11) are un electron în plus față de atomul de neon. Acest electron trebuie să meargă în subshell-ul cu cea mai joasă energie disponibilă, orbitalul 3s, ceea ce dă o configurație 1s22s22s22p63s1. Electronii care ocupă orbitalul (orbitalii) de înveliș cel mai exterior (cea mai mare valoare a lui n) se numesc electroni de valență, iar cei care ocupă orbitalii de înveliș interior se numesc electroni de nucleu ( Figura \PageIndex5\PageIndex5). Deoarece învelișurile electronilor de nucleu corespund configurațiilor electronice ale gazelor nobile, putem abrevia configurațiile electronice prin scrierea gazului nobil care corespunde configurației electronice de nucleu, împreună cu electronii de valență într-un format condensat. Pentru exemplul nostru de sodiu, simbolul reprezintă electronii de nucleu, (1s22s22p6), iar configurația noastră prescurtată sau condensată este 3s1.

În mod similar, configurația abreviată a litiului poate fi reprezentată ca 2s1, unde reprezintă configurația atomului de heliu, care este identică cu cea a învelișului interior umplut al litiului. Scrierea configurațiilor în acest mod evidențiază similitudinea configurațiilor litiului și sodiului. Ambii atomi, care fac parte din familia metalelor alcaline, au doar un singur electron într-o subînveliș de valență s în afara unui set de învelișuri interioare pline.
\}\,2s^1\\ \ce{Na:}\,3s^1\]
Magneziul metal alcalino-pământesc (număr atomic 12), cu cei 12 electroni ai săi într-o configurație 3s2, este analog cu membrul său de familie beriliu, 2s2. Ambii atomi au o subcochilie s plină în afara cochiliilor lor interioare pline. Aluminiul (număr atomic 13), cu 13 electroni și configurația electronică 3s23p1, este analog cu membrul său de familie, borul, 2s22p1.
Configurările electronice ale siliciului (14 electroni), fosforului (15 electroni), sulfului (16 electroni), clorului (17 electroni) și argonului (18 electroni) sunt analoge în configurațiile electronice ale învelișurilor lor exterioare cu cele ale membrilor lor de familie corespunzători: carbon, azot, oxigen, fluor și, respectiv, neon, cu excepția faptului că numărul cuantic principal al învelișului exterior al elementelor mai grele a crescut cu unu, ajungând la n = 3. Figura \(\(\PageIndex{6}\) prezintă configurația electronică de cea mai joasă energie, sau starea fundamentală, pentru aceste elemente, precum și cea pentru atomii fiecăruia dintre elementele cunoscute.
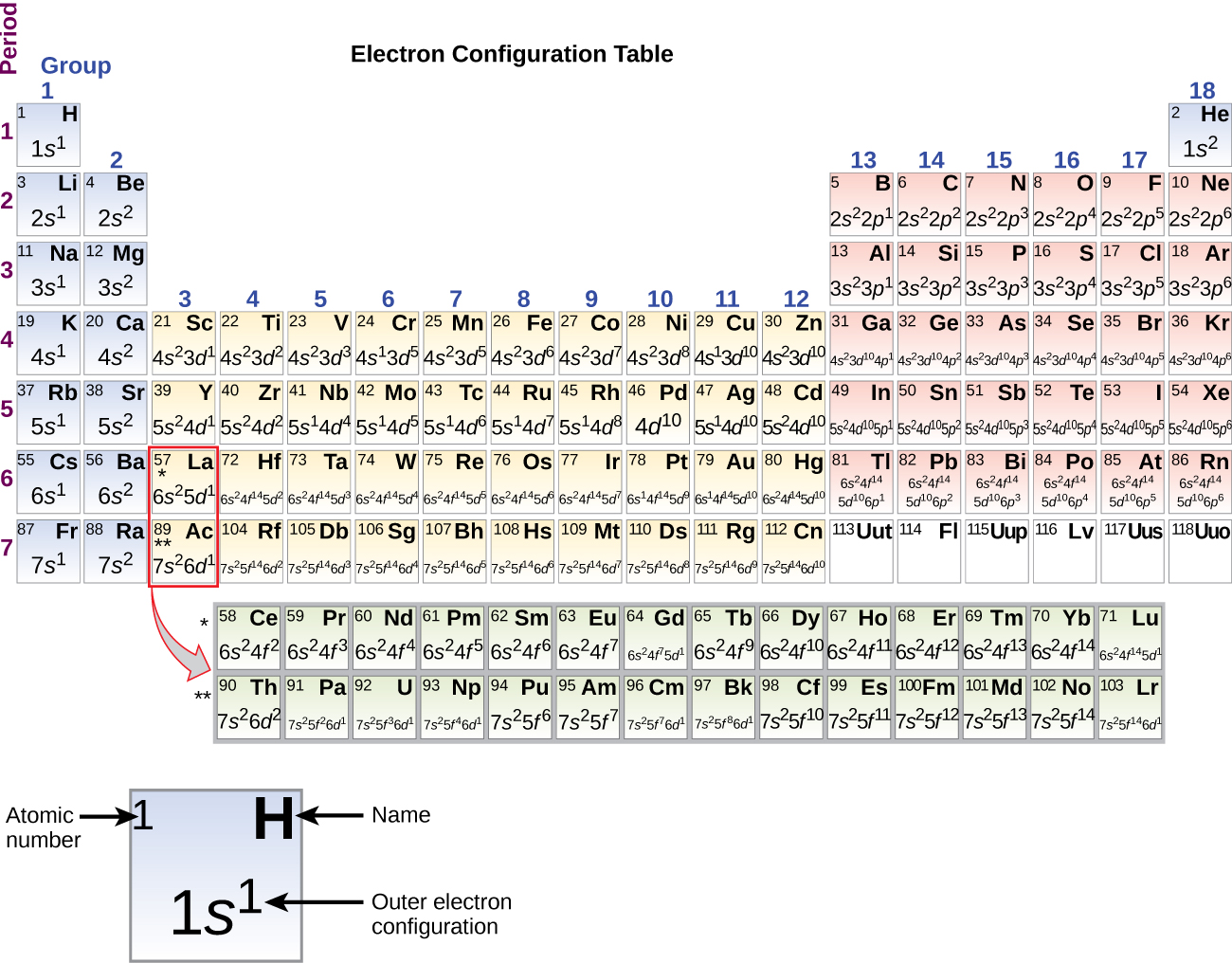
Când ajungem la următorul element din tabelul periodic, metalul alcalin potasiu (număr atomic 19), ne-am putea aștepta să începem să adăugăm electroni în subshell-ul 3d. Cu toate acestea, toate dovezile chimice și fizice disponibile indică faptul că potasiul este la fel ca litiul și sodiul și că următorul electron nu este adăugat la nivelul 3d, ci este, în schimb, adăugat la nivelul 4s (Figura \(\PageIndex{3}\) sau \(\PageIndex{4}\)). După cum s-a discutat anterior, orbitalul 3d fără noduri radiale are o energie mai mare, deoarece este mai puțin penetrant și mai protejat de nucleu decât cel 4s, care are trei noduri radiale. Astfel, potasiul are o configurație electronică de 4s1. Prin urmare, potasiul corespunde Li și Na în configurația cojii de valență. Următorul electron este adăugat pentru a completa subshell-ul 4s și calciul are o configurație electronică de 4s2. Astfel, calciul are o configurație electronică a învelișului exterior care corespunde celei a beriliului și magneziului.
Începând cu metalul de tranziție scandiu (număr atomic 21), se adaugă succesiv electroni suplimentari în subînvelișul 3d. Această subshell este umplută până la capacitatea sa cu 10 electroni (rețineți că pentru l = 2 , există 2l + 1 = 5 valori ale lui ml, ceea ce înseamnă că există cinci orbitali d care au o capacitate combinată de 10 electroni). Subshell-ul 4p se umple în continuare. Rețineți că pentru trei serii de elemente, de la scandiu (Sc) până la cupru (Cu), de la ytriu (Y) până la argint (Ag) și de la lutețiu (Lu) până la aur (Au), un total de 10 electroni d sunt adăugați succesiv la învelișul (n – 1) de lângă învelișul n pentru a aduce acest înveliș (n – 1) de la 8 la 18 electroni. Pentru două serii, de la lantan (La) la lutețiu (Lu) și de la actiniu (Ac) la lawrenciu (Lr), 14 electroni f (l = 3, 2l + 1 = 7 valori ml; astfel, șapte orbitali cu o capacitate combinată de 14 electroni) sunt adăugați succesiv la învelișul (n – 2) pentru a aduce acel înveliș de la 18 electroni la un total de 32 de electroni.
Exemplu \(\PageIndex{1}\): Numere cuantice și configurații electronice
Care este configurația electronică și diagrama orbitală pentru un atom de fosfor? Care sunt cele patru numere cuantice pentru ultimul electron adăugat?
Soluție
Numărul atomic al fosforului este 15. Astfel, un atom de fosfor conține 15 electroni. Ordinea de umplere a nivelelor energetice este 1s, 2s, 2p, 3s, 3p, 4s, . . . . Cei 15 electroni ai atomului de fosfor se vor umple până la orbitalul 3p, care va conține trei electroni:
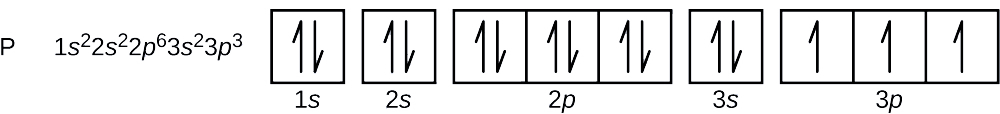
Ultimul electron adăugat este un electron 3p. Prin urmare, n = 3 și, pentru un orbital de tip p, l = 1. Valoarea ml poate fi -1, 0 sau +1. Cei trei orbitali p sunt degenerate, astfel încât oricare dintre aceste valori ml este corectă. Pentru electronii neperecheați, convenția atribuie valoarea \(+\dfrac{1}{2}\) pentru numărul cuantic de spin; astfel, \(m_s=+\dfrac{1}{2}\).
Exercițiu \(\PageIndex{1}\)
Identificați atomii din configurațiile electronice date:
- 4s23d5
- 5s24d105p6
Răspundeți la a
Mn
Răspundeți la b
Xe
Tabloul periodic poate fi un instrument puternic în prezicerea configurației electronice a unui element. Cu toate acestea, găsim excepții de la ordinea de umplere a orbitalilor care sunt prezentate în figura \(\PageIndex{3}\) sau \(\PageIndex{4}\). De exemplu, configurațiile electronice ale metalelor de tranziție crom (Cr; număr atomic 24) și cupru (Cu; număr atomic 29), printre altele, nu sunt cele la care ne-am aștepta. În general, astfel de excepții implică subshell-uri cu energie foarte asemănătoare, iar efecte mici pot duce la schimbări în ordinea umplerii.
În cazul lui Cr și Cu, constatăm că subshell-urile pe jumătate umplute și complet umplute reprezintă aparent condiții de stabilitate preferată. Această stabilitate este de așa natură încât un electron se deplasează din orbitalul 4s în orbitalul 3d pentru a obține stabilitatea suplimentară a unui subshell 3d pe jumătate umplut (în Cr) sau a unui subshell 3d umplut (în Cu). Există și alte excepții. De exemplu, se preconizează că niobiul (Nb, număr atomic 41) are configurația electronică 5s24d3. Din punct de vedere experimental, observăm că configurația electronică în starea fundamentală este de fapt 5s14d4. Putem raționaliza această observație spunând că respingerile electron-electronice experimentate prin împerecherea electronilor în orbitalul 5s sunt mai mari decât diferența de energie dintre orbitalii 5s și 4d. Nu există o metodă simplă de a prezice excepțiile pentru atomii în care mărimea repulsiilor dintre electroni este mai mare decât diferențele mici de energie dintre subshell-uri.
.