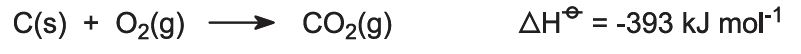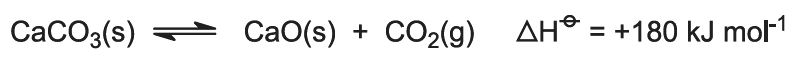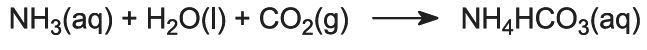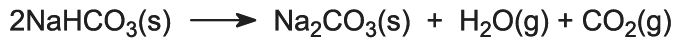- Utilizări ale carbonatului de sodiu
- Producția anuală de carbonat de sodiu
- Fabricarea carbonatului de sodiu
- (a) Din clorură de sodiu și carbonat de calciu
- (1) Amonificarea saramurii
- (2) Formarea oxidului de calciu și a dioxidului de carbon
- (3) Turnul Solvay
- (4) Separarea hidrocarbonatului de sodiu solid
- (5) Formarea carbonatului de sodiu
- (6) Formarea hidroxidului de calciu
- (7) Regenerarea amoniacului
- (b) Din minereuri de trona și nahcolit
Utilizări ale carbonatului de sodiu
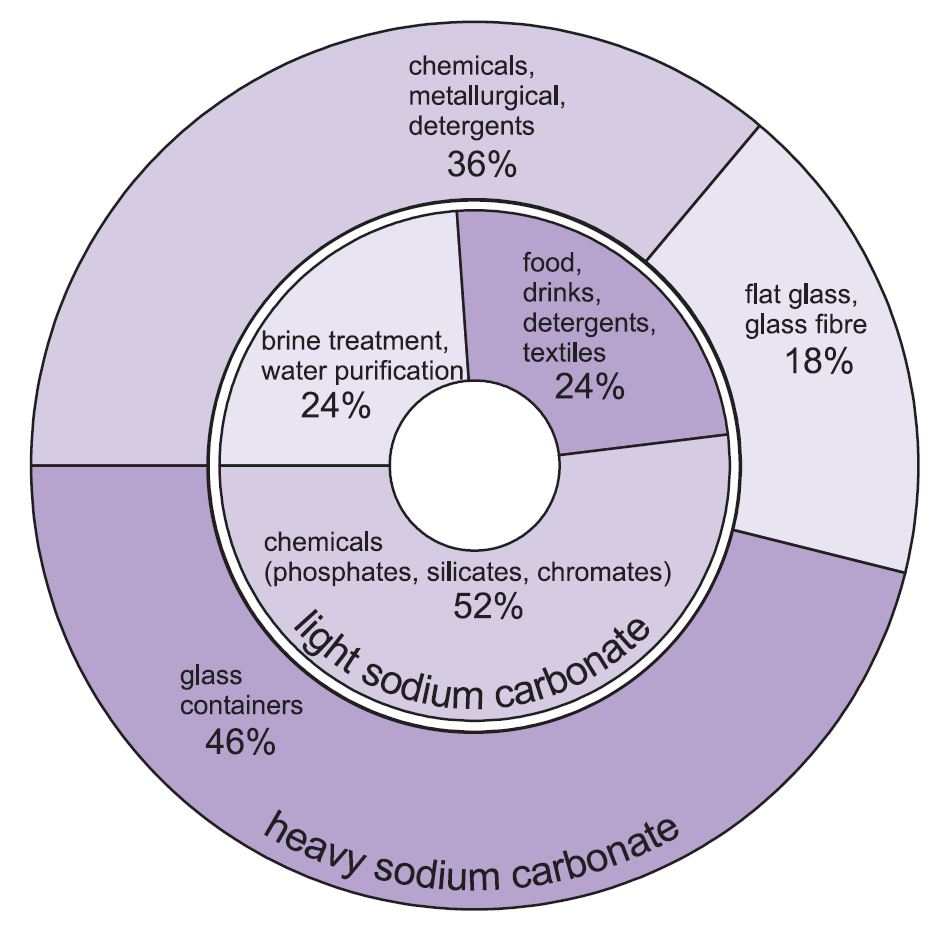
Se folosesc două forme de carbonat de sodiu (sodă) – grea și ușoară. Forma ușoară se obține mai întâi și o parte se transformă apoi în forma grea. Carbonatul de sodiu ușor conține mai puțin de 0,5% clorură de sodiu. Carbonatul de sodiu greu se obține prin hidratarea carbonatului de sodiu ușor până la monohidrat (Na2CO3.H2O) și apoi prin deshidratarea acestuia pentru a obține un produs cu o dimensiune și densitate crescută a cristalelor.
Cele două forme au utilizări diferite.
Cele mai importante utilizări ale carbonatului de sodiu greu sunt ca substanță solidă, în special în fabricarea sticlei, unde este folosit ca fondant în topirea siliciului (nisip).
Utilizările pentru carbonatul de sodiu ușor sunt în mod tradițional acolo unde substanța chimică este necesară în soluție.
Figura 1 Utilizări ale carbonatului de sodiu greu și ușor.
În total, aproximativ 50% din producția totală de carbonat de sodiu este utilizată pentru fabricarea sticlei, 18% pentru fabricarea altor produse chimice și 10% în săpunuri și detergenți.
Producția anuală de carbonat de sodiu
China este cel mai mare producător de carbonat de sodiu din lume, reprezentând 46% din producția mondială, iar SUA 23%. (IHS Markit, 2015)
| Lume | 52 milioane de tone1,2 |
| China | 25 milioane de tone3 |
| SUA. | 12 milioane de tone1 |
| Europa | 11 milioane de tone |
| Rusia | 0.71 milioane de tone4 |
Date din:
1. 2018 Elements of the Business of Chemistry, American Chemistry Council.
2. Dintre acestea, 14,7 tone sunt extrase din mine. Marea majoritate este extrasă în SUA (11,7 milioane de tone) și în Turcia (2 milioane de tone). Restul este fabricat din clorură de sodiu și carbonat de calciu.
3. IHS Markit, 2015
4. Serviciul Federal de Statistică de Stat: Federația Rusă 2011
Fabricarea carbonatului de sodiu
Există două surse principale de carbonat de sodiu:
a) din sare și carbonat de calciu (prin procedeul sodei de amoniac (Solvay))
b) din minereuri de carbonat de sodiu și hidrogenocarbonat (trona și nahcolit)
(a) Din clorură de sodiu și carbonat de calciu
Reacția globală poate fi considerată ca fiind cea dintre carbonatul de calciu și clorura de sodiu:
Cu toate acestea, carbonatul de calciu este prea insolubil pentru a reacționa cu o soluție de sare. În schimb, produsul este obținut printr-o serie de șapte etape.
Procesul este cunoscut sub numele de procedeul amoniac-soda sau procedeul Solvay, după numele chimistului industrial belgian care l-a brevetat în 186I.
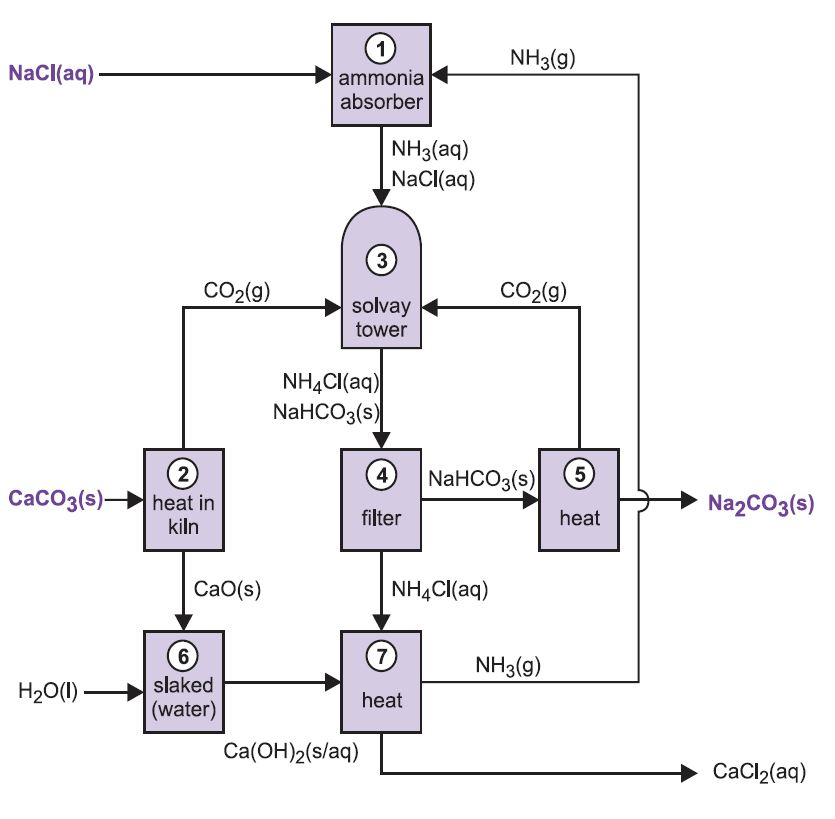
Diferitele etape ale procedeului Solvay sunt interconectate, așa cum se poate observa din diagrama și descrierea de mai jos.
Figura 2 Diferite etape ale procesului Solvay.
(1) Amonificarea saramurii
Gazul de amoniac este absorbit în saramură concentrată pentru a obține o soluție care conține atât clorură de sodiu, cât și amoniac. Sunt prezenți ioni Na+(aq), Cl-(aq), NH4+(aq), OH-(aq) și NH3(aq).
(2) Formarea oxidului de calciu și a dioxidului de carbon
Se alimentează cuptoarele cu un amestec de calcar/coke (13:1 în masă). Cocsul arde într-un contracurent de aer preîncălzit:
Căldura de ardere ridică temperatura cuptorului și calcarul se descompune:
Gazul, care conține aproximativ 40% dioxid de carbon, este eliberat de praful de var și trimis la turnurile de carbonatare (Solvay). Reziduul, oxid de calciu, este utilizat la recuperarea amoniacului (a se vedea etapa 7 de mai jos).
(3) Turnul Solvay
Aceasta este etapa cheie a procesului. Saramura amoniacată din etapa (1) este trecută în jos prin Turnul Solvay, în timp ce dioxidul de carbon din etapele (2) și (5) este trecut în sus prin acesta. Turnul Solvay este înalt și conține un set de deflectoare în formă de ciupercă pentru a încetini și sparge fluxul de lichid, astfel încât dioxidul de carbon să poată fi absorbit eficient de soluție. Dioxidul de carbon, la dizolvare, reacționează cu amoniacul dizolvat pentru a forma hidrogenocarbonat de amoniu:
Soluția conține acum ioni Na+(aq), Cl-(aq), NH4+(aq) și HCO3-(aq). Dintre cele patru substanțe care ar putea fi formate prin diferite combinații ale acestor ioni, hidrogenocarbonatul de sodiu (NaHCO3) este cel mai puțin solubil. Acesta precipită sub formă solidă în partea inferioară a turnului, care este răcit. Procesul net este:
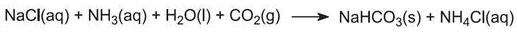
O suspensie de hidrogenocarbonat de sodiu solid într-o soluție de clorură de amoniu se scurge de la baza turnului.
(4) Separarea hidrocarbonatului de sodiu solid
Suspensia este filtrată pentru a separa hidrogenocarbonatul de sodiu solid de soluția de clorură de amoniu, care este apoi utilizată în etapa (7).
(5) Formarea carbonatului de sodiu
Hidrogenocarbonatul de sodiu se încălzește în cuptoare rotative la 450 K, astfel încât se descompune în carbonat de sodiu, apă și dioxid de carbon:
Dioxidul de carbon este trimis înapoi în Turnul Solvay pentru a fi utilizat în etapa (3). Produsul procedeului, carbonatul de sodiu anhidru, se obține sub forma unei pulberi albe fine, cunoscută sub numele de carbonat de sodiu ușor.
(6) Formarea hidroxidului de calciu
Ultimele două etape, (6) și (7), se referă la regenerarea amoniacului din clorura de amoniu (obținută în etapa 3). Varul viu din etapa (2) se stinge cu apă în exces, dând lapte de var:
(7) Regenerarea amoniacului
Această suspensie de hidroxid de calciu se amestecă cu soluția de clorură de amoniu rămasă din etapa (4) și se încălzește:
Amoniacul este astfel recuperat și trimis înapoi la etapa (1). Clorura de calciu este singurul produs secundar al întregului proces.
Procesul general este unul elegant. În teorie, singurele materii prime sunt calcarul și saramura. Inevitabil, există pierderi de amoniac, iar acestea sunt compensate prin adăugarea de rezerve suplimentare, așa cum este necesar în etapa (1).
(b) Din minereuri de trona și nahcolit
Procesul Solvay nu este utilizat în SUA. În schimb, industria folosește două minereuri și aceasta reprezintă aproximativ 30% din producția mondială. Unul este trona, care se găsește în cantități mari în Wyoming. Trona are formula:
Mineritul este exploatat sub formă solidă și încălzit pentru a elimina dioxidul de carbon, pentru a produce carbonat de sodiu:
Celălalt minereu este nahcolitul, care este hidrogenocarbonat de sodiu. La încălzire formează carbonat de sodiu.
.