El principio de Aufbau
Para determinar la configuración de electrones de cualquier átomo en particular, podemos «construir» las estructuras en el orden de los números atómicos. Comenzando con el hidrógeno, y continuando a través de los períodos de la tabla periódica, añadimos un protón a la vez al núcleo y un electrón a la subcapa apropiada hasta que hayamos descrito las configuraciones electrónicas de todos los elementos. Este procedimiento se denomina principio Aufbau, de la palabra alemana Aufbau («construir»). Cada electrón añadido ocupa la subcélula de menor energía disponible (en el orden mostrado en la Figura \(\PageIndex{3}\)), sujeto a las limitaciones impuestas por los números cuánticos permitidos según el principio de exclusión de Pauli. Los electrones entran en las subcubiertas de mayor energía sólo después de que las subcubiertas de menor energía se hayan llenado hasta su capacidad. La figura \(\PageIndex{3}\a) ilustra la forma tradicional de recordar el orden de llenado de los orbitales atómicos.
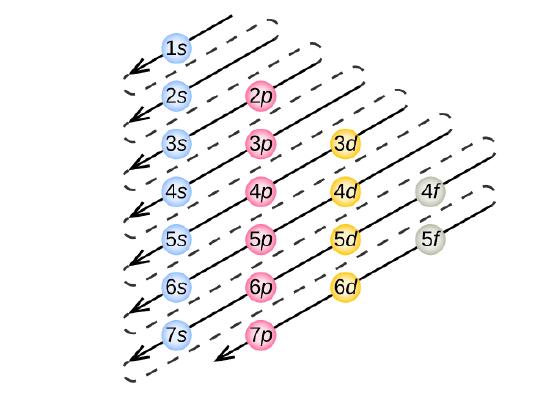
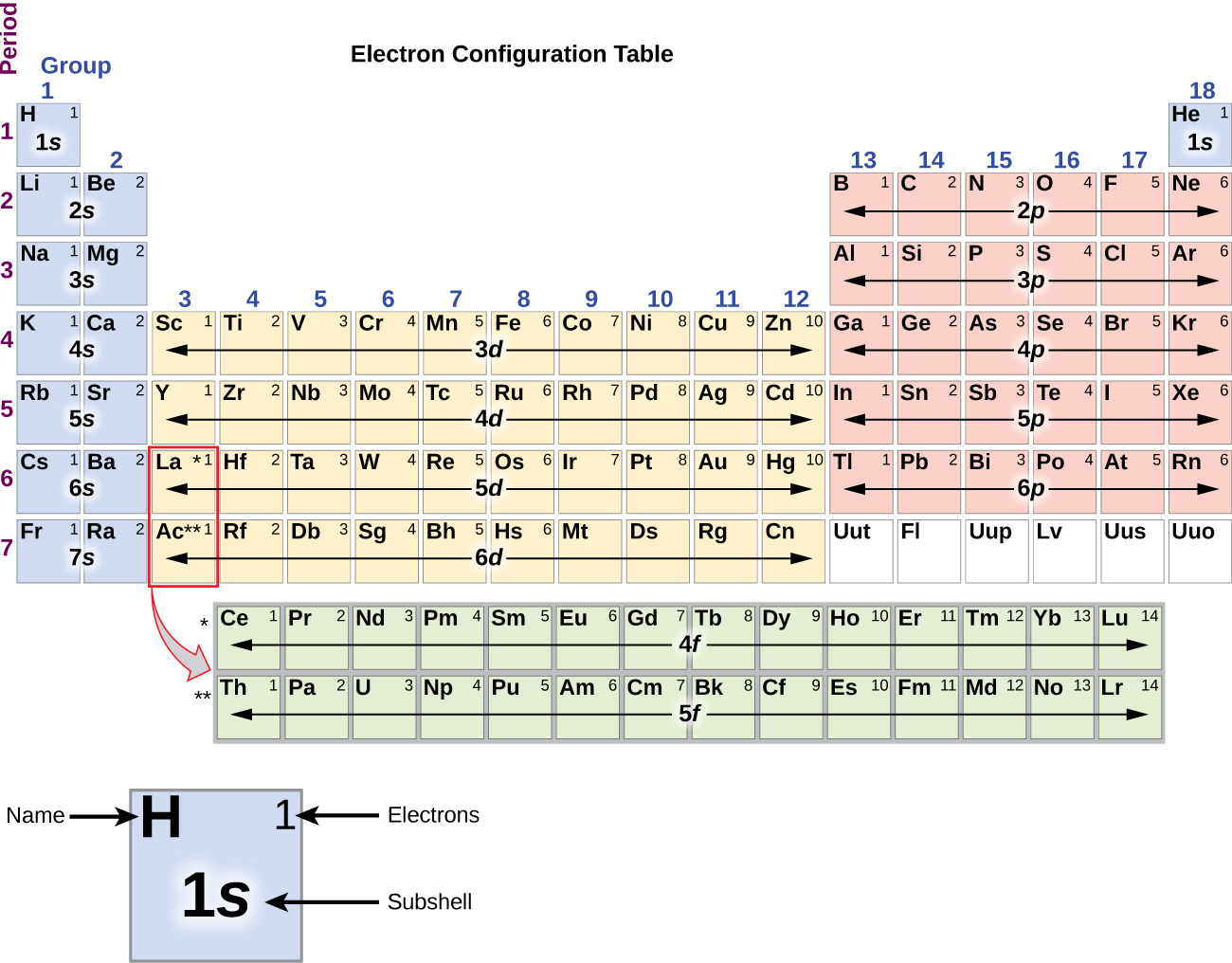
Dado que la disposición de la tabla periódica se basa en las configuraciones de los electrones, la Figura \(\PageIndex{4}\N proporciona un método alternativo para determinar la configuración de los electrones. El orden de llenado simplemente comienza en el hidrógeno e incluye cada subesfera a medida que se avanza en el orden Z creciente. Por ejemplo, después de llenar el bloque 3p hasta el Ar, vemos que el orbital será 4s (K, Ca), seguido por los orbitales 3d.
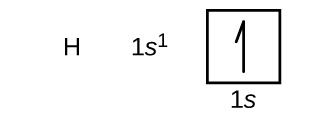
Ahora construiremos la configuración electrónica del estado básico y el diagrama orbital para una selección de átomos del primer y segundo período de la tabla periódica. Los diagramas orbitales son representaciones pictóricas de la configuración de los electrones, mostrando los orbitales individuales y la disposición de los pares de electrones. Comenzamos con un único átomo de hidrógeno (número atómico 1), que consta de un protón y un electrón. Refiriéndonos a la figura \(\PageIndex{3}\) o \(\PageIndex{4}\), esperaríamos encontrar el electrón en el orbital 1s. Por convención, el valor de \(m_s=+\dfrac{1}{2}\) se suele rellenar primero. La configuración de electrones y el diagrama de orbitales son:
Después del hidrógeno está el gas noble helio, que tiene un número atómico de 2. El átomo de helio contiene dos protones y dos electrones. El primer electrón tiene los mismos cuatro números cuánticos que el electrón del átomo de hidrógeno (n = 1, l = 0, ml = 0, \(m_s=+\dfrac{1}{2}\)). El segundo electrón también entra en el orbital 1s y llena ese orbital. El segundo electrón tiene los mismos números cuánticos n, l y ml, pero debe tener el número cuántico de espín opuesto, \(m_s=-\dfrac{1}{2}\). Esto está de acuerdo con el principio de exclusión de Pauli: no hay dos electrones en el mismo átomo que puedan tener el mismo conjunto de cuatro números cuánticos. Para los diagramas orbitales, esto significa que dos flechas van en cada caja (representando dos electrones en cada orbital) y las flechas deben apuntar en direcciones opuestas (representando espines emparejados). La configuración electrónica y el diagrama orbital del helio son:
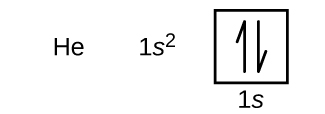
La capa n = 1 está completamente llena en un átomo de helio.
El siguiente átomo es el metal alcalino litio con un número atómico de 3. Los dos primeros electrones del litio llenan el orbital 1s y tienen los mismos conjuntos de cuatro números cuánticos que los dos electrones del helio. El electrón restante debe ocupar el orbital de siguiente energía más baja, el orbital 2s (Figura \(\PageIndex{3}\) o \(\PageIndex{4}\)). Así, la configuración electrónica y el diagrama orbital del litio son:
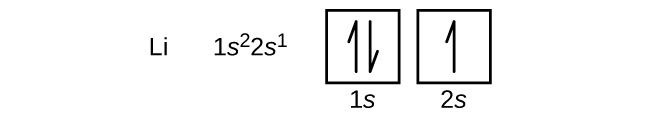
Un átomo del metal alcalinotérreo berilio, de número atómico 4, contiene cuatro protones en el núcleo y cuatro electrones rodeando el núcleo. El cuarto electrón llena el espacio restante en el orbital 2s.
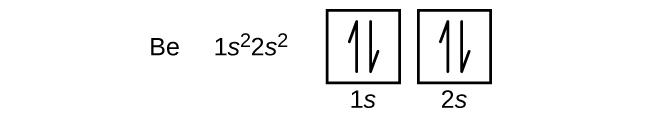
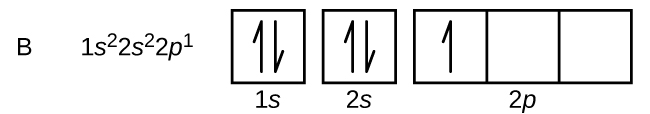
Un átomo de boro (número atómico 5) contiene cinco electrones. La cáscara n = 1 se llena con dos electrones y tres electrones ocuparán la cáscara n = 2. Como cualquier subcáscara s sólo puede contener dos electrones, el quinto electrón debe ocupar el siguiente nivel de energía, que será un orbital 2p. Hay tres orbitales 2p degenerados (ml = -1, 0, +1) y el electrón puede ocupar cualquiera de estos orbitales p. Al dibujar los diagramas de orbitales, incluimos recuadros vacíos para representar cualquier orbital vacío en el mismo subescalón que estamos llenando.
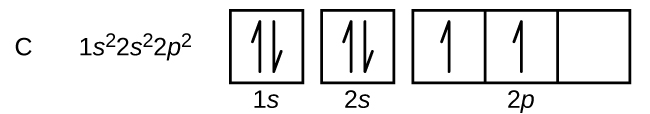
El carbono (número atómico 6) tiene seis electrones. Cuatro de ellos llenan los orbitales 1s y 2s. Los dos electrones restantes ocupan el subesqueleto 2p. Ahora tenemos la opción de llenar uno de los orbitales 2p y emparejar los electrones o dejar los electrones sin emparejar en dos orbitales p diferentes, pero degenerados. Los orbitales se llenan según la regla de Hund: la configuración de menor energía para un átomo con electrones dentro de un conjunto de orbitales degenerados es la que tiene el máximo número de electrones no apareados. Así, los dos electrones de los orbitales 2p del carbono tienen idénticos números cuánticos n, l y ms y difieren en su número cuántico ml (de acuerdo con el principio de exclusión de Pauli). La configuración electrónica y el diagrama de orbitales del carbono son:
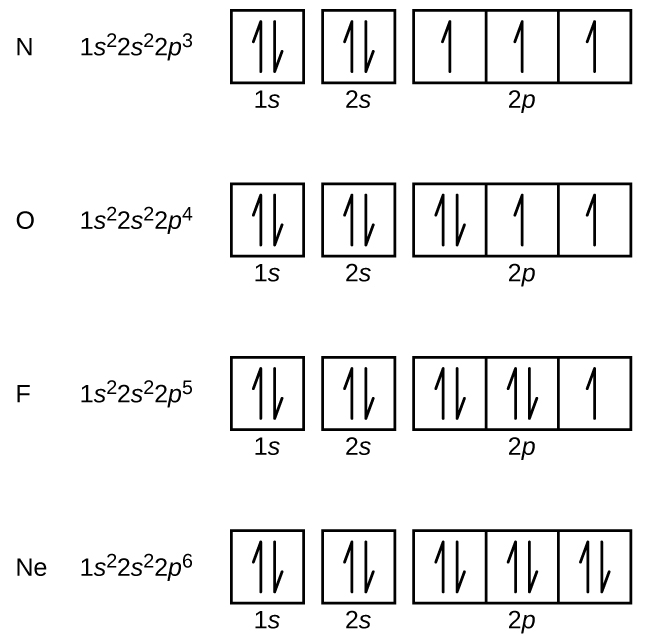
El nitrógeno (número atómico 7) llena las subcubiertas 1s y 2s y tiene un electrón en cada uno de los tres orbitales 2p, de acuerdo con la regla de Hund. Estos tres electrones tienen espines no apareados. El oxígeno (número atómico 8) tiene un par de electrones en cualquiera de los orbitales 2p (los electrones tienen espines opuestos) y un solo electrón en cada uno de los otros dos. El flúor (número atómico 9) sólo tiene un orbital 2p que contiene un electrón no apareado. Todos los electrones del gas noble neón (número atómico 10) están emparejados y todos los orbitales de las capas n = 1 y n = 2 están llenos. Las configuraciones electrónicas y los diagramas orbitales de estos cuatro elementos son:
El metal alcalino sodio (número atómico 11) tiene un electrón más que el átomo de neón. Este electrón debe ir al subesqueleto de menor energía disponible, el orbital 3s, dando una configuración 1s22s22p63s1. Los electrones que ocupan el orbital(es) más externo(s) de la cáscara (valor más alto de n) se llaman electrones de valencia, y los que ocupan los orbitales de la cáscara interna se llaman electrones del núcleo ( Figura \PageIndex5\PageIndex5). Dado que las capas de electrones del núcleo corresponden a las configuraciones electrónicas de los gases nobles, podemos abreviar las configuraciones electrónicas escribiendo el gas noble que corresponde a la configuración electrónica del núcleo, junto con los electrones de valencia en un formato condensado. Para nuestro ejemplo del sodio, el símbolo representa los electrones del núcleo, (1s22s22p6) y nuestra configuración abreviada o condensada es 3s1.

De forma similar, la configuración abreviada del litio puede representarse como 2s1, donde representa la configuración del átomo de helio, que es idéntica a la de la capa interna llena del litio. Al escribir las configuraciones de esta manera se destaca la similitud de las configuraciones del litio y del sodio. Ambos átomos, que pertenecen a la familia de los metales alcalinos, tienen un solo electrón en una subcáscara de valencia s fuera de un conjunto de cáscaras interiores llenas.
{{s^1}{ce{Na:}{s^1}]
El metal alcalinotérreo magnesio (número atómico 12), con sus 12 electrones en una configuración 3s2, es análogo a su miembro de la familia el berilio, 2s2. Ambos átomos tienen un subcaparazón s lleno fuera de sus caparazones interiores llenos. El aluminio (número atómico 13), con 13 electrones y la configuración electrónica 3s23p1, es análogo a su familiar el boro, 2s22p1.
Las configuraciones electrónicas del silicio (14 electrones), el fósforo (15 electrones), el azufre (16 electrones), el cloro (17 electrones) y el argón (18 electrones) son análogas en las configuraciones electrónicas de sus envolturas exteriores a las de sus correspondientes miembros de la familia, el carbono, el nitrógeno, el oxígeno, el flúor y el neón, respectivamente, excepto que el número cuántico principal de la envoltura exterior de los elementos más pesados ha aumentado en uno hasta n = 3. La figura \(\PageIndex{6}\a) muestra la configuración de electrones de menor energía, o de estado básico, para estos elementos, así como la de los átomos de cada uno de los elementos conocidos.
Cuando llegamos al siguiente elemento de la tabla periódica, el metal alcalino potasio (número atómico 19), podríamos esperar que empezáramos a añadir electrones al subcaparazón 3d. Sin embargo, toda la evidencia química y física disponible indica que el potasio es como el litio y el sodio, y que el siguiente electrón no se añade al nivel 3d sino que, en cambio, se añade al nivel 4s (Figura (\PageIndex{3}\) o \(\PageIndex{4}\)). Como se ha comentado anteriormente, el orbital 3d sin nodos radiales tiene mayor energía porque es menos penetrante y está más protegido del núcleo que el 4s, que tiene tres nodos radiales. Así, el potasio tiene una configuración electrónica de 4s1. Por lo tanto, el potasio se corresponde con el Li y el Na en su configuración de la capa de valencia. El siguiente electrón se añade para completar la subcáscara 4s y el calcio tiene una configuración electrónica de 4s2. Esto le da al calcio una configuración de electrones de la cáscara externa correspondiente a la del berilio y el magnesio.
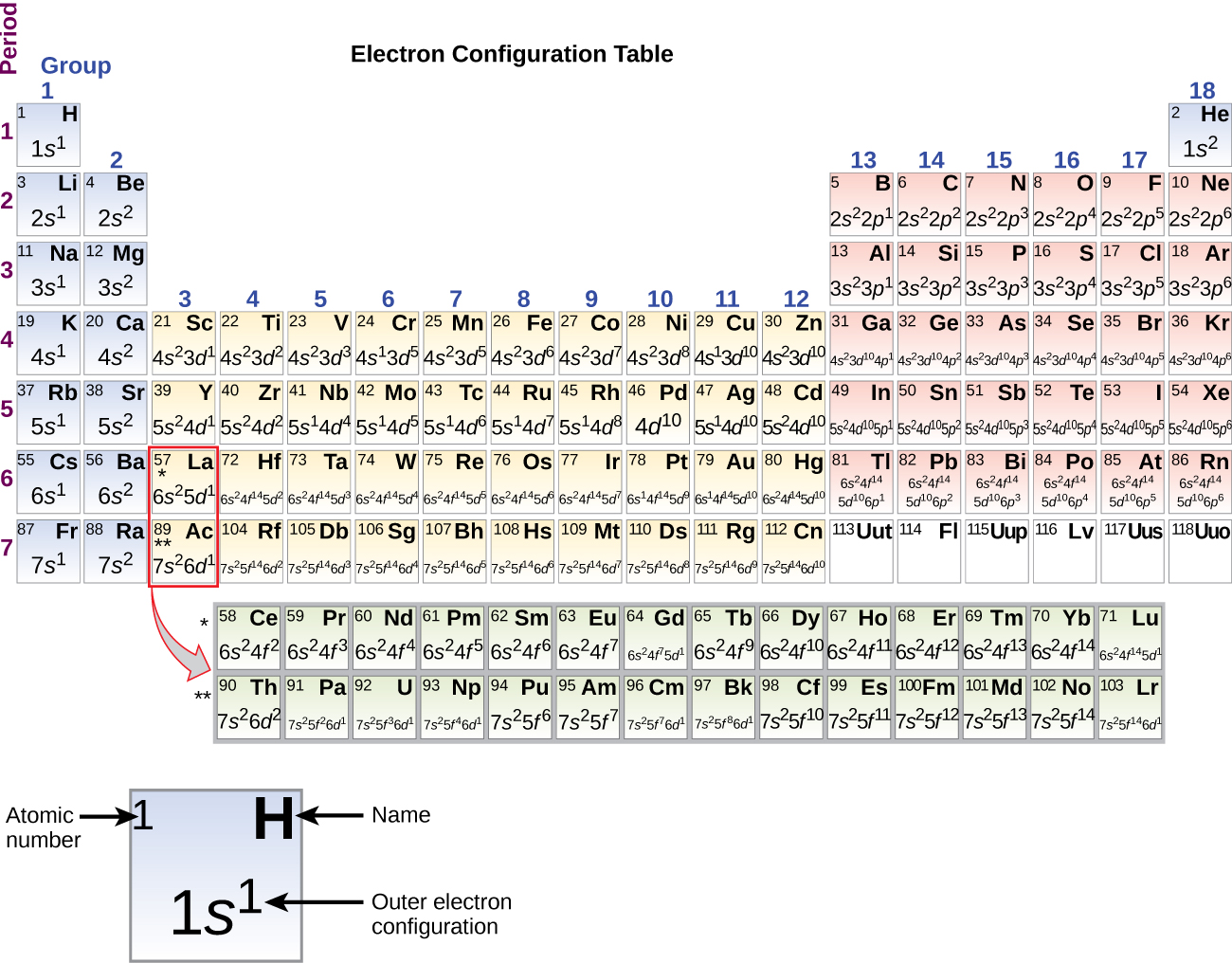
Comenzando con el metal de transición escandio (número atómico 21), se añaden electrones adicionales sucesivamente a la subcáscara 3d. Este subesqueleto se llena hasta su capacidad con 10 electrones (recuerde que para l = 2 , hay 2l + 1 = 5 valores de ml, lo que significa que hay cinco orbitales d que tienen una capacidad combinada de 10 electrones). El subcaparazón 4p es el siguiente en llenarse. Obsérvese que para tres series de elementos, desde el escandio (Sc) hasta el cobre (Cu), desde el itrio (Y) hasta la plata (Ag), y desde el lutecio (Lu) hasta el oro (Au), se añaden sucesivamente un total de 10 electrones d a la cáscara (n – 1) junto a la cáscara n para llevar esa cáscara (n – 1) de 8 a 18 electrones. Para dos series, lantano (La) a través de lutecio (Lu) y actinio (Ac) a través de lawrencio (Lr), 14 electrones f (l = 3, 2l + 1 = 7 valores ml; por lo tanto, siete orbitales con una capacidad combinada de 14 electrones) se añaden sucesivamente a la cáscara (n – 2) para llevar esa cáscara de 18 electrones a un total de 32 electrones.
Ejemplo (\PageIndex{1}\): Números cuánticos y configuraciones electrónicas
¿Cuál es la configuración electrónica y el diagrama de orbitales de un átomo de fósforo? ¿Cuáles son los cuatro números cuánticos para el último electrón añadido?
Solución
El número atómico del fósforo es 15. Por tanto, un átomo de fósforo contiene 15 electrones. El orden de llenado de los niveles de energía es 1s, 2s, 2p, 3s, 3p, 4s, . Los 15 electrones del átomo de fósforo se llenarán hasta el orbital 3p, que contendrá tres electrones:
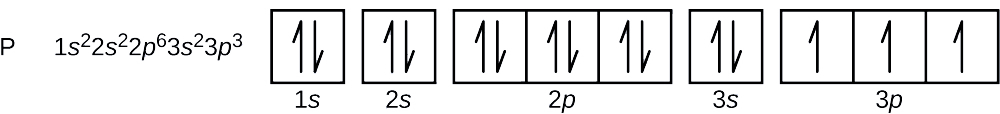
El último electrón añadido es un electrón 3p. Por tanto, n = 3 y, para un orbital tipo p, l = 1. El valor ml puede ser -1, 0 o +1. Los tres orbitales p son degenerados, por lo que cualquiera de estos valores de ml es correcto. Para los electrones no apareados, la convención asigna el valor de \\dfrac{1}{2}{} para el número cuántico de espín; por lo tanto, \(m_s=+\dfrac{1}{2}{}).
Ejercicio \(\PageIndex{1})
Identificar los átomos a partir de las configuraciones electrónicas dadas:
- 4s23d5
- 5s24d105p6
Respuesta a
Mn
Respuesta b
Xe
La tabla periódica puede ser una potente herramienta para predecir la configuración electrónica de un elemento. Sin embargo, encontramos excepciones al orden de llenado de los orbitales que se muestran en la Figura \(\PageIndex{3}) o \(\PageIndex{4}). Por ejemplo, las configuraciones electrónicas de los metales de transición cromo (Cr; número atómico 24) y cobre (Cu; número atómico 29), entre otros, no son las que esperaríamos. En general, tales excepciones implican subcubiertas con energía muy similar, y pequeños efectos pueden llevar a cambios en el orden de llenado.
En el caso del Cr y el Cu, encontramos que las subcubiertas semillenas y completamente llenas representan aparentemente condiciones de estabilidad preferida. Esta estabilidad es tal que un electrón se desplaza del orbital 4s al 3d para ganar la estabilidad extra de una subcapa 3d medio llena (en Cr) o una subcapa 3d llena (en Cu). También se dan otras excepciones. Por ejemplo, se predice que el niobio (Nb, número atómico 41) tiene la configuración electrónica 5s24d3. Experimentalmente, observamos que su configuración electrónica en estado básico es en realidad 5s14d4. Podemos racionalizar esta observación diciendo que las repulsiones electrón-electrón experimentadas al emparejar los electrones en el orbital 5s son mayores que la brecha de energía entre los orbitales 5s y 4d. No existe un método sencillo para predecir las excepciones de los átomos en los que la magnitud de las repulsiones entre los electrones es mayor que las pequeñas diferencias de energía entre los subcapítulos.