Čisté látky a směsi
Čistá chemická látka je každá látka, která má pevné chemické složení a charakteristické vlastnosti. Například kyslík je čistá chemická látka, která je při teplotě 25 °C bezbarvý plyn bez zápachu. Jen velmi málo vzorků látek se skládá z čistých látek; místo toho se většinou jedná o směsi, což jsou kombinace dvou nebo více čistých látek v různých poměrech, ve kterých si jednotlivé látky zachovávají svou identitu. Vzduch, voda z vodovodu, mléko, sýr, chléb a hlína jsou směsi. Pokud jsou všechny části materiálu ve stejném stavu, nemají viditelné hranice a jsou v celém objemu homogenní, pak je materiál homogenní. Příkladem homogenní směsi je vzduch, který dýcháme, a voda z vodovodu, kterou pijeme. Homogenní směsi se také nazývají roztoky. Vzduch je tedy roztokem dusíku, kyslíku, vodní páry, oxidu uhličitého a několika dalších plynů; voda z vodovodu je roztokem malých množství několika látek ve vodě. Konkrétní složení obou těchto roztoků však není pevné, ale závisí jak na zdroji, tak na místě; například složení vody z vodovodu v Boise ve státě Idaho není stejné jako složení vody z vodovodu v Buffalu ve státě New York. Ačkoli většina roztoků, se kterými se setkáváme, je kapalná, roztoky mohou být i pevné. Šedá látka, kterou někteří zubaři stále používají k vyplňování zubních kazů, je složitý pevný roztok, který obsahuje 50 % rtuti a 50 % prášku, který obsahuje převážně stříbro, cín a měď s malým množstvím zinku a rtuti. Pevné roztoky dvou nebo více kovů se běžně nazývají slitiny.
Pokud složení materiálu není zcela homogenní, pak je heterogenní (např. těsto na čokoládové sušenky, modrý sýr a hlína). U směsí, které se zdají být homogenní, se po mikroskopickém zkoumání často zjistí, že jsou heterogenní. Například mléko se zdá být homogenní, ale při zkoumání pod mikroskopem se zřetelně skládá z drobných kuliček tuku a bílkovin rozptýlených ve vodě. Složky heterogenních směsí lze obvykle oddělit jednoduchými prostředky. Směsi pevné látky a kapaliny, jako je písek ve vodě nebo čajové lístky v čaji, se snadno oddělí filtrací, která spočívá v průchodu směsi přes bariéru, například sítko, s otvory nebo póry, které jsou menší než pevné částice. Směsi dvou nebo více pevných látek, jako je cukr a sůl, lze v zásadě oddělit mikroskopickou kontrolou a tříděním. Obvykle jsou však nutné složitější operace, například při oddělování zlatých nugetů od říčního štěrku rýžováním. Nejprve se z říční vody odfiltruje pevný materiál a poté se pevné látky oddělí kontrolou. Pokud je zlato uloženo v hornině, může být nutné jej izolovat pomocí chemických metod.
-and-Milk-(left).jpg?revision=1)
Obrázek 1.2.2: Heterogenní směs. Pod mikroskopem je plnotučné mléko ve skutečnosti heterogenní směs složená z kuliček tuku a bílkovin rozptýlených ve vodě. Obrázek použit se svolením Wikipedie
Homogenní směsi (roztoky) lze rozdělit na jednotlivé složky pomocí fyzikálních procesů, které se opírají o rozdíly v některé fyzikální vlastnosti, například o rozdíly v jejich bodech varu. Dvěma z těchto separačních metod jsou destilace a krystalizace. Destilace využívá rozdílů v těkavosti, což je míra toho, jak snadno se látka při dané teplotě mění na plyn. Jednoduchý destilační přístroj pro oddělení směsi látek, z nichž alespoň jedna je kapalná. Nejtěkavější složka se nejprve vaří a kondenzuje zpět na kapalinu ve vodou chlazeném kondenzátoru, z něhož vytéká do přijímací baňky. Pokud se například destiluje roztok soli a vody, těkavější složka, čistá voda, se shromažďuje v přijímací baňce, zatímco sůl zůstává v destilační baňce.

Obrázek 1.2.3: Destilace roztoku kuchyňské soli ve vodě. Roztok soli ve vodě se zahřívá v destilační baňce, dokud nezačne vřít. Vzniklá pára je obohacena o těkavější složku (vodu), která ve studeném kondenzátoru zkondenzuje na kapalinu a poté se shromažďuje v přijímací baňce.
Složitějším destilačním přístrojem lze oddělit směsi dvou nebo více kapalin s různými body varu. Jedním z příkladů je rafinace surové ropy na řadu užitečných produktů: letecké palivo, benzín, petrolej, motorovou naftu a mazací olej (v přibližném pořadí podle klesající těkavosti). Dalším příkladem je destilace alkoholických nápojů, jako je brandy nebo whisky. Tento relativně jednoduchý postup způsobil federálním úřadům ve 20. letech 20. století v době prohibice, kdy se v odlehlých oblastech Spojených států rozšířily nelegální palírny, nejednu bolest hlavy.
Krystalizace odděluje směsi na základě rozdílů v rozpustnosti, což je míra toho, kolik pevné látky zůstane rozpuštěno v daném množství určité kapaliny. Většina látek je rozpustnější při vyšších teplotách, takže směs dvou nebo více látek lze rozpustit při zvýšené teplotě a poté nechat pomalu vychladnout. Alternativně lze kapalinu, nazývanou rozpouštědlo, nechat odpařit. V obou případech nejméně rozpustná z rozpuštěných látek, tedy ta, která má nejmenší šanci zůstat v roztoku, obvykle vytvoří krystaly jako první a tyto krystaly lze ze zbývajícího roztoku odstranit filtrací.

Obrázek 1.2.4: Krystalizace octanu sodného z koncentrovaného roztoku octanu sodného ve vodě. Přidání malého „zárodečného“ krystalu (a) způsobí, že sloučenina začne tvořit bílé krystaly, které rostou a nakonec zabírají většinu baňky. Video naleznete zde: https://www.youtube.com/watch?v=BLq5NibwV5g
Většinu směsí lze rozdělit na čisté látky, které mohou být buď prvky, nebo sloučeniny. Prvek, například šedý kovový sodík, je látka, kterou nelze chemickými změnami rozložit na jednodušší; sloučenina, například bílý krystalický chlorid sodný, obsahuje dva nebo více prvků a má chemické a fyzikální vlastnosti, které se obvykle liší od vlastností prvků, z nichž se skládá. Až na několik výjimek má určitá sloučenina stejné prvkové složení (stejné prvky ve stejném poměru) bez ohledu na svůj zdroj nebo historii. Chemické složení látky se mění v procesu, který se nazývá chemická změna. Příkladem chemické změny, často nazývané chemická reakce, je přeměna dvou nebo více prvků, například sodíku a chloru, na chemickou sloučeninu chlorid sodný. V současné době je známo asi 115 prvků, ale z těchto 115 prvků byly připraveny miliony chemických sloučenin. Známé prvky jsou uvedeny v periodické tabulce.
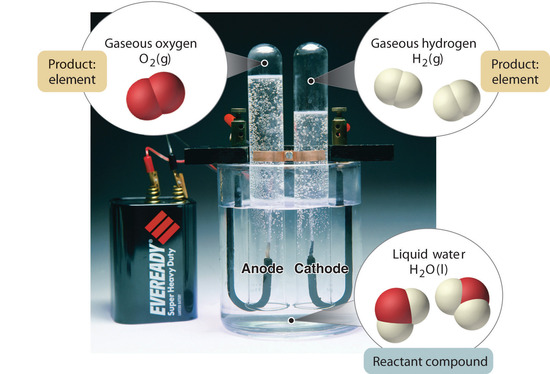
Obrázek 1.2.5: Rozklad vody na vodík a kyslík elektrolýzou. Voda je chemická sloučenina; vodík a kyslík jsou prvky.
Obecně platí, že zpětným chemickým procesem se sloučeniny rozkládají na své prvky. Například vodu (sloučeninu) lze rozložit na vodík a kyslík (oba prvky) procesem zvaným elektrolýza. Při elektrolýze dodává elektřina energii potřebnou k rozdělení sloučeniny na její prvky (obrázek 1.2.5). Podobná technika se v rozsáhlém měřítku používá k získávání čistého hliníku, prvku, z jeho rud, které jsou směsí sloučenin. Protože elektrolýza vyžaduje velké množství energie, jsou náklady na elektřinu zdaleka největším výdajem při výrobě čistého hliníku. Recyklace hliníku je tedy nákladově efektivní a ekologická. Celkové uspořádání hmoty a metody používané k separaci směsí jsou shrnuty na obrázku 1.2.6.
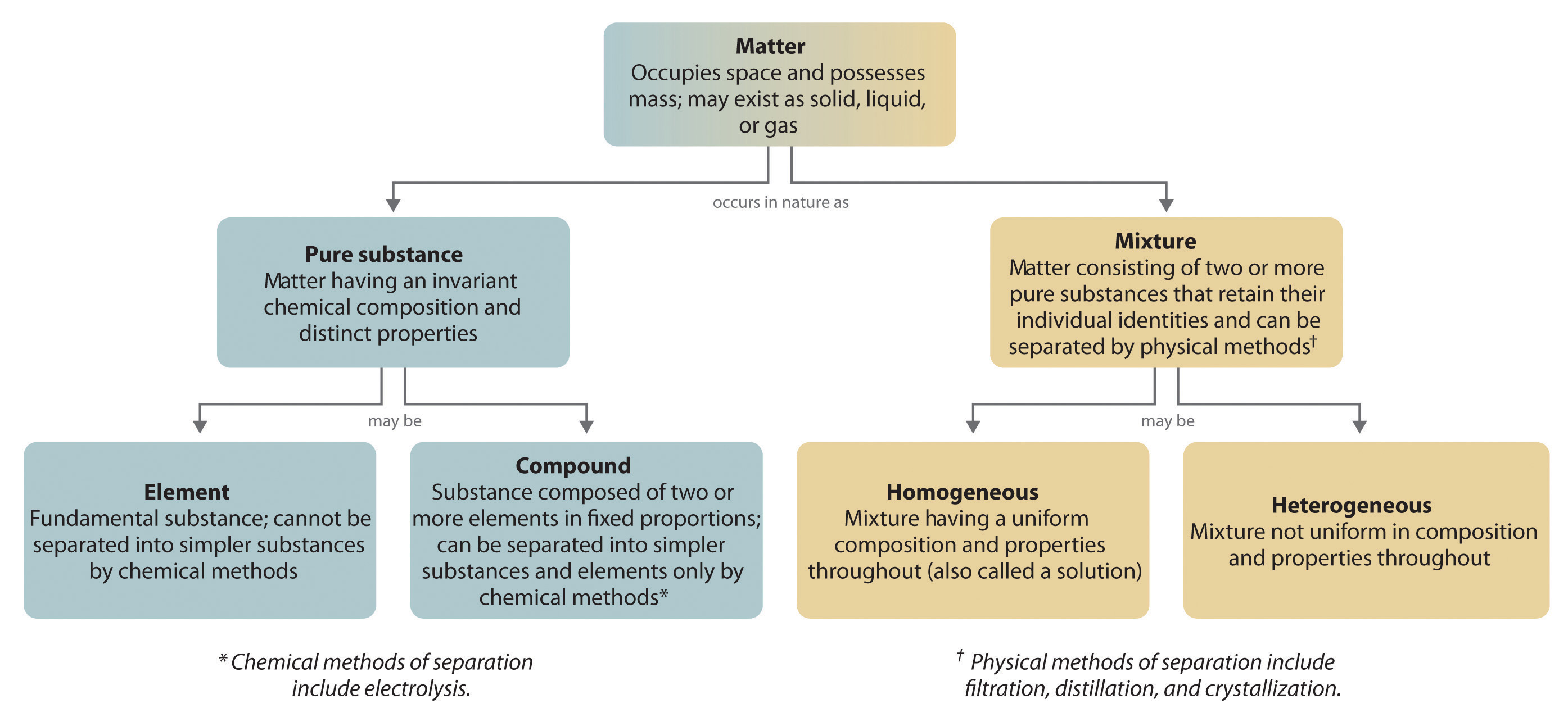
Obrázek 1.2.6: Vztahy mezi druhy látek a metodami používanými k dělení směsí
Příklad 1.2.1
Určete každou látku jako sloučeninu, prvek, heterogenní směs nebo homogenní směs (roztok).
- filtrovaný čaj
- čerstvě vymačkaná pomerančová šťáva
- kompaktní disk
- oxid hlinitý, bílý prášek, který obsahuje 2. Které z těchto látek jsou vhodné?3 poměru atomů hliníku a kyslíku
- selen
Dáno: chemická látka
Ptáno: její klasifikace
Strategie:
- Rozhodněte, zda je látka chemicky čistá. Pokud je látka čistá, jedná se buď o prvek, nebo o sloučeninu. Pokud lze látku rozdělit na prvky, jedná se o sloučeninu.
- Pokud látka není chemicky čistá, jedná se buď o heterogenní směs, nebo o homogenní směs. Pokud je její složení v celém objemu stejné, jedná se o homogenní směs.
Roztok:
- Čaj je roztok sloučenin ve vodě, není tedy chemicky čistý. Obvykle se odděluje od čajových lístků filtrací. B Protože složení roztoku je v celém objemu stejné, jedná se o homogenní směs.
- A Pomerančová šťáva obsahuje částice pevné látky (dužinu) i kapalinu; není chemicky čistá. B Protože jeho složení není v celém objemu rovnoměrné, je pomerančový džus heterogenní směsí.
- A Kompaktní disk je pevný materiál, který obsahuje více než jeden prvek, přičemž na jeho okraji jsou viditelné oblasti s různým složením. Kompaktní disk tedy není chemicky čistý. B Oblasti různého složení naznačují, že kompaktní disk je heterogenní směs.
- A Oxid hlinitý je jediná, chemicky čistá sloučenina.
- A Selen je jedním ze známých prvků.
Cvičení 1.2.1
Určete každou látku jako sloučeninu, prvek, heterogenní směs nebo homogenní směs (roztok).
- bílé víno
- rtuť
- ranžírovaná zálivka na salát
- stolní cukr (sacharóza)
Odpověď:
- roztok
- prvek
- heterogenní směs
- sloučenina
Souhrn
Hmotu lze klasifikovat podle fyzikálních a chemických vlastností. Hmota je vše, co zaujímá prostor a má hmotnost. Tři stavy hmoty jsou pevné, kapalné a plynné. Fyzikální změna zahrnuje přeměnu látky z jednoho skupenství hmoty do jiného, aniž by se změnilo její chemické složení. Většinu hmoty tvoří směsi čistých látek, které mohou být homogenní (stejnorodé složení) nebo heterogenní (různé oblasti mají různé složení a vlastnosti). Čisté látky mohou být buď chemické sloučeniny, nebo prvky. Sloučeniny lze chemickými reakcemi rozložit na prvky, ale prvky nelze chemickými prostředky rozdělit na jednodušší látky. Vlastnosti látek lze klasifikovat jako fyzikální nebo chemické. Fyzikální vlastnosti mohou vědci pozorovat bez změny složení látky, zatímco chemické vlastnosti popisují tendenci látky podléhat chemickým změnám (chemickým reakcím), které mění její chemické složení. Fyzikální vlastnosti mohou být intenzivní nebo extenzivní. Intenzivní vlastnosti jsou stejné pro všechny vzorky, nezávisí na velikosti vzorku a zahrnují například barvu, fyzikální stav a teplotu tání a varu. Extenzivní vlastnosti závisí na množství materiálu a zahrnují hmotnost a objem. Poměr dvou extenzivních vlastností, hmotnosti a objemu, je důležitou intenzivní vlastností, která se nazývá hustota.
Přispěvatelé
Zpracoval Joshua Halpern (Howard University)