Tiszta anyagok és keverékek
A tiszta kémiai anyag minden olyan anyag, amely meghatározott kémiai összetétellel és jellemző tulajdonságokkal rendelkezik. Az oxigén például tiszta kémiai anyag, amely 25°C-on színtelen, szagtalan gáz. Nagyon kevés anyagminta áll tiszta anyagokból; ehelyett a legtöbbjük keverék, amely két vagy több tiszta anyag változó arányú kombinációja, amelyben az egyes anyagok megőrzik azonosságukat. A levegő, a csapvíz, a tej, a kéksajt, a kenyér és a piszok mind keverékek. Ha egy anyag minden része azonos állapotban van, nincsenek látható határai, és mindenütt egyforma, akkor az anyag homogén. Homogén keverékre példa a levegő, amit belélegzünk, és a csapvíz, amit iszunk. A homogén keverékeket oldatoknak is nevezik. Így a levegő nitrogén, oxigén, vízgőz, szén-dioxid és számos más gáz oldata, a csapvíz pedig több anyag kis mennyiségű, vízben lévő oldata. Mindkét oldat sajátos összetétele azonban nem állandó, hanem a forrástól és a helytől is függ; például az idahói Boise város csapvízének összetétele nem azonos a New York-i Buffalo város csapvízének összetételével. Bár a legtöbb oldat, amellyel találkozunk, folyékony, az oldatok lehetnek szilárdak is. Az a szürke anyag, amelyet egyes fogorvosok még mindig használnak fogszuvasodások betömésére, egy összetett szilárd oldat, amely 50%-ban higanyt és 50%-ban olyan port tartalmaz, amely főként ezüstöt, ónt és rezet tartalmaz, kis mennyiségű cinkkel és higannyal. Két vagy több fém szilárd oldatait általában ötvözeteknek nevezik.
Ha egy anyag összetétele nem teljesen egységes, akkor heterogén (pl. csokis süteménytészta, kék sajt és piszok). A homogénnek tűnő keverékekről mikroszkópos vizsgálat után gyakran kiderül, hogy heterogének. A tej például homogénnek tűnik, de ha mikroszkóp alatt vizsgáljuk, egyértelműen vízben eloszló apró zsír- és fehérjegömbökből áll. A heterogén keverékek összetevői általában egyszerű eszközökkel szétválaszthatók. A szilárd-folyadék keverékek, mint például a homok a vízben vagy a tealevelek a teában, könnyen szétválaszthatók szűréssel, amely abból áll, hogy a keveréket egy olyan akadályon, például szűrőn vezetjük át, amelynek lyukai vagy pórusai kisebbek, mint a szilárd részecskék. Elvileg két vagy több szilárd anyag, például cukor és só keverékei mikroszkópos vizsgálattal és válogatással elválaszthatók. Általában azonban bonyolultabb műveletekre van szükség, mint például az aranyrögök elválasztása a folyami kavicsból mosogatással. Először a folyóvízből kiszűrik a szilárd anyagokat, majd a szilárd anyagokat szemrevételezéssel szétválasztják. Ha az arany kőzetbe ágyazódott, előfordulhat, hogy kémiai módszerekkel kell elkülöníteni.
-and-Milk-(left).jpg?revision=1)
1.2.2. ábra: Heterogén keverék. Mikroszkóp alatt a teljes tej valójában heterogén keverék, amely vízben eloszlatott zsír- és fehérjegömbökből áll. Az ábra a Wikipédia engedélyével
A homogén keverékek (oldatok) szétválaszthatók alkotóelemeikre olyan fizikai folyamatok segítségével, amelyek valamilyen fizikai tulajdonság, például a forráspontjuk különbségeire támaszkodnak. Két ilyen elválasztási módszer a desztilláció és a kristályosítás. A desztilláció az illékonyság különbségeit használja ki, ami azt mutatja, hogy egy anyag adott hőmérsékleten milyen könnyen alakul gázzá. Egyszerű desztillációs készülék olyan anyagok keverékének elválasztására, amelyek közül legalább az egyik folyadék. A legillékonyabb komponens forr először, és a vízzel hűtött kondenzátorban folyadékká sűrűsödik vissza, ahonnan a befogadó lombikba folyik. Ha például só és víz oldatát desztilláljuk, akkor az illékonyabb komponens, a tiszta víz a befogadó lombikban gyűlik össze, míg a só a desztilláló lombikban marad.

1.2.3. ábra: Étkezési só vízben oldott oldatának desztillációja. A só vízben lévő oldatát a desztilláló lombikban forrásig melegítjük. A keletkező gőz az illékonyabb komponenssel (vízzel) gazdagodik, amely a hideg kondenzátorban folyadékká kondenzálódik, majd a befogadó lombikban összegyűjtik.
Két vagy több, eltérő forráspontú folyadék keveréke bonyolultabb desztillációs készülékkel választható szét. Egy példa erre a nyers kőolaj finomítása egy sor hasznos termékké: repülőgép-üzemanyaggá, benzinné, kerozinná, dízelüzemanyaggá és kenőolajjá (a csökkenő illékonysági sorrendben). Egy másik példa az alkoholos szeszes italok, például a brandy vagy a whisky lepárlása. Ez a viszonylag egyszerű eljárás nem kevés fejfájást okozott a szövetségi hatóságoknak az 1920-as években, a szesztilalom idején, amikor az Egyesült Államok távoli vidékein elszaporodtak az illegális lepárlók.
A kristályosítás az oldhatósági különbségek alapján választja el a keverékeket, ami azt mutatja, hogy egy adott mennyiségű folyadékban mennyi szilárd anyag marad oldva. A legtöbb anyag magasabb hőmérsékleten jobban oldódik, ezért két vagy több anyag keverékét magas hőmérsékleten lehet feloldani, majd lassan hűlni hagyni. Alternatív megoldásként az oldószernek nevezett folyadékot hagyhatjuk elpárologni. Mindkét esetben az oldott anyagok közül általában a legkevésbé oldódó, az oldatban legkevésbé megmaradó anyag képez először kristályokat, és ezeket a kristályokat szűréssel lehet eltávolítani a maradék oldatból.

1.2.4. ábra: A nátrium-acetát kristályosodása a nátrium-acetát vízben lévő koncentrált oldatából. Egy kis “csírakristály” (a) hozzáadásával a vegyület fehér kristályokat képez, amelyek növekednek és végül a lombik nagy részét elfoglalják. A videó itt található: https://www.youtube.com/watch?v=BLq5NibwV5g
A legtöbb keveréket tiszta anyagokra lehet szétválasztani, amelyek lehetnek elemek vagy vegyületek. Az elem, például a szürke, fémes nátrium, olyan anyag, amely kémiai változásokkal nem bontható egyszerűbbekre; a vegyület, például a fehér, kristályos nátrium-klorid, két vagy több elemet tartalmaz, és kémiai és fizikai tulajdonságai általában eltérnek azoknak az elemeknek a tulajdonságaitól, amelyekből áll. Néhány kivételtől eltekintve egy adott vegyületnek a forrásától vagy történetétől függetlenül ugyanaz az elemi összetétele (ugyanazok az elemek ugyanolyan arányban). Egy anyag kémiai összetétele egy kémiai változásnak nevezett folyamat során változik meg. Két vagy több elem, például nátrium és klór átalakulása egy kémiai vegyületté, nátrium-kloriddá, példa a kémiai változásra, amelyet gyakran kémiai reakciónak neveznek. Jelenleg körülbelül 115 elemet ismerünk, de ebből a 115 elemből már több millió kémiai vegyületet állítottak elő. Az ismert elemek a periódusos rendszerben vannak felsorolva.
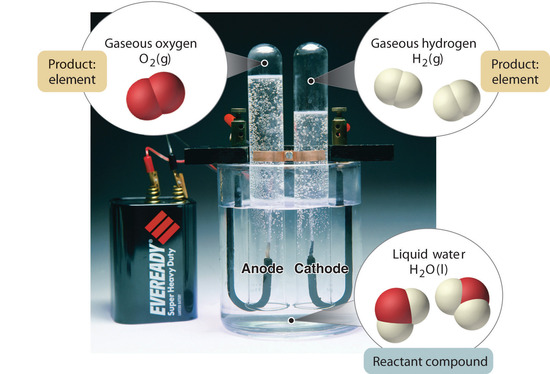
1.2.5. ábra: A víz bomlása hidrogénre és oxigénre elektrolízissel. A víz kémiai vegyület; a hidrogén és az oxigén elemek.
A vegyületeket általában egy fordított kémiai folyamat bontja elemeire. Például a víz (egy vegyület) hidrogénre és oxigénre (mindkettő elem) bontható az elektrolízisnek nevezett eljárással. Az elektrolízis során az elektromosság biztosítja a vegyület alkotóelemeire való szétválasztásához szükséges energiát (1.2.5. ábra). Hasonló technikát alkalmaznak nagy mennyiségben, hogy tiszta alumíniumot, egy elemet nyerjenek az ércekből, amelyek vegyületek keverékei. Mivel az elektrolízishez nagy mennyiségű energiára van szükség, az elektromos áram költsége messze a legnagyobb költség, amely a tiszta alumínium előállítása során felmerül. Így az alumínium újrahasznosítása egyszerre költséghatékony és környezetbarát. Az anyag általános szerveződését és a keverékek szétválasztására használt módszereket az 1.2.6. ábra foglalja össze.
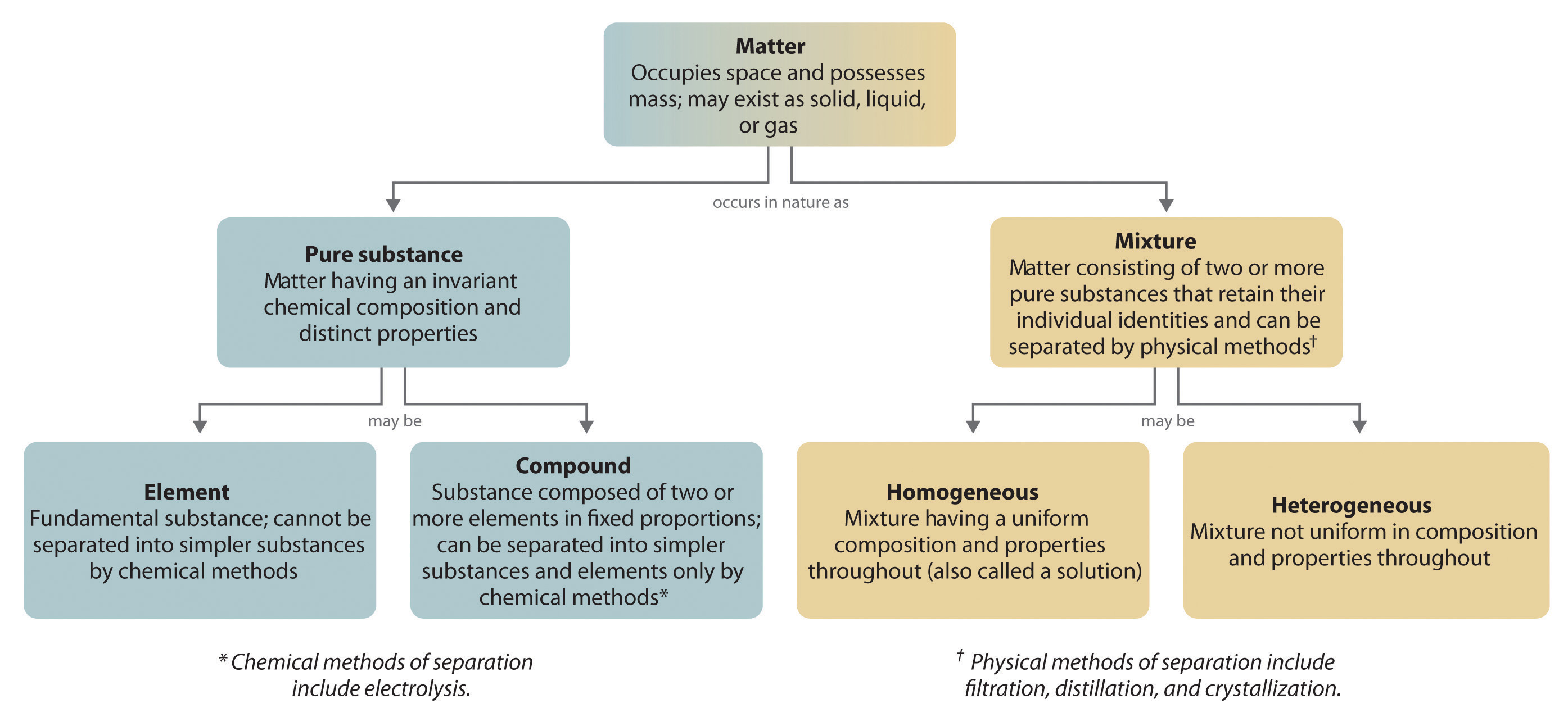
1.2.6. ábra: Az anyagtípusok és a keverékek szétválasztására használt módszerek közötti összefüggések
Példa 1.2.1
Az egyes anyagokat vegyületként, elemként, heterogén keverékként vagy homogén keverékként (oldatként) azonosítjuk.
- szűrt tea
- frissen facsart narancslé
- kompakt lemez
- alumínium-oxid, fehér por, amely 2:Az alumínium és az oxigén atomok aránya 3
- szelén
Adott: egy kémiai anyag
Kérdezett: az osztályozása
Stratégia:
- Eldönteni, hogy egy anyag kémiailag tiszta-e. Ha tiszta, akkor az anyag vagy elem, vagy vegyület. Ha egy anyag elemeire szétválasztható, akkor vegyület.
- Ha egy anyag kémiailag nem tiszta, akkor vagy heterogén keverék, vagy homogén keverék. Ha az összetétele mindenütt egységes, akkor homogén keverék.
Az oldat:
- A tea vegyületek vízben oldott oldata, tehát kémiailag nem tiszta. Általában szűréssel választják el a tealevelekből. B Mivel az oldat összetétele végig egységes, homogén keverékről van szó.
- A A narancslé szilárd részecskéket (pépet) és folyadékot is tartalmaz, kémiailag nem tiszta. B Mivel az összetétele nem mindenütt egyenletes, a narancslé heterogén keverék.
- A A kompakt lemez olyan szilárd anyag, amely egynél több elemet tartalmaz, és a pereme mentén különböző összetételű területek láthatók. Ezért a kompaktlemez kémiailag nem tiszta. B Az eltérő összetételű régiók azt jelzik, hogy a kompaktlemez heterogén keverék.
- A Az alumínium-oxid egyetlen, kémiailag tiszta vegyület.
- A A szelén az egyik ismert elem.
GYakorlat 1.2.1
Az egyes anyagokat nevezzük vegyületnek, elemnek, heterogén elegynek vagy homogén elegynek (oldatnak).
- oldat
- elem
- heterogén keverék
- összetétel
Összefoglaló
Az anyagokat fizikai és kémiai tulajdonságaik alapján lehet osztályozni. Anyag minden, ami helyet foglal és tömeggel rendelkezik. Az anyag három halmazállapota a szilárd, a folyékony és a gáz. A fizikai változás egy anyagnak az egyik halmazállapotból egy másikba való átalakulását jelenti, anélkül, hogy kémiai összetétele megváltozna. A legtöbb anyag tiszta anyagok keverékeiből áll, amelyek lehetnek homogének (egységes összetételűek) vagy heterogének (a különböző területek különböző összetételűek és tulajdonságúak). A tiszta anyagok lehetnek kémiai vegyületek vagy elemek. A vegyületek kémiai reakciókkal elemekre bonthatók, de az elemek kémiai úton nem választhatók szét egyszerűbb anyagokra. Az anyagok tulajdonságai fizikai vagy kémiai tulajdonságokba sorolhatók. A tudósok a fizikai tulajdonságokat az anyag összetételének megváltoztatása nélkül is megfigyelhetik, míg a kémiai tulajdonságok az anyag azon hajlamát írják le, hogy kémiai változásokon (kémiai reakciókon) megy keresztül, amelyek megváltoztatják az anyag kémiai összetételét. A fizikai tulajdonságok lehetnek intenzívek vagy extenzívek. Az intenzív tulajdonságok minden minta esetében azonosak; nem függnek a minta méretétől; és ide tartoznak például a szín, a fizikai állapot, valamint az olvadási és forráspontok. Az extenzív tulajdonságok az anyag mennyiségétől függnek, és magukban foglalják a tömeget és a térfogatot. A két extenzív tulajdonság, a tömeg és a térfogat aránya egy fontos intenzív tulajdonság, a sűrűség.
Megosztók
Módosította Joshua Halpern (Howard Egyetem)