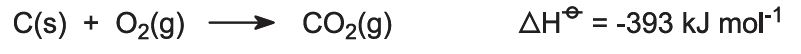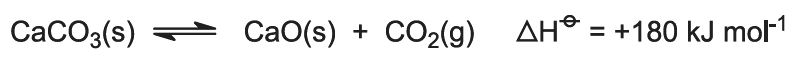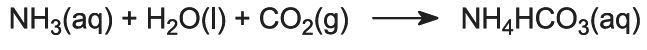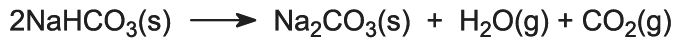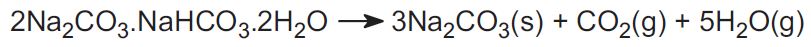- Použití uhličitanu sodného
- Roční výroba uhličitanu sodného
- Výroba uhličitanu sodného
- (a) Z chloridu sodného a uhličitanu vápenatého
- (1) Amoniace solanky
- (2) Tvorba oxidu vápenatého a oxidu uhličitého
- (3) Solvayova věž
- (4) Oddělení pevného hydrogenuhličitanu sodného
- (5) Tvorba uhličitanu sodného
- (6) Tvorba hydroxidu vápenatého
- (7) Regenerace amoniaku
- (b) Z tronových a nahcolitových rud
Použití uhličitanu sodného
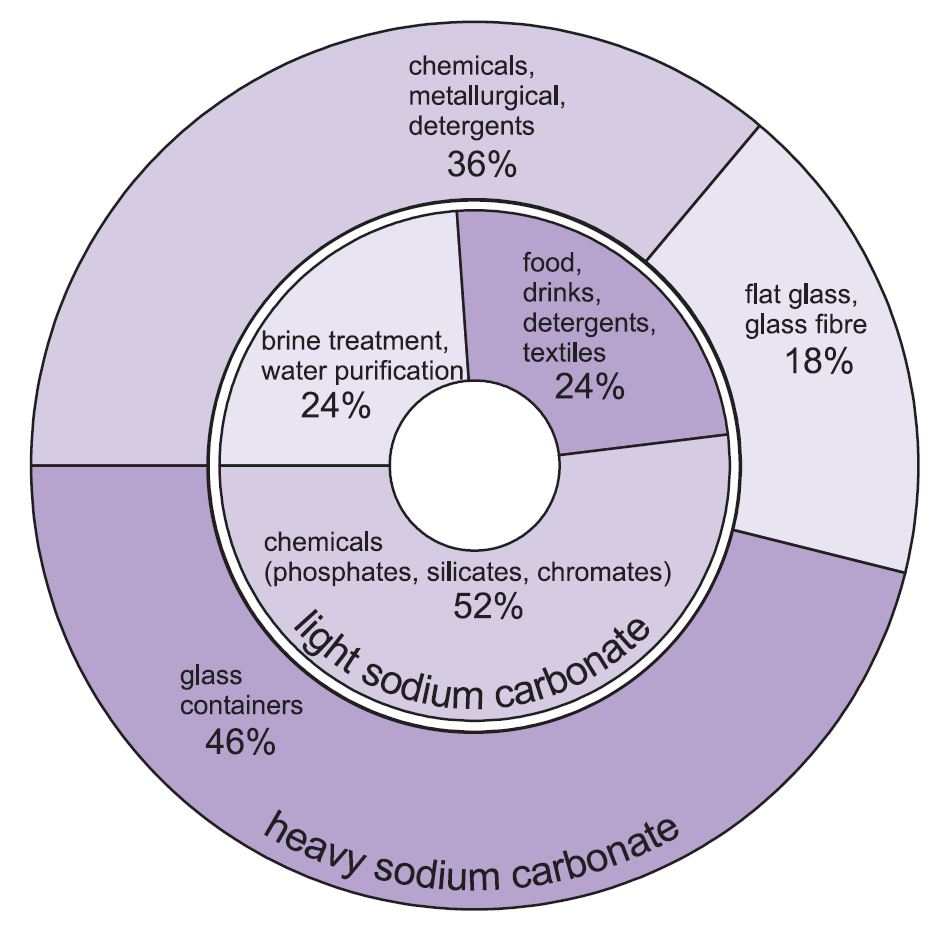
Používají se dvě formy uhličitanu sodného (uhličitanu sodného) -těžká a lehká. Nejprve se získá lehká forma a část se pak přemění na těžkou formu. Lehký uhličitan sodný obsahuje méně než 0,5 % chloridu sodného. Těžký uhličitan sodný se získává hydratací lehkého uhličitanu sodného na monohydrát (Na2CO3.H2O) a jeho následnou dehydratací, čímž se získá produkt se zvýšenou velikostí a hustotou krystalů.
Obě formy mají různé použití.
Hlavní použití těžkého uhličitanu sodného je jako pevná látka, zejména při výrobě skla, kde se používá jako tavidlo při tavení oxidu křemičitého (písku).
Použití lehkého uhličitanu sodného je tradičně tam, kde se vyžaduje chemická látka v roztoku.
Obrázek 1 Použití těžkého i lehkého uhličitanu sodného.
Přibližně 50 % celkové produkce uhličitanu sodného se používá k výrobě skla, 18 % k výrobě jiných chemických látek a 10 % v mýdlech a pracích prostředcích.
Roční výroba uhličitanu sodného
Čína je největším světovým výrobcem uhličitanu sodného, který se na světové výrobě podílí 46 % a USA 23 %. (IHS Markit, 2015)
| Svět | 52 milionů tun1,2 |
| Čína | 25 milionů tun3 |
| USA. | 12 milionů tun1 |
| Evropa | 11 milionů tun |
| Rusko | 0.71 milionů tun4 |
Údaje z:
1. 2018 Elements of the Business of Chemistry, American Chemistry Council.
2. Z toho se těží 14,7 tun. Převážná většina se těží v USA (11,7 milionu tun) a v Turecku (2 miliony tun). Zbytek se vyrábí z chloridu sodného a uhličitanu vápenatého.
3. IHS Markit, 2015
4. Federální státní statistická služba: Ruská federace 2011
Výroba uhličitanu sodného
Existují dva hlavní zdroje uhličitanu sodného:
a) ze soli a uhličitanu vápenatého (procesem sody amonné (Solvay))
b) z uhličitanu sodného a hydrogenuhličitanových rud (trona a nahcolitu)
(a) Z chloridu sodného a uhličitanu vápenatého
Celkovou reakci lze považovat za reakci mezi uhličitanem vápenatým a chloridem sodným:
Uhličitan vápenatý je však příliš nerozpustný na to, aby reagoval s roztokem soli. Místo toho se produkt získává sérií sedmi stupňů.
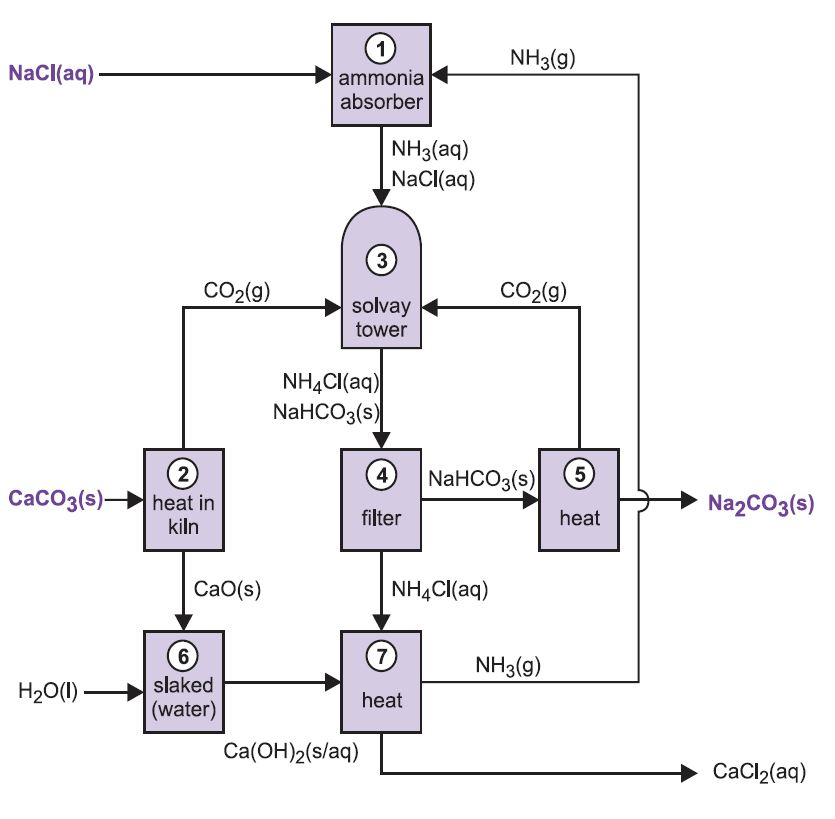
Postup je znám jako amoniakálně-sodný proces nebo Solvayův proces, pojmenovaný podle belgického průmyslového chemika, který si jej nechal patentovat v roce 186I.
Různé stupně Solvayova procesu jsou vzájemně propojeny, jak je patrné ze schématu a popisu níže.
Obrázek 2 Různé fáze Solvayova procesu.
(1) Amoniace solanky
Plynný amoniak se absorbuje v koncentrované solance, čímž vznikne roztok obsahující chlorid sodný i amoniak. Jsou přítomny ionty Na+(aq), Cl-(aq), NH4+(aq), OH-(aq) a NH3(aq).
(2) Tvorba oxidu vápenatého a oxidu uhličitého
Do pecí se přivádí směs vápence a koksu (13:1 hm.). Koks hoří v protiproudu předehřátého vzduchu:
Spalovací teplo zvyšuje teplotu pece a vápenec se rozkládá:
Plyn, obsahující přibližně 40 % oxidu uhličitého, se zbavuje vápenného prachu a posílá se do karbonizačních (Solvayových) věží. Zbytek, oxid vápenatý, se používá při získávání amoniaku (viz krok 7 níže).
(3) Solvayova věž
Jedná se o klíčovou fázi procesu. Solvayovou věží prochází dolů amoniakovaný solný roztok z kroku (1), zatímco oxid uhličitý z kroků (2) a (5) prochází nahoru. Solvayova věž je vysoká a obsahuje sadu hřibovitých přepážek, které zpomalují a rozbíjejí proudění kapaliny, aby mohl být oxid uhličitý účinně absorbován roztokem. Oxid uhličitý při rozpouštění reaguje s rozpuštěným amoniakem za vzniku hydrogenuhličitanu amonného:
Roztok nyní obsahuje ionty Na+(aq), Cl-(aq), NH4+(aq) a HCO3-(aq). Ze čtyř látek, které by mohly vzniknout různými kombinacemi těchto iontů, je hydrogenuhličitan sodný (NaHCO3) nejméně rozpustný. Sráží se jako pevná látka ve spodní části věže, která se ochlazuje. Čistý proces je:
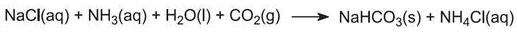
Suspenze pevného hydrogenuhličitanu sodného v roztoku chloridu amonného vytéká ze spodní části věže.
(4) Oddělení pevného hydrogenuhličitanu sodného
Suspenze se filtruje, aby se oddělil pevný hydrogenuhličitan sodný od roztoku chloridu amonného, který se pak použije ve fázi (7).
(5) Tvorba uhličitanu sodného
Hydrogenuhličitan sodný se zahřívá v rotačních pecích při teplotě 450 K, takže se rozkládá na uhličitan sodný, vodu a oxid uhličitý:
Oxid uhličitý se vrací do Solvayovy věže, kde se použije ve stupni (3). Produkt procesu, bezvodý uhličitan sodný, se získává jako jemný bílý prášek známý jako lehký uhličitan sodný.
(6) Tvorba hydroxidu vápenatého
Poslední dva stupně, (6) a (7), se týkají regenerace amoniaku z chloridu amonného (vyrobeného v kroku 3). Pálené vápno z kroku (2) se haší přebytečnou vodou za vzniku vápenného mléka:
(7) Regenerace amoniaku
Tato suspenze hydroxidu vápenatého se smísí s roztokem chloridu amonného, který zbyl z kroku (4), a zahřeje se:
Takto získaný amoniak se vrátí zpět do kroku (1). Chlorid vápenatý je jediným vedlejším produktem celého procesu.
Celkový proces je elegantní. Teoreticky jsou jedinými surovinami vápenec a solanka. Nevyhnutelně dochází ke ztrátám amoniaku, které se nahrazují přidáním dalších zásob, jak je požadováno v kroku (1).
(b) Z tronových a nahcolitových rud
Solvayův proces se v USA nepoužívá. Místo toho se v průmyslu používají dvě rudy a to představuje asi 30 % světové produkce. Jednou z nich je trona, která se v obrovském množství nachází ve Wyomingu. Trona má vzorec:
Ruda se těží v pevném stavu a zahříváním se z ní vypudí oxid uhličitý, čímž se získá uhličitan sodný:
Druhou rudou je nahcolit, což je hydrogenuhličitan sodný. Při zahřívání tvoří uhličitan sodný.