3 viz uhličitan. Pro poštovní obvod Spojeného království viz poštovní směrovací číslo oblasti CO.
Trioxid uhlíku (CO3) je nestabilní oxid uhlíku (oxouhlík). Mezi možné izomery oxidu uhelnatého patří izomery s bodovými skupinami molekulové symetrie Cs, D3h a C2v. Bylo prokázáno, že stav C2v, tvořený dioxiranem, je základním stavem molekuly. Trioxid uhlíku by se neměl zaměňovat se stabilním uhličitanovým iontem (CO32-).
 |
|
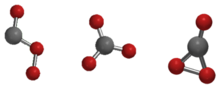
Stav Cs, D3h, a C2v izomery oxidu uhelnatého
|
|
| Název | |
|---|---|
| Název IUPAC
Dioxiran-3-one
|
|
| Identifikátory | |
|
3D model (JSmol)
|
|
|
PubChem CID
|
|
|
|
|
|
| Vlastnosti | |
| CO3 | |
| Molární hmotnost | 60.008 g-mol-1 |
|
Pokud není uvedeno jinak, jsou údaje uvedeny pro materiály ve standardním stavu (při 25 °C , 100 kPa).
|
|
| Infobox reference | |
Oxid uhelnatý může vznikat například v driftové zóně záporného korónového výboje reakcemi mezi oxidem uhličitým (CO2) a atomárním kyslíkem (O) vytvořeným z molekulárního kyslíku volnými elektrony v plazmatu. Další uváděnou metodou je fotolýza ozonu O3 rozpuštěného v kapalném CO2 nebo ve směsi CO2/SF6 při -45 °C ozářené světlem o vlnové délce 253,7 nm. Vznik CO3 je odvozen, ale zdá se, že se samovolně rozpadá cestou 2CO3 → 2CO2 + O2 s dobou života mnohem kratší než 1 minuta. Oxid uhelnatý může vznikat foukáním ozonu na suchý led (pevný CO2) a byl také zjištěn při reakcích mezi oxidem uhelnatým (CO) a molekulárním kyslíkem (O2). Spolu s izomerem C2v v základním stavu byl poprvé spektroskopicky detekován izomer D3h v elektrony ozářeném ledu oxidu uhličitého
.