- Introduktion
- Metoder
- Inklusion og eksklusion af patienter
- Standardprotokolgodkendelser og patientsamtykke
- Undersøgelsesprogram
- Statistik
- Resultater
- Frekvens af IDNA hos RLS-patienter
- Kliniske træk ved RLS-patienter med IDNA sammenlignet med NID
- Kliniske træk ved RLS-patienter med IDNA sammenlignet med IDA
- Hæmatologiske træk hos kontrolpersoner
- Diskussion
- Kliniske kendetegn ved IDNA i RLS
- Er IDNA et tidligt stadium forud for IDA i RLS?
- Accessing and Diagnosing IDNA in RLS
- Konklusion
- Datatilgængelighedserklæring
- Ethisk erklæring
- Author Contributions
- Funding
- Interessekonflikt
- Akkreditering
- Supplementary Material
- Abkortelser
Introduktion
Restless Legs Syndrome (RLS) er en almindelig neurologisk lidelse (1), og jernmangel spiller en vigtig rolle i dens patogenese (2, 3). Jernmangel er almindelig ved RLS, og jernmangelanæmi (IDA) er en velkendt årsag til sekundær RLS (4, 5), som er forbundet med en seksdobbelt stigning i risikoen for RLS i den almindelige befolkning (6). Jernmangel uden anæmi (IDNA, også ikke-anæmisk jernmangel) er normalt snigende og har for nylig tiltrukket sig opmærksomhed på grund af sin verdensomspændende forekomst og udfordring med hensyn til diagnose og håndtering (7). På trods af en klar sammenhæng mellem den kliniske betydning af RLS i IDA-populationen (6) er IDNA’s prævalens og karakteristika ved RLS ikke blevet systematisk undersøgt. Det er uvist, om IDNA udgør en undergruppe af RLS, og om IDNA er et tidligt stadium forud for IDA i RLS. I denne undersøgelse har vi til formål at undersøge de kliniske træk ved RLS med IDNA sammenlignet med dem uden jernmangel (NID, også ikke-jernmangel) og med IDA-patienter i en konsekutiv kohorte af kinesiske RLS-patienter.
Metoder
Inklusion og eksklusion af patienter
Vi rekrutterede løbende patienter fra vores RLS Specialist Clinic og Movement Disorders Clinic i Department of Neurology, Shanghai General Hospital, Shanghai Jiao Tong University School of Medicine mellem jan. 2017 og okt. 2018. RLS blev diagnosticeret i henhold til de diagnostiske kriterier for 2014 International Restless Legs Syndrome Study Group (RLSSG) diagnostiske kriterier (1). Patienter med andre neurologiske lidelser, dårlig samarbejdsvilje eller kognitiv svækkelse blev udelukket fra undersøgelsen. Alders- og kønsmatchede sunde kontroller uden anæmi blev rekrutteret i samme periode i sundhedsundersøgelsescentret på vores hospital. Kontrolpersoner var fri for neurologisk sygdom, herunder RLS, ved face-to-face interview.
Standardprotokolgodkendelser og patientsamtykke
Studiet blev godkendt af Shanghai General Hospital Institutional Review Board, og alle patienter og sunde kontroller inkluderet i undersøgelsen gav skriftligt samtykke.
Undersøgelsesprogram
RLS-patienter blev evalueret som vi tidligere har beskrevet (8). Kort fortalt interviewede vi patienterne ansigt til ansigt i vores ambulatorium. Patienter, der blev betragtet som positive for RLS, blev diagnosticeret af to neurologer med speciale i RLS. Vi registrerede demografiske oplysninger, historie, symptomer, medicinering, generelle neurologiske og medicinske undersøgelser og MMSE for alle rekrutterede patienter. Et semistruktureret spørgeskema blev yderligere vurderet, som omfattede alder for RLS-debut, RLS-familiehistorie (kendskab defineret som “førstegradsslægtninge”), type og topografi af fornemmelser, og om RLS-symptomer korrelerede med årstidsvariationer. RLS-sværhedsgraden i en uge forud for interviewet blev vurderet ved hjælp af den internationale RLS-skala (IRLSRS) (9). Undersøgelser som f.eks. vaskulær ultralyd, nerveledningshastighed, elektromyografi osv. blev udført, hvis det var klinisk indiceret for at udelukke mulige RLS-mimikere som f.eks. perifere polyneuropatier, venøs stase, vaskulær claudicatio, reumatoid arthritis osv. Forsøgspersoner med medicinering af neuroleptika eller anden medicinering, som forfatterne anså for at være muligvis relateret til RLS i de foregående tre måneder, blev også udelukket. Vi udelukkede dem med bemærkelsesværdige komorbiditeter, der var forbundet med sekundær RLS som kronisk nyresvigt, graviditet, Parkinsons sygdom, perifer neuropati, slagtilfælde og ataksi. Blodprøver for hæmoglobin og perifer jernstatus, herunder serumferritin, jern, transferrin og total jernbindingskapacitet (TIBC), blev vurderet. Transferrinmætningen (TSAT) blev beregnet som serumjern/TIBC × 100. Normalt hæmoglobinniveau blev defineret som kvinder ≥ 113 g/L og mænd ≥ 131 g/L i henhold til den normale værdi på vores hospital. IDNA er defineret som serumferritin <75 μg/L (eller ferritin ≥ 75 μg/L men TSAT <20 %) med normalt hæmoglobinniveau (10, 11). IDA diagnosticeres, når hæmoglobin <113 g/L (kvinder) eller <131 g/L (mænd) samt serumferritin <75 μg/L (eller serumferritin ≥ 75 μg/L, men TSAT <20%).
Statistik
Data blev analyseret ved hjælp af SPSS 21.0 for Windows (IBM Co., USA). Alle data er præsenteret som gennemsnit ± standardafvigelser. Da de fleste variabler ikke var normalfordelte, blev Kruskal-Wallis-testen anvendt til sammenligninger af enkeltvariabler mellem tre grupper, og post-hoc Mann-Whitney-test, når P < 0,05. Forskelle i proportioner blev analyseret ved hjælp af Pearsons chi-kvadrat- eller Fisher’s eksakte test, når det var relevant. P < 0,05 blev betragtet som signifikant. I betragtning af de potentielle virkninger af lægemiddelbehandling på RLS-symptom og andre funktioner beregnede vi alle data to gange i henholdsvis de samlede RLS-patienter og i RLS-patienter uden medicinering.
Resultater
Vi indskrev kontinuerligt i alt 196 primære RLS-patienter uden anæmi (IDNA RLS og NID RLS) i denne undersøgelse, herunder 66 mandlige patienter (33,7%) og 130 kvindelige patienter (66,3%). Gennemsnitsalderen var 53,0 ± 13,5 år gammel. 65,8 % (129/196) af RLS-patienterne tog ikke medicin mod RLS (109 var medicin-naive, og 20 var medicinfri i mere end 2 uger ved interviewet). Vi inkluderede også 26 RLS-patienter med IDA (22 medicin-naivt). Vi udelukkede fem anæmiske RLS-patienter (Hb <113 g/L for kvinder og Hb <131 g/L for mænd), som ikke havde tegn på jernmangel (serumferritin ≥ 75 μg/L samt TIBC ≥ 20 %, gennemsnitligt serumferritin som 236,1 ± 119,3 μg/L). Ingen af RLS-patienterne med IDA havde tegn på infektion, og årsagerne til IDA RLS blev opført (tabel 1). Derudover indsamlede vi 63 sunde kontrolpersoner, herunder 22 mandlige personer (34,9 %) og 41 kvindelige personer (65,1 %), og gennemsnitsalderen i kontrolgruppen var 51,0 ± 12,0 år (gennemsnitsalderen var 51,0 ± 10,4 og 51,0 ± 12,8 for henholdsvis mænd og kvinder). Der var ingen signifikante forskelle i både køn (RLS vs. kontrol: 66,3 vs. 65,1 % for kvinder, P > 0,05) og alder (RLS vs. kontrol: 53,0 ± 13,5 vs. 51,0 ± 12,0, P > 0,05) mellem RLS-patienter og kontrolpersoner. Detaljerede demografiske oplysninger om patienter med RLS i hver gruppe er vist (tabel 2).
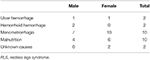
Tabel 1. Mulige årsager til jernmangel hos anæmiske RLS-patienter.
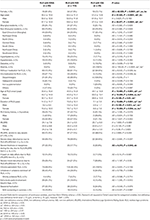
Tabel 2. Demografiske oplysninger og kliniske karakteristika for RLS-patienter med IDNA, NID og IDA.
Frekvens af IDNA hos RLS-patienter
Af de 196 RLS-patienter (130 kvinder, 66 mænd) uden anæmi eller andre komorbiditeter havde 83 (42,3 %) jernmangel. Prævalensen af IDNA hos kvinder (58,5 %, 76/130) er meget højere end hos mænd (10,6 %, 7/66) i denne kohorte af RLS-patienter uden anæmi (tabel 2), med en relativ risiko på 5,51 (95 % konfidensinterval 2,70-11,27, p < 0,0001).
Kliniske træk ved RLS-patienter med IDNA sammenlignet med NID
I kvindelige RLS-patienter uden anæmi havde IDNA-gruppen en yngre alder både ved interview og ved RLS-debut sammenlignet med NID-gruppen (P < 0,01; Tabel 2). Selv om der ikke var nogen forskel på sværhedsgraden af RLS ved IRLSRS, fandt vi flere patienter med svær/meget svær træthed eller søvnighed i løbet af dagen i IDNA-gruppen sammenlignet med NID-gruppen (32,5 vs. 17,7 %, P < 0,05; Tabel 2). Der var ingen forskel med hensyn til familiehistorie, sværhedsgrad, lateralitet, placering og sæsonudsving af RLS mellem IDNA- og NID-gruppen, hverken hos mænd eller kvinder. IDNA RLS-gruppen præsenterede lavere serumferritin (mænd og kvinder, P < 0,0001) samt højere transferrin- og TIBC-værdier (kvinder, P < 0,0001) sammenlignet med NID RLS-gruppen (Figur 1, Tabel 3).
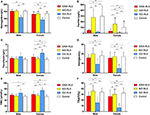
Figur 1. De hæmatologiske og jernparametre efter gruppe og køn (A) Hæmoglobin. (B) Ferritin. (C) Transferrin. (D) Jern. (E) TIBC. (F) TSAT. **P < 0,01, *P < 0,05, Kruskal-Wallis-test og post-hoc Mann-Whitney-test. Data sammenlignet mellem IDNA RLS (n = 83), NID RLS (n = 113), IDA RLS (n = 26) og kontroller (n = 63). ##P < 0,01, #P < 0,05, Mann-Whitney U-test. Data sammenlignet mellem mænd og kvinder i hver gruppe af IDNA RLS, NID RLS, IDA RLS og kontroller. Jernmangel blev defineret som ferritinniveau <75 μg/L, eller ferritin 75 μg/L, men TSAT <20 %. IDA, jernmangelanæmi; IDNA, jernmangel uden anæmi; NID, ikke-jernmangel; RLS, restless legs syndrome; TIBC, total jernbindingskapacitet; TSAT, transferrinmætning.
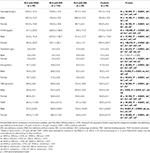
Tabel 3. Hæmatologiske data for RLS-patienter med IDNA, NID, IDA og kontrolpersoner.
Efter udelukkelse af RLS-patienter, der fik medicin mod RLS, viste IDNA RLS-gruppen stadig en højere andel af svær/meget svær træthed/søvnighed om dagen sammenlignet med NID RLS-gruppen, dog ikke et signifikant niveau (35 vs. 18,8 %, P = 0,078). Andre træk mellem IDNA RLS og NID RLS var ens (Supplerende tabel 1).
Kliniske træk ved RLS-patienter med IDNA sammenlignet med IDA
IDA-gruppen havde mere alvorligt forstyrrede serumjernmetaboliske parametre end IDNA-gruppen, herunder lavere ferritin (mand, P < 0.05; kvinde, P < 0,0001), højere transferrin (kvinde, P < 0,0001), lavere jern (mand, P < 0,05; kvinde, P < 0,0001), højere TIBC (kvinde, P < 0,0001) og lavere TSAT-værdier (mand, P < 0,05; kvinde, P < 0,0001) i serum (Figur 1, Tabel 3). IDNA RLS havde længere sygdomsvarighed (P < 0,01 hos mænd, P < 0,05 hos kvinder) og yngre alder ved debut (kun signifikant hos mænd med P < 0,05) end IDA RLS. Der var ingen forskelle med hensyn til positiv familiehistorie, sværhedsgrad (IRLSRS), lateralitet, lokalisering og sæsonbestemt fluktuation af RLS mellem IDNA RLS og IDA RLS, hverken hos mænd eller kvindelige RLS-patienter (tabel 2). Resultaterne var ens efter udelukkelse af RLS-patienter med medicinering for RLS (Supplerende tabel 1).
Hæmatologiske træk hos kontrolpersoner
Diagnostiske kriterier for jernmangel er forskellige mellem den generelle befolkning og RLS-patienter (som diskussion nedenfor). I henhold til vores hospitals grænseværdi for jernmangel i den almindelige befolkning (20 μg/L) fandt vi, at ingen af de mandlige forsøgspersoner i kontrolgruppen havde jernmangel, mens fire kvindelige kontrolpersoner viste jernmangel (to forsøgspersoner med serumferritin <20 μg/L og to forsøgspersoner med ferritin ≥ 20 μg/L, men TSAT <20%). Der var ingen signifikant forskel i prævalensen af jernmangel hos kontrolpersoner mellem mænd (0 %, 0/22) og kvinder (9,8 %, 4/41; P = 0,288). De hæmatologiske tests på hæmoglobin- og jernparametre i kontrolgruppen var mest ens med NID RLS-gruppen sammenlignet med IDNA- eller IDA-gruppen (Figur 1, Tabel 3).
Diskussion
Patofysiologien ved primær og sekundær RLS er ufuldstændigt forstået. Jernmangel i hjernen har en grundlæggende rolle i RLS-patogenese, og tilstande, der er karakteriseret ved systemisk jernmangel, såsom anæmi og graviditet, er forbundet med en højere prævalens af RLS-symptomer (2, 3, 5, 6). IDA er en anerkendt komorbiditet, der er forbundet med sekundær RLS (4-6, 12). IDNA er mere snigende, og dens kendetegn er mindre kendt hos RLS-patienter.
Kliniske kendetegn ved IDNA i RLS
Generelt er kvinder mere modtagelige for RLS (1, 13, 14). Kvinder i den fødedygtige alder er også mere jernmanglende end mænd i den generelle befolkning (15). I denne undersøgelse af RLS-patienter uden anæmi fandt vi også en betydelig kønsafhængig forskelsbehandling. Kvindelige RLS-patienter har en meget højere risiko for IDNA end mandlige RLS-patienter (relativ risiko på 5,51, p < 0,0001). Færre mandlige RLS-patienter led af jernmangel, enten med eller uden anæmi. Hos kontrollerne fandt vi, selv om det ikke var statistisk signifikant, at 9,8 % af de kvindelige forsøgspersoner led af jernmangel, mens ingen af de mandlige forsøgspersoner gjorde det. Jernmangel er ualmindeligt hos det mandlige køn, så hvis mandlige RLS-patienter har jernmangel, bør der foretages yderligere undersøgelser for at vurdere sekundære årsager såsom kroniske blødninger og underernæring på grund af gastrointestinale lidelser.
Ved sammenligning med den “normale” NID RLS gruppe viste IDNA RLS gruppen en tidligere RLS debutalder og en yngre alder ved interviewet hos kvinder, men ikke hos mænd (Tabel 2). I en tidligere undersøgelse fandt vi, at tidligt indsættende RLS viste en mere positiv RLS-familiehistorie og mere alvorligt forstyrrede perifere jernparametre (lavere serumferritin og højere serumtransferrin- og TIBC-værdier) sammenlignet med sent indsættende RLS (8). For nylig fandt vi, at IDNA i RLS forudsiger nogle genetiske faktorer sammenlignet med NID i RLS (upublicerede data). En potentiel subtype i forbindelse med genetisk baggrund, jernmangel og tidligt indsættende RLS fortjener yderligere undersøgelse. Træthed, svaghed, koncentrationsbesvær, nedsat hukommelse samt dårlig arbejdspræstation er uspecifikke symptomer, som ofte er forbundet med jernmangel (7, 16). Allen et al. (6) har tidligere rapporteret, at IDA-patienter med RLS viste mere træthed, dårligere søvnkvalitet og nedsat energi om dagen sammenlignet med IDA-patienter uden RLS. Vi fandt, at RLS-patienter med IDNA også var mere tilbøjelige til at lide af manifestationer af alvorlig/meget alvorlig træthed eller søvnighed i løbet af dagen på grund af RLS sammenlignet med RLS-patienter med NID (skæringspunkt ved 75 μg/L, 32,5 vs. 17,7 %, P < 0,05, Tabel 2). Når man igen analyserede kun i RLS-patienter uden medicinering, viste IDNA RLS-patienterne stadig en tendens til at være mere modtagelige for svær/meget svær træthed eller søvnighed om dagen, selv om de ikke nåede en statistisk signifikans (35 vs. 18,8 %, P = 0,078, Supplerende tabel 1). Der blev ikke fundet nogen forskel på svær/meget svær træthed eller søvnighed om dagen mellem IDNA RLS og IDA RLS i denne undersøgelse (tabel 2). Udtømt jernlager, langs et kontinuum fra IDA til IDNA, er forbundet med nedsat aktivitet af jernafhængige enzymer, nedsat cellulær oxidativ kapacitet samt nedsat energieffektivitet (17-19). Da vi anvendte en strengere definition for IDNA (serumferritin cut-off værdi sat til 50 μg/L), fandt vi stadig, at flere IDNA RLS-patienter med IDNA led af svær/meget svær træthed eller søvnighed i løbet af dagen sammenlignet med NID RLS-patienter (32,3 vs. 19,8 %), men dette var dog ikke signifikant (P > 0,05; Supplerende tabel 2). Periodisk benbevægelse i søvn (PLMS) er tæt forbundet med RLS, og locus inden for BTBD9-genet er korreleret med risiko for både PLMS og RLS (20, 21). Det skal bemærkes, at vi kun evaluerede søvnkvaliteten ved hjælp af IRLSRS underpunkt 4, og vi foretog ikke en detaljeret vurdering af søvnstatus ved hjælp af polysomnografi (PSG)-måling. Derfor var data om PLMS og andre søvnrelaterede parametre ikke tilgængelige, hvilket kan bidrage væsentligt til træthed eller søvnighed om dagen. Derfor skal sammenhængen mellem dagtræthed/søvnighed og IDNA undersøges nærmere. Vi fandt ikke nogen signifikant forskel i sværhedsgrad af RLS mellem IDNA- og NID-gruppen. Perifer jernmangel vil øge risikoen for RLS prævalens i tidligere kliniske undersøgelser (6). Reducerede serumjernkoncentrationer nedsætter globalt set hjernens jernniveauer, og jernbehandling gavner RLS-patienter med lave niveauer af perifert jern (10). Ikke desto mindre viser talrige RLS-patienter uden systemisk jernmangel stadig et hjernespecifikt underskud af jern i hjernen (22). Undersøgelser i gnavere rapporterede, at serumjernstatus ikke var korreleret med regionale jernniveauer i hjernen, og kan derfor være begrænset relateret til træk ved RLS (23, 24).
Er IDNA et tidligt stadium forud for IDA i RLS?
Jernmangel kan klassificeres i to niveauer, IDNA og IDA, i henhold til hæmoglobinmålingens værdi. I denne undersøgelse havde RLS-patienter med IDA de laveste hæmoglobin-, ferritin- og jernniveauer samt de højeste transferrin- og TIBC-værdier sammenlignet med IDNA RLS og NID RLS (Figur 1, Tabel 3). Selv om der ikke var nogen signifikante forskelle på hæmoglobinniveauerne mellem IDNA RLS og NID RLS (både hos mandlige og kvindelige RLS-patienter), var serumhæmoglobin hos IDNA RLS-patienter lavere sammenlignet med kontroller (kun hos kvinder, P < 0,05, Figur 1, Tabel 3). Desuden lå værdierne for jernparametre i IDNA RLS-gruppen mellem værdierne for NID RLS eller kontrolgruppen og IDA RLS-gruppen (Figur 1, Tabel 3). Disse resultater er i overensstemmelse med synspunktet om, at IDNA er en mildere jernmangel forud for udviklingen af anæmi. Det skal bemærkes, at serumjernparametre anses for at afspejle den perifere jernstatus hovedsageligt i erythronerne (25), mens jernlagring i andre organer (såsom lever, hjerne osv.) skal valideres hos IDNA-emner.
Nu er årsager og træk ved IDNA RLS og IDA RLS ikke desto mindre ikke helt ens. I denne undersøgelse havde de fleste RLS-patienter med IDA bemærkelsesværdige comorbiditeter forbundet med underernæring eller kronisk overdrevent blodtab, herunder tarmblødning, hæmorrhoideblødning og menorrhagi (Tabel 1), hvilket er i overensstemmelse med den tidligere undersøgelse (12). Det er værd at bemærke, at menorrhagi er en almindelig årsag til IDA hos kvinder i den reproduktive alder, som kan være en følge af uterusfibromer, adenomyose og andre gynækologiske lidelser. Underernæring kan være sekundær til gastrointestinale forstyrrelser, vegetarisk kost og misforståelser vedrørende selvbillede af kroppen hos unge kvinder. Således er jernmangel hos størstedelen af IDA RLS-patienterne i denne undersøgelse “absolut jernmangel”. I modsætning hertil mangler RLS-patienter med IDNA normalt bemærkelsesværdige komorbiditeter. Årsagerne til IDNA RLS er snigende, og IDNA i RLS hører generelt til omfanget af primær RLS (4) i forbindelse med “funktionel jernmangel”. Vi kan dog ikke udelukke snigende sekundære årsager hos IDNA RLS-patienter, som kan føre til utilstrækkelig jernforsyning i kroppen.
Sammenlignet med RLS med IDNA havde patienter med IDA en ældre alder for RLS-debut samt kortere varighed af RLS hos både mænd og kvinder (mere signifikant hos mænd; Tabel 2), hvilket var i overensstemmelse med det synspunkt, at sekundær RLS normalt har en ældre debutalder (26). Ifølge vores erfaring viser disse IDA RLS-patienter med bemærkelsesværdige årsager (såsom akut blodtab) normalt kortere sygdomsvarighed og hurtigere helbredelse eller lindring, når behandlelige comorbide lidelser korrigeres og jernstatus genoprettes. De har normalt ikke brug for langvarig RLS-terapi, hvilket er noget anderledes end primære RLS-patienter. Fremtidige longitudinelle undersøgelser er nødvendige for at bekræfte behandlingseffekterne af jerntilskud hos RLS-patienter med IDA. Andre undersøgelser af komorbide RLS i forbindelse med graviditet (27) og uræmi (28) rapporterede om forbedring efter fødsel og nyretransplantation, hvilket tyder på, at ændringer i tilknyttede metaboliske faktorer kan udløse RLS hos modtagelige personer (5).
Der er derfor heterogenitet i både IDA RLS og IDNA RLS. Selv om IDNA generelt betragtes som et tidligt stadium forud for anæmi (7), er IDNA RLS muligvis ikke blot et prodromalstadie forud for IDA RLS.
Accessing and Diagnosing IDNA in RLS
Og selv om knoglemarvsbiopsi anses for at være den bedste indikator for jernstatus, udføres den sjældent på grund af potentielle risici for infektion eller blødning på biopsi-stedet (29). De mest anvendte laboratorieindikatorer for jernstatus er ferritin, som enten afspejler vævets jernlagre eller tilstrækkeligheden af det jern, der er let tilgængeligt for erytropoiese (30). Selv om serumferritin er en følsom markør til vurdering af kroppens samlede jernlager, kan andre forhold som f.eks. inflammatorisk status, alder og nyrefunktion være forstyrrende faktorer, der øger serumferritinniveauet (31). Ferritin og transferrin er også akutfasereaktanter, og ferritinniveauet kan være forhøjet og transferrinniveauet nedsat under en inflammatorisk tilstand (32). Derfor kan selv serumferritin ≥ 75 μg/L og TSAT <20 % stadig have egentlig jernmangel (11, 33).
En serumferritinkoncentrationsgrænseværdi på <30 μg/L er mest følsom og specifik til at identificere potentiel jernmangel i den generelle befolkning (17, 18), og IDNA klassificeres som havende normale hæmoglobinniveauer med nedsat serumferritinniveau (<20 μg/L) (34, 35). Kliniske laboratorier fastsætter normalt den nedre grænse for referenceområdet for serumferritin til 10-20 μg/L i den almindelige befolkning (36) (den nedre grænse er fastsat til 20 μg/L på vores hospital). Betydeligt højere tærskelværdier for serumferritin anvendes normalt til at definere jernmangel ved kroniske lidelser som f.eks. hjertesvigt og kronisk nyresygdom (7, 17). Vurderingskriterierne til at definere jernmangel i RLS er også forskellige fra dem hos raske kontroller, selv om der endnu ikke er opnået konsensus om den nøjagtige grænseværdi for ferritin til at indikere IDNA i RLS. Nyere undersøgelser tyder på, at RLS-patienter bør betragtes som jernmangel, når deres ferritinkoncentration er under 75 μg/L (10, 11, 27). Tidligere undersøgelser har dog for det meste bestemt ferritinkoncentrationen under 50 μg/L som “lav jernstatus” i RLS (37, 38). Da der ikke foreligger data om beskrivelser af forskellige cut-off point, sammenlignede vi træk ved IDNA RLS og NID RLS ved at bruge både 75 og 50 μg/L som cut-off værdier af ferritin for jernmangel. Vi fandt, at ved anvendelse af 50 μg/L som den nedre grænseværdi for ferritin, opfylder 33,2 % (65/196) af RLS-patienterne kriterierne for IDNA. Resultaterne var ret ens for de to anvendte tærskelværdier, bortset fra at øget svær/meget svær træthed eller søvnighed i løbet af dagen i IDNA RLS sammenlignet med NID RLS ikke var signifikant, når grænseværdien for ferritin blev fastsat til 50 μg/L (Tabel 2, Supplerende tabel 2).
Vores undersøgelse havde nogle begrænsninger: For det første var dette en tværsnitsundersøgelse, og manglen på longitudinelle data gjorde det svært at identificere udviklingen af RLS-symptomer og virkninger af behandling. Desuden kan der være en tilbagekaldelsesbias. For det andet var dette en enkelt centerundersøgelse, da omkring en fjerdedel af patienterne var lokale indbyggere i Shanghai, og størstedelen af patienterne kom fra Østkina. I betragtning af det store område i Kina og mulige forskellige miljøfaktorer kan der være en udvælgelsesbias. For det tredje foretog vi ikke PSG-måling for at evaluere detaljeret søvnstatus hos RLS-patienter og kontroller. For det fjerde var omkring en tredjedel af RLS-patienterne i denne undersøgelse i behandling med dopaminergika og/eller gabapentin enacarbil (kun én patient modtog jerntilskudsterapi), hvilket kan påvirke de kliniske træk. Vi beregnede imidlertid alle data igen hos RLS-patienter uden medicinering og drog den samme konklusion. Når det er sagt, har vores undersøgelse dog nogle fordele. Vi undersøgte i detaljer det kliniske spektrum af RLS og udelukkede andre komorbiditeter eller RLS-mimikere. Vi interviewede hver enkelt patient ansigt til ansigt, og vi udelukkede omhyggeligt de atypiske RLS-patienter under opfølgningen. Der har været begrænsede undersøgelser af IDNA’s karakteristika ved RLS, vi udforskede detaljerede kliniske karakteristika ved IDNA hos konsekutive kinesiske RLS-patienter.
Konklusion
IDNA er hyppig hos patienter med RLS, især hos kvinder, og har nogle særlige kliniske karakteristika. IDNA havde yngre alder både ved interview og ved RLS-debut sammenlignet med NID hos kvindelige RLS-patienter. IDNA er ikke særlig almindelig hos mandlige RLS-patienter, og mænd med jernmangel bør evalueres for komorbide lidelser. Karakteristika hos RLS-patienter med IDNA er forskellige fra RLS med IDA. RLS med IDNA udgør et vigtigt og overset folkesundhedsproblem, som fortjener mere klinisk opmærksomhed og bør indgå i behandlingsstrategien. Regelmæssig screening af perifere jernparametre selv hos patienter med normal blodtælling anbefales for rettidig passende behandling.
Datatilgængelighedserklæring
Datasættene genereret til denne undersøgelse er tilgængelige på anmodning til den tilsvarende forfatter.
Ethisk erklæring
Studierne, der involverer menneskelige deltagere, blev gennemgået og godkendt af Shanghai General Hospital Institutional Review Board. Patienterne/deltagerne gav deres skriftlige informerede samtykke til at deltage i denne undersøgelse.
Author Contributions
X-YZ konception/design/gennemførelse af projektet/udarbejdelse af manuskriptet. T-TW: udførelse af projektet/indsamling og fortolkning af data/udarbejdelse af manuskriptet. H-MW og JS: laboratoriemåling. XL, L-YN, T-JC og M-YQ: gennemførelse af projektet/indsamling og fortolkning af data. TL og WO: kritisk revision af manuskriptet med henblik på vigtigt intellektuelt indhold. Y-CW: udformning/design/overvågning af projektet, kritisk revision af manuskriptet for vigtigt intellektuelt indhold. Alle forfattere: udarbejdelse af manuskriptet.
Funding
Dette arbejde blev sponsoreret af Shanghai Municipal Planning Commission of Science and Research Fund (201740017), Clinical Research Innovation Plan of Shanghai General Hospital (CTCCR-2018C02), Interdisciplinary Program of Shanghai Jiao Tong University (YG2015QN21), og National Natural Science Foundation of China (No. 81671251).
Interessekonflikt
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Vi takker alle patienter og raske kontrolpersoner, der deltog i denne undersøgelse. Vi takker personalet i Physical Examination Center i Shanghai General Hospital. Vi takker også Department of Bioinformatics and Biostatistics, School of Life Sciences and Biotechnology, Shanghai Jiao Tong University, Yue Zhang for statistisk konsultation.
Supplementary Material
Det supplerende materiale til denne artikel kan findes online på: https://www.frontiersin.org/articles/10.3389/fneur.2020.00298/full#supplementary-material
Abkortelser
CI, konfidensinterval; IRLSSG, International Restless Legs Study Group; MMSE, Mini-Mental State Examination; NID, uden jernmangel; RLS, restless legs syndrome; IDA, jernmangelanæmi; IDNA, jernmangel uden anæmi; IRLSRS, International Restless Legs Syndrome Rating Scale; TIBC, total jernbindingskapacitet; TSAT, transferrinmætningsgrad.
1. Allen RP, Picchietti DL, Garcia-Borreguero D, Ondo WG, Walters AS, Winkelman JW, et al. Restless legs syndrome/Willis-Ekbom disease diagnostic criteria: updated International Restless Legs Syndrome Study Group (RLSSG) consensus criteria-history, rationale, description, and significance. Sleep Med. (2014) 15:860-73. doi: 10.1016/j.sleep.2014.03.025
CrossRef Full Text | Google Scholar
2. Connor JR, Boyer PJ, Menzies SL, Dellinger B, Allen RP, Ondo WG, et al. Neuropatologisk undersøgelse tyder på nedsat jernoptagelse i hjernen ved restless legs syndrom. Neurologi. (2003) 61:304-9. doi: 10.1212/01.WNL.0000078887.16593.12
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Allen RP, Earley CJ. Jernets rolle i forbindelse med restless legs syndrom. Mov disord. (2007) 18(22 Suppl):S440-8. doi: 10.1002/mds.21607
CrossRef Full Text | Google Scholar
4. Trenkwalder C, Allen R, Hogl B, Clemens S, Patton S, Schormair B, et al. Comorbiditeter, behandling og patofysiologi i forbindelse med restless legs syndrom. Lancet Neurol. (2018) 17:994-1005. doi: 10.1016/S1474-4422(18)30311-9
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Trenkwalder C, Allen R, Hogl B, Paulus W, Winkelmann J. Restless legs syndrome associeret med større sygdomme: en systematisk gennemgang og et nyt koncept. Neurology. (2016) 86:1336-43. doi: 10.1212/WNL.00000000000000002542
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Allen RP, Auerbach S, Bahrain H, Auerbach M, Earley CJ. Prævalensen og virkningen af restless legs syndrom hos patienter med jernmangelanæmi. Am J Hematol. (2013) 88:261-4. doi: 10.1002/ajh.23397
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Soppi ET. Jernmangel uden anæmi – en klinisk udfordring. Clin Case Rep. (2018) 6:1082-6. doi: 10.1002/ccr3.1529
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Zhu XY, Wu TT, Wang HM, Ni LY, Li X, Liu Y, et al. Kliniske træk og undertyper af restless legs syndrome i den kinesiske befolkning: en undersøgelse af 359 patienter. Sleep Med. (2019) 59:15-23. doi: 10.1016/j.sleep.2019.01.053
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP, et al. International Restless Legs Syndrome Study, Validation of the International Restless Legs Syndrome Study Group rating scale for restless legs syndrome. Sleep Med. (2003) 4:121-32. doi: 10.1016/S1389-9457(02)00258-7
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. International Restless Legs Syndrome Study, Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report. Sleep Med. (2018) 41:27-44. doi: 10.1016/j.sleep.2017.11.1126
CrossRef Full Text | Google Scholar
11. Trenkwalder C, Winkelmann J, Oertel W, Virgin G, Roubert B, Mezzacasa A, et al. Ferric carboxymaltose in patients with restless legs syndrome and nonanemic iron deficiency: a randomized trial. Mov Disord. (2017) 32:1478-82. doi: 10.1002/mds.27040
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Mehmood T, Auerbach M, Earley CJ, Allen RP. Respons på intravenøst jern hos patienter med jernmangelanæmi (IDA) og restless leg syndrome (Willis-Ekbom sygdom). Sleep Med. (2014) 15:1473-6. doi: 10.1016/j.sleep.2014.08.012
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Thomas K, Watson CB. Restless legs syndrom hos kvinder: en gennemgang. J Womens Health. (2008) 17:859-68. doi: 10.1089/jwh.2007.0515
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Ohayon MM, O’Hara R, Vitiello MV. Epidemiologi af restless legs syndrom: en sammenfatning af litteraturen. Sleep Med Rev. (2012) 16:283-95. doi: 10.1016/j.smrv.2011.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Umbreit J. Jernmangel: en kortfattet gennemgang. Am J Hematol. (2005) 78:225-31. doi: 10.1002/ajh.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Sawada T, Konomi A, Yokoi K. Jernmangel uden anæmi er forbundet med vrede og træthed hos unge japanske kvinder. Biol Trace Elem Res. (2014) 159:22-31. doi: 10.1007/s12011-014-9963-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Camaschella C. Jernmangelanæmi. N Engl J Med. (2015) 372:1832-43. doi: 10.1056/NEJMra1401038
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Jernmangelanæmi. Lancet. (2016) 387:907-16. doi: 10.1016/S0140-6736(15)60865-0
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Haas JD, Brownlie T. Jernmangel nedsat arbejdskapacitet: en kritisk gennemgang af forskningen for at fastslå en årsagssammenhæng. J Nutr. (2001) 131:676S-88S; diskussion 688S-90S. doi: 10.1093/jn/131.2.676S
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Stefansson H, Rye DB, Hicks A, Petursson H, Ingason A, Thorgeirsson TE, et al. En genetisk risikofaktor for periodiske lembevægelser i søvne. N Engl J Med. (2007) 357:639-47. doi: 10.1056/NEJMoa072743
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Li G, Tang H, Wang C, Qi X, Chen J, Chen S, et al. Forbindelse af BTBD9 og MAP2K5/SKOR1 med restless legs syndrome i den kinesiske befolkning. Sleep. (2017) 40:zsx028. doi: 10.1093/sleep/zsx028
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Earley CJ, Connor J, Garcia-Borreguero D, Jenner P, Winkelman J, Zee PC, et al. Ændret jernhomeostase i hjernen og dopaminerge funktioner i Restless Legs Syndrome (Willis-Ekbom-syndrom). Sleep Med. (2014) 15:1288-301. doi: 10.1016/j.sleep.2014.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Erikson KM, Pinero DJ, Connor JR, Beard JL. Regionale jern-, ferritin- og transferrinkoncentrationer i hjernen under jernmangel og jerntilførsel hos rotter under udvikling. J Nutr. (1997) 127:2030-8. doi: 10.1093/jn/127.10.2030
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Yin L, Unger EL, Jellen LC, Earley CJ, Allen RP, Tomaszewicz A, et al. Systemgenetisk analyse af multivariate respons på jernmangel hos mus. Am J Physiol Regul Integr Comp Physiol. (2012) 302:R1282-96. doi: 10.1152/ajpregu.00634.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hallberg L, Hulthen L. Perspektiver på jernoptagelse. Blood Cells Mol Dis. (2002) 29:562-73. doi: 10.1006/bcmd.2002.0603
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Shukla G, Gupta A, Pandey RM, Kalaivani M, Goyal V, Srivastava A, et al. Hvilke træk adskiller unilateralt fra bilateralt restless legs syndrom? En sammenlignende observationsundersøgelse af 195 patienter. Sleep Med. (2014) 15:714-9. doi: 10.1016/j.sleep.2014.01.025
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Picchietti DL, Hensley JG, Bainbridge JL, Lee KA, Manconi M, McGregor JA, et al. International Restless Legs Syndrome Study, Consensus clinical practice guidelines for the diagnosis and treatment of restless legs syndrome/Willis-Ekbom disease during pregnancy and lactation. Sleep Med Rev. (2015) 22:64-77. doi: 10.1016/j.smrv.2014.10.009
CrossRef Full Text | Google Scholar
28. Winkelmann J, Stautner A, Samtleben W, Trenkwalder C. Langtidsforløb af restless legs syndrome hos dialysepatienter efter nyretransplantation. Mov Disord. (2002) 17:1072-6. doi: 10.1002/mds.10231
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Bain BJ. Morbiditet ved knoglemarvsbiopsi: gennemgang af 2003. J Clin Pathol. (2005) 58:406-8. doi: 10.1136/jcp.2004.022178
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Baynes RD. Vurdering af jernstatus. Clin Biochem. (1996) 29:209-15. doi: 10.1016/0009-9120(96)00010-K
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Wish JB. Vurdering af jernstatus: ud over serumferritin og transferrinmætning. Clin J Am Soc Nephrol. (2006) 1(1 Suppl):S4-8. doi: 10.2215/CJN.01490506
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Tietz NW, Rinker AD, Morrison SR. Hvornår er et serumjern virkelig et serumjern? Status for målinger af serumjern. Clin Chem. (1994) 40:546-1. doi: 10.1093/clinchem/40.4.546
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Mackie S, Winkelman JW. Normalt ferritin hos en patient med jernmangel og RLS. J Clin Sleep Med. (2013) 9:511-3. doi: 10.5664/jcsm.2680
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Sammenligning af to doser af elementært jern til behandling af latent jernmangel: effektivitet, bivirkninger og blindingsevne. Nutrients. (2014) 6:1394-405. doi: 10.3390/nu6041394
PubMed Abstract | CrossRef Full Text | Google Scholar
35. D’Adamo CR, Novick JS, Feinberg TM, Dawson VJ, Miller LE. Et fødevarebaseret kosttilskud med en lav dosis jern forbedrede markører for jernstatus blandt ikke-anæmiske jernmangelramte kvinder. J Am Coll Nutr. (2018) 37:342-9. doi: 10.1080/07315724.2018.1427158
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Goodnough LT, Nemeth E, Ganz T. Detection, evaluation, and management of iron-restricted erythropoiesis. Blood. (2010) 116:4754-61. doi: 10.1182/blood-2010-05-286260
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Lee CS, Lee SD, Kang SH, Park HY, Yoon IY. Sammenligning af effektiviteten af oralt jern og pramipexol til behandling af patienter med restless legs syndrom med lavt serumferritin. Eur J Neurol. (2014) 21:260-6. doi: 10.1111/ene.12286
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Tilma J, Tilma K, Norregaard O, Ostergaard JR. Restless legs syndrome i den tidlige barndom: symptomer og effekt af oral jernbehandling. Acta Paediatr. (2013) 102:e221-6. doi: 10.1111/apa.12173
PubMed Abstract | CrossRef Full Text | Google Scholar