- Introducere
- Metode
- Includerea și excluderea pacienților
- Aprobări standard ale protocolului și consimțământul pacienților
- Program de examinare
- Statistică
- Rezultate
- Frecvența IDNA la pacienții cu RLS
- Caracteristicile clinice ale pacienților cu RLS cu IDNA în comparație cu NID
- Caracteristicile clinice ale pacienților cu RLS cu IDNA în comparație cu IDA
- Caracteristici hematologice la subiecții de control
- Discuție
- Caracteristici clinice ale IDNA în RLS
- Este IDNA un stadiu timpuriu anterior IDA în RLS?
- Accesarea și diagnosticarea IDNA în RLS
- Concluzie
- Declarația privind disponibilitatea datelor
- Declarația privind etica
- Contribuții ale autorilor
- Finanțare
- Conflict de interese
- Recunoștințe
- Material Suplimentar
- Abbreviații
Introducere
Sindromul picioarelor neliniștite (RLS) este o tulburare neurologică comună (1), iar deficitul de fier joacă un rol cheie în patogeneza sa (2, 3). Deficitul de fier este frecvent în RLS, iar anemia feriprivă (IDA) este o cauză bine cunoscută de RLS secundar (4, 5), care este asociată cu o creștere de șase ori a riscului de RLS în populația generală (6). Deficitul de fier fără anemie (IDNA, de asemenea, deficitul de fier nonanemic) este de obicei insidios și a atras recent atenția pentru prevalența sa la nivel mondial și provocarea pentru diagnostic și gestionare (7). În ciuda unei relații clare între semnificația clinică a RLS în populația cu IDNA (6), prevalența și caracteristicile IDNA în RLS nu au fost investigate în mod sistematic. Nu se știe dacă IDNA reprezintă un subgrup de RLS și dacă IDNA este un stadiu incipient înainte de IDA în RLS. În acest studiu, ne propunem să investigăm caracteristicile clinice ale RLS cu IDNA în comparație cu cei fără deficit de fier (NID, de asemenea, fără deficit de fier) și cu pacienții cu IDA într-o cohortă consecutivă de pacienți chinezi cu RLS.
Metode
Includerea și excluderea pacienților
Am recrutat în mod continuu pacienți de la Clinica noastră specializată în RLS și Clinica de tulburări de mișcare din cadrul Departamentului de Neurologie, Spitalul General din Shanghai, Școala de Medicină a Universității Jiao Tong din Shanghai, între ian. 2017 și oct. 2018. RLS a fost diagnosticat în conformitate cu criteriile de diagnosticare din 2014 ale Grupului internațional de studiu al sindromului picioarelor neliniștite (RLSSG) (1). Pacienții cu alte tulburări neurologice, cooperare slabă sau tulburări cognitive au fost excluși din studiu. Controalele sănătoase fără anemie, potrivite ca vârstă și sex, au fost recrutate în aceeași perioadă în Centrul de Examinare a Sănătății din spitalul nostru. Controalele au fost libere de boli neurologice, inclusiv RLS, prin interviu față în față.
Aprobări standard ale protocolului și consimțământul pacienților
Studiul a fost aprobat de Shanghai General Hospital Institutional Review Board și toți pacienții și controalele sănătoase incluse în studiu și-au dat consimțământul scris.
Program de examinare
Pacienții cu RLS au fost evaluați așa cum am descris anterior (8). Pe scurt, am intervievat pacienții față în față în clinica noastră ambulatorie. Pacienții considerați pozitivi pentru RLS au fost diagnosticați de doi neurologi specializați în RLS. Am înregistrat informațiile demografice, istoricul, simptomele, medicamentele, examinările neurologice și medicale generale și MMSE pentru toți pacienții recrutați. A fost evaluat în continuare un chestionar semi-structurat, care a inclus vârsta de debut a RLS, istoricul familial al RLS (familiaritate definită ca „rude de gradul întâi”), tipul și topografia senzațiilor și dacă simptomele RLS se corelau cu variația sezonieră. Severitatea RLS pentru 1 săptămână înainte de interviu a fost evaluată cu ajutorul scalei internaționale de evaluare a RLS (IRLSRS) (9). Examinările precum ecografia vasculară, vitezele de conducere nervoasă, electromiografia etc. au fost efectuate dacă erau indicate clinic pentru a exclude posibilele mimici ale RLS, cum ar fi polineuropatiile periferice, staza venoasă, claudicația vasculară, artrita reumatoidă și așa mai departe. De asemenea, au fost excluși subiecții cu antecedente de medicație cu neuroleptice sau alte medicamente pe care autorii le-au considerat posibil legate de RLS în ultimele trei luni. I-am exclus pe cei cu comorbidități notabile care au fost asociate cu RLS secundar, cum ar fi insuficiența renală cronică, sarcina, boala Parkinson, neuropatia periferică, accidentul vascular cerebral și ataxia. Au fost evaluate analizele de sânge pentru hemoglobină și starea periferică a fierului, inclusiv feritina serică, fierul, transferrina și capacitatea totală de legare a fierului (TIBC). Saturația de transferrină (TSAT) a fost calculată ca fier seric/TIBC × 100. Nivelul normal al hemoglobinei a fost definit ca fiind femeile ≥ 113 g/L și bărbații ≥ 131 g/L, în conformitate cu valoarea normală din spitalul nostru. IDNA este definită ca feritină serică <75 μg/L (sau feritină ≥ 75 μg/L, dar TSAT <20%) cu un nivel normal al hemoglobinei (10, 11). IDA este diagnosticată atunci când hemoglobina <113 g/L (femei) sau <131 g/L (bărbați), precum și feritina serică <75 μg/L (sau feritina serică ≥ 75 μg/L dar TSAT <20%).
Statistică
Datele au fost analizate folosind SPSS 21.0 pentru Windows (IBM Co., SUA). Toate datele sunt prezentate ca medii ± deviații standard. Deoarece majoritatea variabilelor nu au fost distribuite în mod normal, testul Kruskal-Wallis a fost utilizat pentru comparații cu o singură variabilă între cele trei grupuri, și post-hoc Mann-Whitney atunci când P < 0,05. Diferențele de proporții au fost analizate prin testul chi pătrat al lui Pearson sau testul exact al lui Fisher atunci când a fost cazul. P < 0,05 au fost considerate semnificative. Având în vedere efectele potențiale ale terapiei medicamentoase asupra simptomului RLS și a altor caracteristici, am calculat toate datele de două ori la totalul pacienților cu RLS și, respectiv, la pacienții cu RLS fără medicație.
Rezultate
Am înrolat în mod continuu un total de 196 de pacienți cu RLS primar fără anemie (RLS IDNA și RLS NID) în acest studiu, inclusiv 66 de pacienți de sex masculin (33,7%) și 130 de pacienți de sex feminin (66,3%). Vârsta medie a fost de 53,0 ± 13,5 ani. 65,8% (129/196) dintre pacienții cu RLS nu luau medicamente pentru RLS (109 nu luau medicamente, iar 20 nu luau medicamente de mai mult de 2 săptămâni la interviu). Am inclus, de asemenea, 26 de pacienți cu RLS cu IDA (22 fără medicamente). Am exclus cinci pacienți cu RLS anemici (Hb <113 g/L pentru femei și Hb <131 g/L pentru bărbați) care nu aveau dovezi de deficit de fier (feritină serică ≥ 75 μg/L, precum și TIBC ≥ 20%, feritină serică medie ca 236,1 ± 119,3 μg/L). Niciunul dintre pacienții cu RLS cu IDA nu a prezentat semne de infecție, iar cauzele RLS cu IDA au fost enumerate (tabelul 1). În plus, am colectat 63 de subiecți sănătoși de control, inclusiv 22 de subiecți de sex masculin (34,9%) și 41 de subiecți de sex feminin (65,1%), iar vârsta medie a grupului de control a fost de 51,0 ± 12,0 ani (vârsta medie de 51,0 ± 10,4 și 51,0 ± 12,8 ani pentru bărbați și, respectiv, femei). Nu au existat diferențe semnificative atât în ceea ce privește sexul (RLS vs. control: 66,3 vs. 65,1% pentru femei, P > 0,05), cât și vârsta (RLS vs. control: 53,0 ± 13,5 vs. 51,0 ± 12,0, P > 0,05) între pacienții cu RLS și cei de control. Informațiile demografice detaliate ale pacienților cu RLS din fiecare grup sunt prezentate (Tabelul 2).
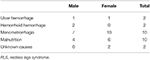
Tabel 1. Posibile cauze ale deficitului de fier la pacienții cu RLS anemic.
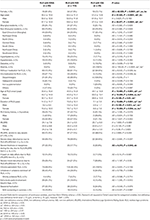
Tabel 2. Informații demografice și caracteristici clinice ale pacienților cu RLS cu IDNA, NID și IDA.
Frecvența IDNA la pacienții cu RLS
Dintre cei 196 de pacienți cu RLS (130 de femei, 66 de bărbați) fără anemie sau alte comorbidități, 83 (42,3%) aveau deficit de fier. Prevalența IDNA la femei (58,5%, 76/130) este mult mai mare decât la bărbați (10,6%, 7/66) în această cohortă de pacienți cu RLS fără anemie (tabelul 2), cu un risc relativ de 5,51 (interval de încredere 95% 2,70-11,27, p < 0,0001).
Caracteristicile clinice ale pacienților cu RLS cu IDNA în comparație cu NID
La pacienții cu RLS de sex feminin fără anemie, grupul IDNA a avut o vârstă mai tânără atât la interviu, cât și la debutul RLS, în comparație cu grupul NID (P < 0,01; Tabelul 2). Deși nu a existat nicio diferență privind severitatea RLS prin IRLSRS, am găsit mai mulți pacienți cu oboseală sau somnolență severă/foarte severă în timpul zilei în grupul IDNA în comparație cu grupul NID (32,5 vs. 17,7%, P < 0,05; Tabelul 2). Nu a existat nicio diferență în ceea ce privește istoricul familial, severitatea, lateralitatea, localizarea și fluctuația sezonieră a SLR între IDNA și grupul NID, nici la bărbați, nici la femei. Grupul IDNA RLS a prezentat valori mai scăzute ale feritinei serice (bărbați și femei, P < 0,0001), precum și valori mai ridicate ale transferinei și TIBC (femei, P < 0,0001), comparativ cu grupul NID RLS (Figura 1, Tabelul 3).
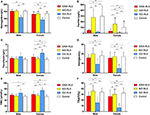
Figura 1. Parametrii hematologici și ai fierului în funcție de grup și sex (A) Hemoglobina. (B) Feritină. (C) Transferrină. (D) Fier. (E) TIBC. (F) TSAT. **P < 0,01, *P < 0,05, testul Kruskal-Wallis și testul post-hoc Mann-Whitney. Datele au fost comparate între IDNA RLS (n = 83), NID RLS (n = 113), IDA RLS (n = 26) și controale (n = 63). ##P < 0,01, #P < 0,05, Mann-Whitney U-test. Datele au fost comparate între bărbați și femei în fiecare grup de IDNA RLS, NID RLS, IDA RLS și controale. Deficiența de fier a fost definită ca nivel de feritină <75 μg/L, sau feritină 75 μg/L, însă TSAT <20%. IDA, anemie prin deficit de fier; IDNA, deficit de fier fără anemie; NID, fără deficit de fier; RLS, sindromul picioarelor neliniștite; TIBC, capacitatea totală de legare a fierului; TSAT, saturația transferinei.
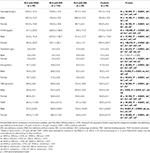
Tabelul 3. Date hematologice ale pacienților cu RLS cu IDNA, NID, IDA și controale.
După excluderea pacienților cu RLS care iau medicamente pentru RLS, grupul IDNA RLS a prezentat în continuare rate mai mari de oboseală severă/foarte severă/somnolență în timpul zilei în comparație cu grupul NID RLS, deși nu la un nivel semnificativ (35 vs. 18,8%, P = 0,078). Alte caracteristici între IDNA RLS și NID RLS au fost similare (tabelul suplimentar 1).
Caracteristicile clinice ale pacienților cu RLS cu IDNA în comparație cu IDA
Grupul IDA a avut parametrii metabolici serici ai fierului mai grav perturbați decât grupul IDNA, inclusiv feritină mai scăzută (bărbați, P < 0.05; femeie, P < 0,0001), transferrină mai mare (femeie, P < 0,0001), valori mai mici ale fierului (bărbat, P < 0,05; femeie, P < 0,0001), TIBC mai mare (femeie, P < 0,0001) și TSAT mai mici (bărbat, P < 0,05; femeie, P < 0,0001) în ser (figura 1, tabelul 3). IDNA RLS a avut o durată mai lungă a bolii (P < 0,01 la bărbați, P < 0,05 la femei) și o vârstă mai mică la debut (semnificativă doar la bărbați cu P < 0,05) decât IDA RLS. Nu au existat diferențe în ceea ce privește istoricul familial pozitiv, severitatea (IRLSRS), lateralitatea, localizarea și fluctuația sezonieră a RLS între IDNA RLS și IDA RLS, nici la bărbații, nici la femeile cu RLS (Tabelul 2). Rezultatele au fost similare după excluderea pacienților cu RLS care au luat medicamente pentru RLS (tabelul suplimentar 1).
Caracteristici hematologice la subiecții de control
Criteriile de diagnostic pentru deficitul de fier sunt diferite între populația generală și pacienții cu RLS (conform discuției de mai jos). În conformitate cu valoarea limită a spitalului nostru pentru deficitul de fier în populația generală (20 μg/L), am constatat că niciunul dintre subiecții de sex masculin din grupul de control nu avea deficit de fier, în timp ce patru subiecți de sex feminin de control au prezentat deficit de fier (doi subiecți cu feritină serică <20 μg/L și doi subiecți cu feritină ≥ 20 μg/L, dar TSAT <20%). Nu a existat nicio diferență semnificativă de prevalență a deficienței de fier la persoanele de control între bărbați (0%, 0/22) și femei (9,8%, 4/41; P = 0,288). Testele hematologice privind hemoglobina și parametrii fierului în grupul de control au fost cele mai asemănătoare cu grupul NID RLS în comparație cu grupul IDNA sau IDA (figura 1, tabelul 3).
Discuție
Patofiziologia RLS primar și secundar este incomplet înțeleasă. Deficitul de fier la nivelul creierului are un rol fundamental în patogeneza RLS, iar condițiile caracterizate de deficit de fier sistemic, cum ar fi anemia și sarcina, sunt asociate cu o prevalență mai mare a simptomelor RLS (2, 3, 5, 6). IDA este o comorbiditate recunoscută asociată cu RLS secundar (4-6, 12). IDNA este mai insidioasă, iar caracteristicile sale sunt mai puțin cunoscute la pacienții cu RLS.
Caracteristici clinice ale IDNA în RLS
În general, femeile sunt mai susceptibile la RLS (1, 13, 14). Femeile aflate la vârsta fertilă sunt, de asemenea, mai deficitare în fier decât bărbații din populația generală (15). În acest studiu privind pacienții cu RLS fără anemie, am constatat, de asemenea, o discriminare semnificativă în funcție de sex. Pacienții RLS de sex feminin prezintă un risc mult mai mare de IDNA decât pacienții RLS de sex masculin (risc relativ de 5,51, p < 0,0001). Mai puțini pacienți de sex masculin cu RLS au suferit de deficit de fier, fie cu sau fără anemie. La martori, deși fără semnificație statistică, am constatat că 9,8% dintre subiecții de sex feminin sufereau de deficiență de fier, în timp ce niciunul dintre subiecții de sex masculin nu a făcut acest lucru. Deficitul de fier este neobișnuit la sexul masculin, astfel încât, dacă pacienții cu RLS de sex masculin au deficit de fier, ar trebui făcute investigații suplimentare pentru a evalua cauzele secundare, cum ar fi hemoragia cronică și malnutriția datorată tulburărilor gastrointestinale.
În comparație cu grupul „normal” NID RLS, grupul IDNA RLS a prezentat o vârstă de debut a RLS mai timpurie și o vârstă mai mică la interviu la femei, dar nu și la bărbați (tabelul 2). Într-un studiu anterior, am constatat că RLS cu debut precoce a demonstrat un istoric familial RLS mai pozitiv și parametrii periferici de fier mai grav perturbați (feritină serică mai mică și valori mai mari ale transferrinei și TIBC serice) în comparație cu RLS cu debut tardiv (8). Recent, am constatat că IDNA în RLS prezice anumiți factori genetici în comparație cu NID în RLS (date nepublicate). Un potențial subtip în asociere cu fondul genetic, deficitul de fier și RLS cu debut precoce merită investigații suplimentare. Oboseala, slăbiciunea, dificultatea de a se concentra, scăderea memoriei, precum și performanța slabă la locul de muncă sunt simptome nespecifice care sunt adesea asociate cu deficiența de fier (7, 16). Allen et al. (6) au raportat anterior că bolnavii IDA cu RLS au prezentat mai multă oboseală, o calitate mai slabă a somnului și o energie scăzută în timpul zilei în comparație cu pacienții IDA fără RLS. Am constatat că pacienții cu RLS cu IDNA au fost, de asemenea, mai predispuși să sufere de manifestări de oboseală severă/foarte severă sau de somnolență în timpul zilei din cauza RLS în comparație cu pacienții cu RLS cu IDNA (punct de tăiere la 75 μg/L, 32,5 vs. 17,7%, P < 0,05, Tabelul 2). Atunci când au fost analizați din nou doar la pacienții cu RLS fără medicație, pacienții cu RLS cu IDNA au prezentat în continuare o tendință de mai mare susceptibilitate la oboseală sau somnolență severă/foarte severă în timpul zilei, deși nu a atins o semnificație statistică (35 vs. 18,8%, P = 0,078, Tabelul suplimentar 1). În acest studiu nu s-a constatat nicio diferență de oboseală sau somnolență diurnă severă/foarte severă între IDNA RLS și IDA RLS (Tabelul 2). Rezerva deficitară de fier, de-a lungul unui continuum de la IDA la IDNA, este asociată cu scăderea activității enzimelor dependente de fier, cu reducerea capacității oxidative celulare, precum și cu scăderea eficienței energetice (17-19). Atunci când am utilizat o definiție mai strictă pentru IDNA (valoarea limită a feritinei serice stabilită la 50 μg/L), am constatat în continuare că mai mulți pacienți cu RLS IDNA au suferit de oboseală sau somnolență severă/foarte severă în timpul zilei în comparație cu pacienții cu RLS NID (32,3 vs. 19,8%), însă acest lucru nu a fost semnificativ (P > 0,05; Tabelul suplimentar 2). Mișcarea periodică a picioarelor în somn (PLMS) este strâns legată de RLS, iar locusul din cadrul genei BTBD9 este corelat cu riscul atât de PLMS, cât și de RLS (20, 21). În mod notabil, am evaluat doar calitatea somnului folosind subpunctul 4 al IRLSRS și nu am efectuat o evaluare detaliată a stării de somn folosind măsura polisomnografică (PSG). În consecință, nu au fost disponibile date privind PLMS și alți parametri legați de somn, care pot contribui în mod semnificativ la oboseala sau somnolența diurnă. Prin urmare, asocierea dintre oboseala/somnolența diurnă și IDNA necesită investigații suplimentare. Nu am constatat o diferență semnificativă în ceea ce privește severitatea SLR între grupul IDNA și grupul NID. Deficitul de fier periferic va crește riscul de prevalență a RLS în studiile clinice anterioare (6). Concentrațiile reduse de fier seric scad la nivel global nivelurile de fier din creier, iar tratamentul cu fier aduce beneficii pacienților cu RLS cu niveluri scăzute de fier periferic (10). Cu toate acestea, numeroși pacienți cu RLS fără deficit de fier sistemic prezintă totuși un deficit de fier specific creierului (22). Studiile la rozătoare au raportat că statusul de fier seric nu a fost corelat cu nivelurile regionale de fier din creier, prin urmare, poate fi legat în mod limitat de caracteristicile RLS (23, 24).
Este IDNA un stadiu timpuriu anterior IDA în RLS?
Deficitul de fier poate fi clasificat în două niveluri, IDNA și IDA, în funcție de valoarea de măsurare a hemoglobinei. În acest studiu, pacienții cu RLS cu IDA au avut cele mai scăzute niveluri de hemoglobină, feritină și fier, precum și cele mai ridicate valori ale transferrinei și TIBC în comparație cu RLS IDNA și RLS NID (Figura 1, Tabelul 3). Deși nu au existat diferențe semnificative în ceea ce privește nivelurile de hemoglobină între IDNA RLS și NID RLS (atât la pacienții cu RLS de sex masculin, cât și la cei de sex feminin), hemoglobina serică la pacienții cu IDNA RLS a fost mai mică în comparație cu controalele (numai la femei, P < 0,05, Figura 1, Tabelul 3). În plus, valorile parametrilor de fier în grupul IDNA RLS au fost între cele ale grupului NID RLS sau ale grupului de control și cele ale grupului IDA RLS (Figura 1, Tabelul 3). Aceste rezultate sunt în concordanță cu punctul de vedere al IDNA este o deficiență de fier mai ușoară înainte de dezvoltarea anemiei. De remarcat, se consideră că parametrii fierului seric reflectă starea periferică a fierului în principal în eritroane (25), în timp ce stocarea fierului în alte organe (cum ar fi ficatul, creierul etc.) trebuie validată la subiecții IDNA.
Cu toate acestea, cauzele și caracteristicile IDNA RLS și IDA RLS nu sunt în întregime similare. În acest studiu, majoritatea pacienților cu RLS cu IDA au avut comorbidități notabile asociate cu malnutriția sau pierderea excesivă cronică de sânge, inclusiv hemoragia tractului alimentar, hemoragia hemoroizilor și menoragia (tabelul 1), ceea ce este în concordanță cu studiul anterior (12). Este demn de remarcat faptul că menoragia este o cauză frecventă de IDA la femeile de vârstă reproductivă, care poate fi ulterioară fibroamelor uterine, adenomiozei și altor tulburări ginecologice. Malnutriția poate fi secundară tulburărilor gastrointestinale, dietei vegetariene și concepțiilor greșite cu privire la imaginea corporală proprie la femeile tinere. Astfel, deficitul de fier la majoritatea pacienților IDA RLS din acest studiu sunt „deficit absolut de fier”. În schimb, pacienții cu RLS cu IDNA nu au, de obicei, comorbidități notabile. Cauzele RLS IDNA sunt insidioase, iar IDNA în RLS aparține, în general, domeniului de aplicare al RLS primar (4) asociat cu „deficiența funcțională de fier”. Cu toate acestea, nu putem exclude nicio cauză secundară insidioasă la pacienții cu RLS cu IDNA, care poate duce la un aport inadecvat de fier în organism.
În comparație cu RLS cu IDNA, pacienții cu IDNA au avut o vârstă mai înaintată de debut a RLS, precum și o durată mai scurtă a RLS atât la bărbați, cât și la femei (mai semnificativă la bărbați; tabelul 2), ceea ce a fost în concordanță cu punctul de vedere conform căruia RLS secundar are de obicei o vârstă de debut mai înaintată (26). Conform experienței noastre, acești pacienți cu RLS IDA cu cauze notabile (cum ar fi pierderea acută de sânge) demonstrează, de obicei, o durată mai scurtă a bolii și o recuperare sau ameliorare mai rapidă atunci când tulburările comorbide tratabile sunt corectate și starea de fier este restabilită. De obicei, aceștia nu necesită un tratament pe termen lung pentru RLS, care sunt oarecum diferiți de pacienții cu RLS primar. Sunt necesare studii longitudinale viitoare pentru a confirma efectele tratamentului cu supliment de fier la pacienții cu RLS cu IDA. Alte studii privind RLS comorbid de sarcină (27) și uremie (28) au raportat o ameliorare după naștere și transplant renal, sugerând că modificările factorilor metabolici asociați pot declanșa RLS la subiecții susceptibili (5).
Prin urmare, există eterogenitate atât în RLS IDA, cât și în RLS IDNA. Deși IDNA este, în general, considerat un stadiu timpuriu înaintea anemiei (7), este posibil ca IDNA RLS să nu fie pur și simplu un stadiu prodromial înaintea IDA RLS.
Accesarea și diagnosticarea IDNA în RLS
Deși biopsia măduvei osoase este considerată cel mai bun indicator pentru statusul de fier, aceasta este rareori efectuată din cauza riscurilor potențiale de infecție sau sângerare la locul biopsiei (29). Cei mai utilizați indicatori de laborator ai statusului de fier sunt feritina, care reflectă fie depozitele de fier tisular, fie adecvarea fierului ușor disponibil pentru eritropoieză (30). Deși feritina serică este un marker sensibil pentru evaluarea stocului total de fier din organism, alte condiții, cum ar fi starea inflamatorie, vârsta și funcția renală, pot fi factori de confuzie, crescând nivelul feritinei serice (31). Feritina și transferrina sunt, de asemenea, reactanți ai fazei acute, iar nivelul de feritină ar putea fi crescut, iar nivelul de transferrină ar putea fi scăzut într-o stare inflamatorie (32). Prin urmare, chiar și feritina serică ≥ 75 μg/L și TSAT <20% ar putea avea totuși o deficiență reală de fier (11, 33).
Un punct de tăiere al concentrației serice de feritină de <30 μg/L este cel mai sensibil și specific pentru a identifica o potențială deficiență de fier în populația generală (17, 18), iar IDNA este clasificat ca având niveluri normale de hemoglobină cu niveluri scăzute de feritină serică (<20 μg/L) (34, 35). Laboratoarele clinice stabilesc, de obicei, limita inferioară a intervalului de referință pentru feritina serică la 10-20 μg/L în populația obișnuită (36) (limita inferioară este stabilită la 20 μg/L în spitalul nostru). Niveluri limită semnificativ mai ridicate pentru feritina serică sunt de obicei utilizate pentru a defini deficitul de fier în afecțiuni cronice, cum ar fi insuficiența cardiacă și boala cronică de rinichi (7, 17). Criteriile de evaluare pentru a defini deficitul de fier în RLS sunt, de asemenea, diferite de cele de la controalele sănătoase, deși valoarea limită exactă a feritinei pentru a semnifica IDNA în RLS nu a ajuns încă la un consens. Studii recente sugerează că pacienții cu RLS ar trebui să fie considerați cu deficit de fier atunci când concentrația de feritină este sub 75 μg/L (10, 11, 27). Cu toate acestea, studiile anterioare au determinat, în cea mai mare parte, concentrația de feritină sub 50 μg/L ca „status scăzut de fier” în RLS (37, 38). Deoarece nu sunt disponibile date privind descrierile diferitelor puncte de tăiere, am comparat caracteristicile IDNA RLS și NID RLS folosind atât 75, cât și 50 μg/L ca valori de tăiere a feritinei pentru deficitul de fier. Am constatat că, atunci când se utilizează 50 μg/L ca linie de bord inferioară a feritinei, 33,2% (65/196) dintre pacienții cu RLS îndeplinesc criteriile IDNA. Rezultatele au fost destul de asemănătoare pentru cele două praguri utilizate, cu excepția faptului că creșterea oboselii severe/foarte severe sau a somnolenței în timpul zilei la RLS IDNA în comparație cu RLS NID nu a fost semnificativă atunci când valoarea limită a feritinei a fost stabilită la 50 μg/L (tabelul 2, tabelul suplimentar 2).
Studiul nostru a avut unele limitări: În primul rând, acesta a fost un studiu transversal și lipsa datelor longitudinale a făcut dificilă identificarea evoluției simptomelor RLS și a efectelor tratamentului. În plus, este posibil să existe o prejudecată de reamintire. În al doilea rând, acesta a fost un studiu cu un singur centru, deoarece aproximativ un sfert dintre pacienți erau rezidenți locali din Shanghai, iar majoritatea pacienților proveneau din estul Chinei. Având în vedere un teritoriu vast în China și diverși factori de mediu posibili, poate exista o prejudecată de selecție. În al treilea rând, nu am efectuat măsurători PSG pentru a evalua starea detaliată a somnului la pacienții cu RLS și la controale. În al patrulea rând, aproximativ o treime dintre pacienții cu RLS din acest studiu au urmat un tratament dopaminergic și/sau un tratament cu gabapentin enacarbil (doar un singur pacient a primit un tratament suplimentar cu fier), ceea ce poate influența caracteristicile clinice. Cu toate acestea, am calculat din nou toate datele la pacienții cu RLS fără medicație și am ajuns la aceeași concluzie. Acestea fiind spuse, studiul nostru are unele avantaje. Am studiat în detaliu spectrul clinic al RLS și am exclus alte comorbidități sau mimica RLS. Am intervievat fiecare pacient față în față și am exclus cu atenție acei pacienți cu RLS atipic în timpul urmăririi. Au existat studii limitate privind caracteristicile IDNA în RLS, noi am explorat caracteristicile clinice detaliate ale IDNA la pacienții chinezi consecutivi cu RLS.
Concluzie
IDNA este frecventă la pacienții cu RLS, în special la femei și are unele caracteristici clinice speciale. IDNA a avut o vârstă mai tânără atât la interviu, cât și la debutul RLS, în comparație cu NID la pacienții cu RLS de sex feminin. IDNA nu este foarte frecventă la pacienții cu RLS de sex masculin, iar bărbații cu deficit de fier ar trebui să fie evaluați pentru tulburări comorbide. Caracteristicile pacienților cu RLS cu IDNA sunt diferite de cele ale pacienților cu RLS cu IDA. RLS cu IDNA reprezintă o problemă de sănătate publică importantă și neglijată, care merită mai multă atenție clinică și ar trebui abordată în strategia de tratament. Se recomandă depistarea regulată a parametrilor periferici ai fierului chiar și la pacienții cu hemoleucograma normală pentru o terapie adecvată în timp util.
Declarația privind disponibilitatea datelor
Seturile de date generate pentru acest studiu sunt disponibile la cererea autorului corespondent.
Declarația privind etica
Studiile care au implicat participanți umani au fost revizuite și aprobate de către Shanghai General Hospital Institutional Review Board. Pacienții/participanții și-au dat consimțământul în cunoștință de cauză, în scris, pentru a participa la acest studiu.
Contribuții ale autorilor
X-YZ concepția/designul/execuția proiectului/redactarea manuscrisului. T-TW: executarea proiectului/colectarea și interpretarea datelor/redactarea manuscrisului. H-MW și JS: măsurători de laborator. XL, L-YN, T-JC și M-YQ: executarea proiectului/colectarea și interpretarea datelor. TL și WO: revizuirea critică a manuscrisului pentru conținut intelectual important. Y-CW: concepție/design/supravegherea proiectului, revizuirea critică a manuscrisului pentru conținut intelectual important. Toți autorii: pregătirea manuscrisului.
Finanțare
Această lucrare a fost sponsorizată de Comisia de planificare municipală din Shanghai a Fondului pentru știință și cercetare (201740017), de Planul de inovare în domeniul cercetării clinice al Spitalului General din Shanghai (CTCCR-2018C02), de Programul interdisciplinar al Universității Jiao Tong din Shanghai (YG2015QN21) și de Fundația Națională de Științe Naturale din China (nr. 81671251).
Conflict de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Le mulțumim tuturor pacienților și subiecților de control sănătoși care au participat la acest studiu. Mulțumim personalului Centrului de Examinare Fizică din cadrul Spitalului General din Shanghai. De asemenea, mulțumim Departamentului de Bioinformatică și Biostatistică, Școala de Științe ale Vieții și Biotehnologie, Universitatea Jiao Tong din Shanghai, lui Yue Zhang pentru consultanță statistică.
Material Suplimentar
Materialul suplimentar pentru acest articol poate fi găsit online la adresa: https://www.frontiersin.org/articles/10.3389/fneur.2020.00298/full#supplementary-material
Abbreviații
CI, interval de încredere; IRLSSG, International Restless Legs Study Group; MMSE, Mini-Mental State Examination; NID, fără deficit de fier; RLS, sindromul picioarelor neliniștite; IDA, anemie feriprivă; IDNA, deficit de fier fără anemie; IRLSRS, International Restless Legs Syndrome Rating Scale; TIBC, capacitatea totală de legare a fierului; TSAT, saturația transferinei.
1. Allen RP, Picchietti DL, Garcia-Borreguero D, Ondo WG, Walters AS, Winkelman JW, et al. Criterii de diagnostic pentru sindromul picioarelor neliniștite/boala Willis-Ekbom: criterii de consens actualizate ale Grupului internațional de studiu al sindromului picioarelor neliniștite (RLSSG) – istoric, raționament, descriere și semnificație. Sleep Med. (2014) 15:860-73. doi: 10.1016/j.sleep.2014.03.025
CrossRef Full Text | Google Scholar
2. Connor JR, Boyer PJ, Menzies SL, Dellinger B, Allen RP, Ondo WG, et al. Examinarea neuropatologică sugerează o afectare a achiziției de fier din creier în sindromul picioarelor neliniștite. Neurologie. (2003) 61:304-9. doi: 10.1212/01.WNL.0000078887.16593.12
PubMed Abstract | Refef Full Text | Google Scholar
3. Allen RP, Earley CJ. Rolul fierului în sindromul picioarelor neliniștite. Mov disord. (2007) 18(22 Suppl):S440-8. doi: 10.1002/mds.21607
CrossRef Full Text | Google Scholar
4. Trenkwalder C, Allen R, Allen R, Hogl B, Clemens S, Patton S, Schormair B, et al. Comorbidități, tratament și fiziopatologie în sindromul picioarelor neliniștite. Lancet Neurol. (2018) 17:994-1005. doi: 10.1016/S1474-4422(18)30311-9
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Trenkwalder C, Allen R, Allen R, Hogl B, Paulus W, Winkelmann J. Sindromul picioarelor neliniștite asociat cu boli majore: o revizuire sistematică și un nou concept. Neurologie. (2016) 86:1336-43. doi: 10.1212/WNL.0000000000002542
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Allen RP, Auerbach S, Auerbach S, Bahrain H, Auerbach M, Earley CJ. Prevalența și impactul sindromului picioarelor neliniștite la pacienții cu anemie feriprivă. Am J Hematol. (2013) 88:261-4. doi: 10.1002/ajh.23397
PubMed Abstract | Full CrossRef Text | Google Scholar
7. Soppi ET. Deficitul de fier fără anemie – o provocare clinică. Clin Case Rep. (2018) 6:1082-6. doi: 10.1002/ccr3.1529
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Zhu XY, Wu TT, Wang HM, Ni LY, Li X, Liu Y, et al. Caracteristici clinice și subtipuri ale sindromului picioarelor neliniștite în populația chineză: un studiu de 359 de pacienți. Sleep Med. (2019) 59:15-23. doi: 10.1016/j.sleep.2019.01.053
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP, et al. International Restless Legs Syndrome Study, Validation of the International Restless Legs Syndrome Study Group rating scale for restless legs syndrome. Sleep Med. (2003) 4:121-32. doi: 10.1016/S1389-9457(02)00258-7
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. International Restless Legs Syndrome Study, Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report. Sleep Med. (2018) 41:27-44. doi: 10.1016/j.sleep.2017.11.1126
CrossRef Full Text | Google Scholar
11. Trenkwalder C, Winkelmann J, Oertel W, Virgin G, Roubert B, Mezzacasa A, et al. Carboximaltoza ferică la pacienții cu sindromul picioarelor neliniștite și deficit de fier nonanemic: un studiu randomizat. Mov Disord. (2017) 32:1478-82. doi: 10.1002/mds.27040
PubMed Abstract | Text integral | Google Scholar
12. Mehmood T, Auerbach M, Earley CJ, Allen RP. Răspunsul la fierul intravenos la pacienții cu anemie feriprivă (IDA) și sindromul picioarelor neliniștite (boala Willis-Ekbom). Sleep Med. (2014) 15:1473-6. doi: 10.1016/j.sleep.2014.08.012
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Thomas K, Watson CB. Sindromul picioarelor neliniștite la femei: o revizuire. J Womens Health. (2008) 17:859-68. doi: 10.1089/jwh.2007.0515
PubMed Abstract | Refef Full Text | Google Scholar
14. Ohayon MM, O’Hara R, Vitiello MV. Epidemiologia sindromului picioarelor neliniștite: o sinteză a literaturii. Sleep Med Rev. (2012) 16:283-95. doi: 10.1016/j.smrv.2011.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Umbreit J. Iron deficiency: a concise review. Am J Hematol. (2005) 78:225-31. doi: 10.1002/ajh.20249
PubMed Abstract | Text integral | Google Scholar
16. Sawada T, Konomi A, Yokoi K. Deficiența de fier fără anemie este asociată cu furie și oboseală la femeile japoneze tinere. Biol Trace Elem Res. (2014) 159:22-31. doi: 10.1007/s12011-014-9963-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Camaschella C. Anemia feriprivă. N Engl J Med. (2015) 372:1832-43. doi: 10.1056/NEJMra1401038
PubMed Abstract | Refef Full Text | Google Scholar
18. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Iron deficiency anaemia. Lancet. (2016) 387:907-16. doi: 10.1016/S0140-6736(15)60865-0
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Haas JD, Brownlie T. Deficiența de fier a redus capacitatea de muncă: o analiză critică a cercetării pentru a determina o relație cauzală. J Nutr. (2001) 131:676S-88S; discuție 688S-90S. doi: 10.1093/jn/131.2.676S
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Stefansson H, Rye DB, Hicks A, Petursson H, Ingason A, Thorgeirsson TE, et al. Un factor de risc genetic pentru mișcările periodice ale membrelor în somn. N Engl J Med. (2007) 357:639-47. doi: 10.1056/NEJMoa072743
PubMed Abstract | Ref. Full Text | Google Scholar
21. Li G, Tang H, Tang H, Wang C, Qi X, Chen J, Chen S, et al. Asocierea BTBD9 și MAP2K5/SKOR1 cu sindromul picioarelor neliniștite în populația chineză. Sleep. (2017) 40:zsx028. doi: 10.1093/sleep/zsx028
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Earley CJ, Connor J, Garcia-Borreguero D, Jenner P, Winkelman J, Zee PC, et al. Alterarea homeostaziei fierului din creier și a funcției dopaminergice în sindromul picioarelor neliniștite (boala Willis-Ekbom). Sleep Med. (2014) 15:1288-301. doi: 10.1016/j.sleep.2014.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Erikson KM, Pinero DJ, Connor JR, Beard JL. Concentrațiile regionale de fier, feritină și transferrină din creier în timpul deficienței de fier și a reîncărcării cu fier la șobolani în curs de dezvoltare. J Nutr. (1997) 127:2030-8. doi: 10.1093/jn/127.10.2030
PubMed Abstract | Refef Full Text | Google Scholar
24. Yin L, Unger EL, Jellen LC, Earley CJ, Allen RP, Tomaszewicz A, et al. Analiza genetică sistemică a răspunsului multivariat la deficiența de fier la șoareci. Am J Physiol Regul Integr Comp Physiol. (2012) 302:R1282-96. doi: 10.1152/ajpregu.00634.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hallberg L, Hulthen L. Perspective privind absorbția fierului. Blood Cells Mol Dis. (2002) 29:562-73. doi: 10.1006/bcmd.2002.0603
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Shukla G, Gupta A, Pandey RM, Kalaivani M, Goyal V, Srivastava A, et al. What features differentiate unilateral from bilateral restless legs syndrome? Un studiu observațional comparativ cu 195 de pacienți. Sleep Med. (2014) 15:714-9. doi: 10.1016/j.sleep.2014.01.025
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Picchietti DL, Hensley JG, Bainbridge JL, Lee KA, Manconi M, McGregor JA, et al. International Restless Legs Syndrome Study, Consensus clinical practice guidelines for the diagnosis and treatment of restless legs syndrome/Willis-Ekbom disease during pregnancy and lactation. Sleep Med Rev. (2015) 22:64-77. doi: 10.1016/j.smrv.2014.10.009
CrossRef Full Text | Google Scholar
28. Winkelmann J, Stautner A, Samtleben W, Trenkwalder C. Evoluția pe termen lung a sindromului picioarelor neliniștite la pacienții dializați după transplantul renal. Mov Disord. (2002) 17:1072-6. doi: 10.1002/mds.10231
PubMed Abstract | Text integral | Google Scholar
29. Bain BJ. Morbiditatea biopsiei măduvei osoase: revizuirea anului 2003. J Clin Pathol. (2005) 58:406-8. doi: 10.1136/jcp.2004.022178
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Baynes RD. Evaluarea statusului de fier. Clin Biochem. (1996) 29:209-15. doi: 10.1016/0009-9120(96)00010-K
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Wish JB. Evaluarea statusului de fier: dincolo de feritina serică și saturația de transferrină. Clin J Am Soc Nephrol. (2006) 1(1 Suppl):S4-8. doi: 10.2215/CJN.0149050506
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Tietz NW, Rinker AD, Morrison SR. Când un fier seric este într-adevăr un fier seric? The status of serum iron measurements. Clin Chem. (1994) 40:546-1. doi: 10.1093/clinchem/40.4.546
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Mackie S, Winkelman JW. Feritină normală la un pacient cu deficiență de fier și RLS. J Clin Sleep Med. (2013) 9:511-3. doi: 10.5664/jcsm.2680
PubMed Abstract | Full Text | Google Scholar
34. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Compararea a două doze de fier elementar în tratamentul deficitului de fier latent: eficacitate, efecte secundare și capacități de orbire. Nutrienți. (2014) 6:1394-405. doi: 10.3390/nu6041394
PubMed Abstract | Full CrossRef Text | Google Scholar
35. D’Adamo CR, Novick JS, Feinberg TM, Dawson VJ, Miller LE. Un supliment alimentar derivat din alimente care conține o doză mică de fier a îmbunătățit markerii statutului de fier în rândul femeilor cu deficit de fier nonanemic. J Am Coll Nutr. (2018) 37:342-9. doi: 10.1080/07315724.2018.1427158
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Goodnough LT, Nemeth E, Ganz T. Detectarea, evaluarea și gestionarea eritropoiezei cu restricție de fier. Blood. (2010) 116:4754-61. doi: 10.1182/blood-2010-05-286260
PubMed Abstract | Refef Full Text | Google Scholar
37. Lee CS, Lee SD, Kang SH, Park HY, Yoon IY. Compararea eficacității fierului oral și a pramipexolului pentru tratamentul pacienților cu sindromul picioarelor neliniștite cu feritină serică scăzută. Eur J Neurol. (2014) 21:260-6. doi: 10.1111/ene.12286
PubMed Abstract | Full Text | Google Scholar
38. Tilma J, Tilma K, Norregaard O, Ostergaard JR. Sindromul picioarelor neliniștite cu debut precoce în copilărie: simptome și efectul tratamentului oral cu fier. Acta Paediatr. (2013) 102:e221-6. doi: 10.1111/apa.12173
PubMed Abstract | Refef Full Text | Google Scholar
.