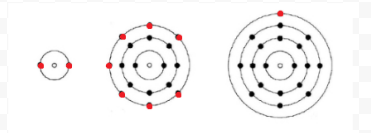
Lewis benutzte einfache Diagramme (heute Lewis-Diagramme genannt), um die Anzahl der Elektronen in der äußersten Schale eines Atoms, der Valenzschale, zu bestimmen. Der Kern des Atoms, d. h. der Nukleus zusammen mit den inneren Elektronen, wird durch das chemische Symbol dargestellt, und nur die Valenzelektronen werden als Punkte um das chemische Symbol herum gezeichnet. So können die drei in Abbildung 1 aus Elektronen und Valenz gezeigten Atome durch die folgenden Lewis-Diagramme dargestellt werden:

Ist das Atom ein Edelgasatom, sind zwei alternative Vorgehensweisen möglich. Entweder man geht davon aus, dass das Atom keine Valenzelektronen hat, oder man betrachtet die äußerste gefüllte Schale als Valenzschale. Die ersten drei Edelgase lassen sich also wie folgt schreiben:
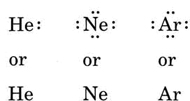
Beispiel \(\PageIndex{1}\): Lewis-Strukturen
Zeichne Lewis-Diagramme für jeweils ein Atom der folgenden Elemente: Li, N, F, Na
Lösung
Aus dem Periodensystem auf der vorderen Umschlagseite geht hervor, dass Li die Ordnungszahl 3 hat. Es enthält also drei Elektronen, eines mehr als das Edelgas He. Das bedeutet, dass die äußerste oder Valenzschale nur ein Elektron enthält, und das Lewis-Diagramm lautet
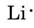
Nach der gleichen Logik hat N sieben Elektronen, fünf mehr als He, während F neun Elektronen hat, sieben mehr als He, was
![]()
Na hat neun Elektronen mehr als He, aber acht davon sind im Kern, entsprechend den acht Elektronen in der äußersten Schale von Ne. Da Na nur ein Elektron mehr hat als Ne, lautet sein Lewis-Diagramm
![]()
Aus dem vorangegangenen Beispiel ist ersichtlich, dass die Lewis-Diagramme der Alkalimetalle bis auf ihre chemischen Symbole identisch sind. Dies stimmt gut mit dem sehr ähnlichen chemischen Verhalten der Alkalimetalle überein. In ähnlicher Weise sehen die Lewis-Diagramme für alle Elemente in anderen Gruppen, wie z. B. die Erdalkalimetalle oder die Halogene, gleich aus.
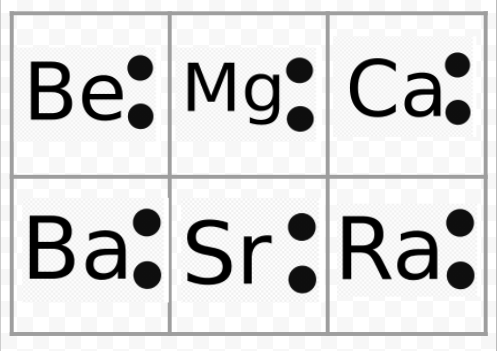
Die Lewis-Diagramme können auch verwendet werden, um die Wertigkeiten der Elemente vorherzusagen. Lewis schlug vor, dass die Anzahl der Valenzen eines Atoms gleich der Anzahl der Elektronen in seiner Valenzschale oder der Anzahl der Elektronen ist, die der Valenzschale hinzugefügt werden müssten, um die elektronische Schalenstruktur des nächsten Edelgases zu erreichen. Ihre Lewis-Diagramme und die der Edelgase He und Ne lauten

Vergleicht man Be mit He, so stellt man fest, dass Ersteres zwei Elektronen mehr hat und daher eine Wertigkeit von 2 haben sollte. Beim Element O könnte man eine Wertigkeit von 6 oder eine Wertigkeit von 2 erwarten, da es sechs Valenzelektronen hat – zwei weniger als Ne. Mit Hilfe der auf diese Weise entwickelten Wertigkeitsregeln konnte Lewis die regelmäßige Zunahme und Abnahme der Indizes der Verbindungen in der Tabelle im Abschnitt Wertigkeit erklären, die hier wiedergegeben ist. Darüber hinaus konnte er mehr als 50 Prozent der Formeln in der Tabelle erklären. (Diejenigen, die mit seinen Ideen übereinstimmen, sind in der Tabelle farblich hervorgehoben. Vielleicht möchten Sie sich jetzt die Tabelle ansehen und überprüfen, ob einige der angegebenen Formeln den Regeln von Lewis entsprechen). Lewis‘ Erfolg in diesem Zusammenhang gab einen klaren Hinweis darauf, dass die Elektronen der wichtigste Faktor sind, der die Atome bei der Bildung von Molekülen zusammenhält.
Trotz dieser Erfolge gibt es auch Schwierigkeiten in Lewis‘ Theorien, insbesondere für Elemente jenseits von Calcium im Periodensystem. Das Element Br (Z = 35) hat zum Beispiel 17 Elektronen mehr als das Edelgas Ar (Z = 18). Daraus lässt sich schließen, dass Br 17 Valenzelektronen hat, was es schwierig macht zu erklären, warum Br Cl und F so sehr ähnelt, obwohl diese beiden Atome nur sieben Valenzelektronen haben.
| Element | Atomgewicht | Wasserstoff Verbindungen | Sauerstoff-Verbindungen | Chlor-Verbindungen |
|---|---|---|---|---|
| Wasserstoff | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | Nicht gebildet | Nicht gebildet | Nicht gebildet |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Bor | 10.81 | B2H6 | B2O3 | BCl3 |
| Kohlenstoff | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Stickstoff | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Sauerstoff | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Nicht gebildet | Nicht gebildet | Nicht gebildet |
| Natrium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
| Aluminium | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silizium | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Phosphor | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Schwefel | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlor | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Kalium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | Nicht gebildet | Nicht gebildet | Nicht gebildet |
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relativ instabil | Sc2O3 | ScCl3 |
| Titan | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Beiträger
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff und Adam Hahn.