Lewis a utilisé des diagrammes simples (maintenant appelés diagrammes de Lewis) pour garder une trace du nombre d’électrons présents dans la coquille la plus externe, ou de valence, d’un atome donné. Le noyau de l’atome, c’est-à-dire le noyau et les électrons internes, est représenté par le symbole chimique, et seuls les électrons de valence sont dessinés sous forme de points entourant le symbole chimique. Ainsi, les trois atomes illustrés dans la figure 1 de Électrons et Valence peuvent être représentés par les diagrammes de Lewis suivants :
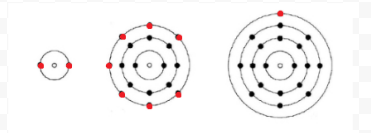

Si l’atome est un atome de gaz noble, deux procédures alternatives sont possibles. Soit on peut considérer que l’atome n’a pas d’électrons de valence, soit on peut considérer la coquille remplie la plus externe comme la coquille de valence. Les trois premiers gaz nobles peuvent donc s’écrire comme:
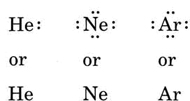
Exemple \(\PageIndex{1}\) : Structures de Lewis
Dessinez des diagrammes de Lewis pour un atome de chacun des éléments suivants : Li, N, F, Na
Solution
Nous trouvons dans le tableau périodique à l’intérieur de la couverture que Li a un numéro atomique de 3. Il contient donc trois électrons, un de plus que le gaz noble He. Cela signifie que la coquille la plus externe, ou coquille de valence, ne contient qu’un seul électron, et le diagramme de Lewis est
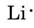
Suivant le même raisonnement, N a sept électrons, cinq de plus que He, tandis que F a neuf électrons, sept de plus que He, ce qui donne
![]()
Na a neuf électrons de plus que He, mais huit d’entre eux sont dans le noyau, correspondant aux huit électrons de la coquille la plus externe de Ne. Puisque Na n’a qu’un électron de plus que Ne, son diagramme de Lewis est
![]()
Voyez dans l’exemple précédent que les diagrammes de Lewis des métaux alcalins sont identiques sauf pour leurs symboles chimiques. Cela correspond bien au comportement chimique très similaire des métaux alcalins. De même, les diagrammes de Lewis de tous les éléments des autres groupes, comme les alcalino-terreux ou les halogènes, se ressemblent.
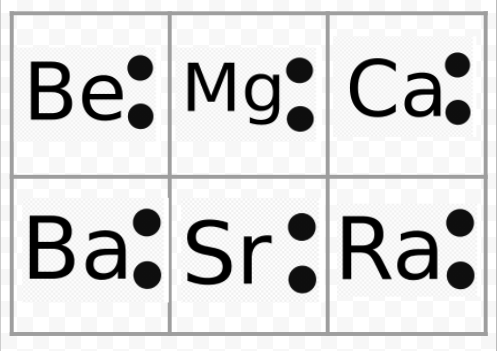
Les diagrammes de Lewis peuvent également être utilisés pour prédire les valences des éléments. Lewis a suggéré que le nombre de valences d’un atome était égal au nombre d’électrons dans sa coquille de valence ou au nombre d’électrons qui devraient être ajoutés à la coquille de valence pour obtenir la structure de la coquille électronique du gaz noble suivant. Pour illustrer cette idée, considérons les éléments Be et O. Leurs diagrammes de Lewis et ceux des gaz nobles He et Ne sont les suivants :

En comparant Be à He, on constate que le premier a deux électrons de plus et devrait donc avoir une valence de 2. L’élément O pourrait avoir une valence de 6 ou de 2 puisqu’il a six électrons de valence – deux de moins que Ne. En utilisant les règles de valence ainsi développées, Lewis a pu expliquer l’augmentation et la diminution régulières des indices des composés dans le tableau figurant dans la section sur la valence et reproduit ici. En outre, il a pu expliquer plus de 50 % des formules du tableau. (Celles qui correspondent à ses idées sont ombragées en couleur dans le tableau. Vous pouvez vous référer à ce tableau maintenant et vérifier que certaines des formules indiquées suivent les règles de Lewis). Le succès de Lewis à cet égard a donné une indication claire que les électrons étaient le facteur le plus important pour maintenir les atomes ensemble lorsque les molécules se forment.
Malgré ces succès, il y a aussi des difficultés à trouver dans les théories de Lewis, en particulier pour les éléments au-delà du calcium dans le tableau périodique. L’élément Br (Z = 35), par exemple, possède 17 électrons de plus que le gaz noble Ar (Z = 18). Cela nous amène à conclure que Br possède 17 électrons de valence, ce qui rend maladroite l’explication de la ressemblance de Br avec Cl et F alors que ces deux atomes ne possèdent que sept électrons de valence.
| Élément | Poids atomique | Hydrogène. Composés | Composés de l’oxygène | Composés du chlore |
|---|---|---|---|---|
| Hydrogène | 1.01 | H2 | H2O, H2O2 | HCl |
| Hélium | 4.00 | Non formé | Non formé | Non formé |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Béryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Bore | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbone | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Azote | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygène | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Néon | 20.18 | Non formé | Non formé | Non formé |
| Sodium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnésium | 24.31 | MgH2 | MgO | MgCl2 |
| Aluminium | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silicium | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Phosphore | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Soufre | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlore | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potassium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | Non formé | Non formé | Non formé |
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relativement instable | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chrome | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributeurs
-
Ed Vitz (Université de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Université du Minnesota Rochester), Tim Wendorff et Adam Hahn.