Le principe Aufbau
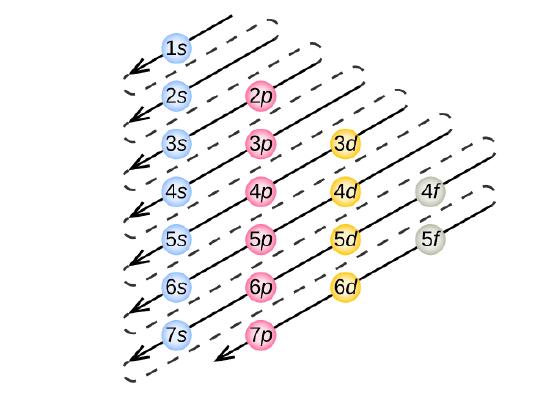
Pour déterminer la configuration électronique de tout atome particulier, nous pouvons « construire » les structures dans l’ordre des numéros atomiques. En commençant par l’hydrogène, et en continuant à travers les périodes du tableau périodique, nous ajoutons un proton à la fois au noyau et un électron à la sous-coquille appropriée jusqu’à ce que nous ayons décrit les configurations électroniques de tous les éléments. Cette procédure est appelée le principe Aufbau, du mot allemand Aufbau (« construire »). Chaque électron ajouté occupe la sous-coquille de plus basse énergie disponible (dans l’ordre indiqué sur la figure \(\PageIndex{3}\)), sous réserve des limitations imposées par les nombres quantiques autorisés selon le principe d’exclusion de Pauli. Les électrons ne pénètrent dans les sous-enveloppes d’énergie supérieure qu’une fois que les sous-enveloppes d’énergie inférieure ont été remplies à pleine capacité. La figure \(\PageIndex{3}\) illustre la manière traditionnelle de se souvenir de l’ordre de remplissage des orbitales atomiques.
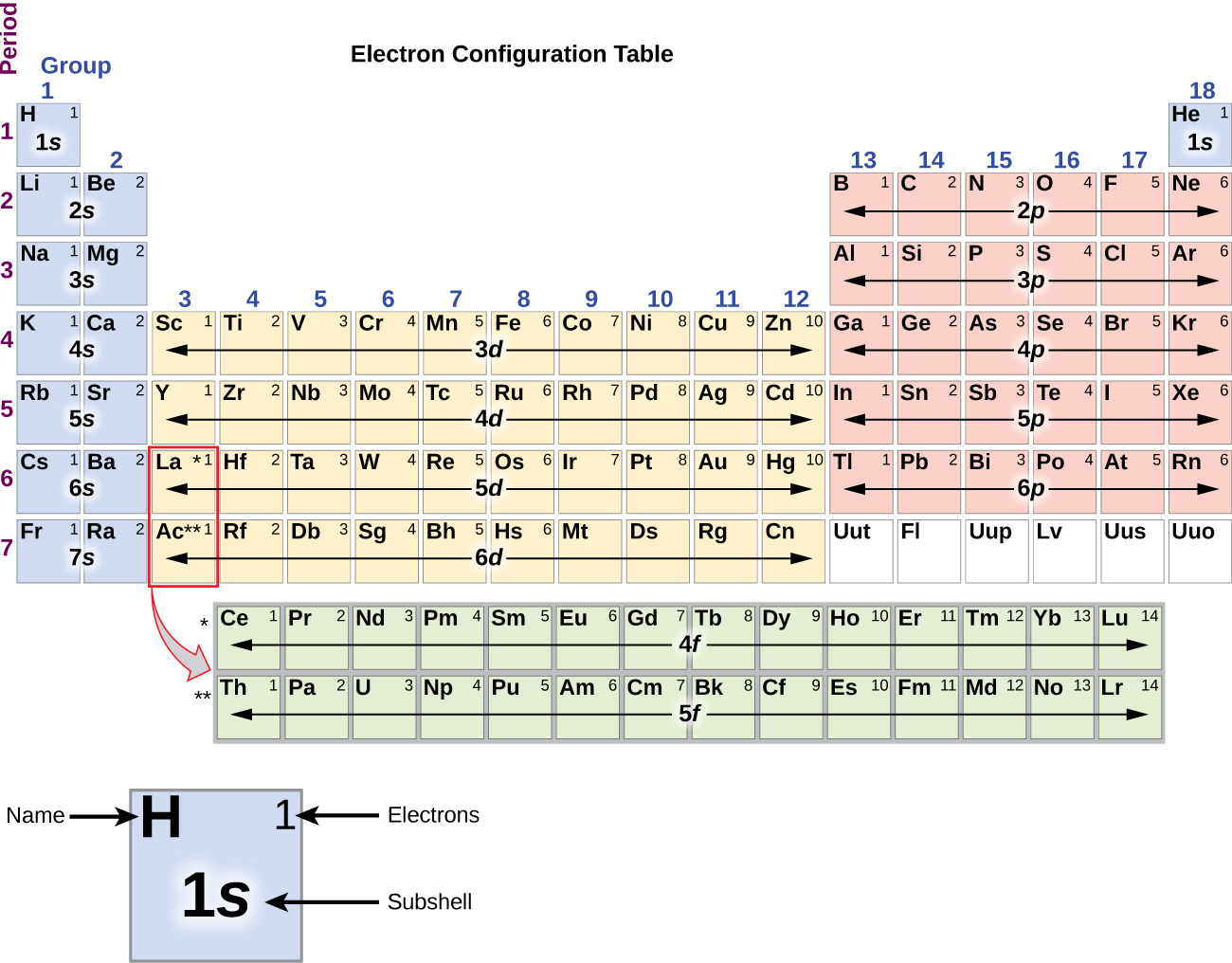
Puisque la disposition du tableau périodique est basée sur les configurations électroniques, la figure \(\PageIndex{4}\) fournit une méthode alternative pour déterminer la configuration électronique. L’ordre de remplissage commence simplement à l’hydrogène et inclut chaque sous-coquille au fur et à mesure que vous avancez dans l’ordre Z croissant. Par exemple, après avoir rempli le bloc 3p jusqu’à Ar, nous voyons que l’orbitale sera 4s (K, Ca), suivie des orbitales 3d.
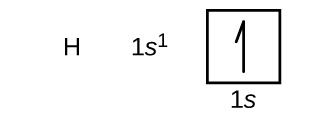
Nous allons maintenant construire la configuration électronique de l’état fondamental et le diagramme orbital pour une sélection d’atomes dans les première et deuxième périodes du tableau périodique. Les diagrammes orbitaux sont des représentations picturales de la configuration électronique, montrant les orbitales individuelles et la disposition des électrons par paires. Nous commençons par un seul atome d’hydrogène (numéro atomique 1), composé d’un proton et d’un électron. Si l’on se réfère à la figure \(\PageIndex{3}\) ou \(\PageIndex{4}\), on s’attend à trouver l’électron dans l’orbitale 1s. Par convention, la valeur \(m_s=+\dfrac{1}{2}\) est généralement renseignée en premier. La configuration électronique et le diagramme orbital sont :
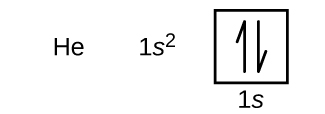
Après l’hydrogène, on trouve l’hélium, un gaz noble dont le numéro atomique est 2. L’atome d’hélium contient deux protons et deux électrons. Le premier électron possède les quatre mêmes nombres quantiques que l’électron de l’atome d’hydrogène (n = 1, l = 0, ml = 0, \(m_s=+\dfrac{1}{2}\)). Le deuxième électron va également dans l’orbitale 1s et remplit cette orbitale. Le deuxième électron a les mêmes nombres quantiques n, l et ml, mais doit avoir le nombre quantique de spin opposé, \(m_s=-\dfrac{1}{2}\). Ceci est en accord avec le principe d’exclusion de Pauli : deux électrons d’un même atome ne peuvent pas avoir le même ensemble de quatre nombres quantiques. Pour les diagrammes orbitaux, cela signifie que deux flèches vont dans chaque case (représentant deux électrons dans chaque orbitale) et que les flèches doivent pointer dans des directions opposées (représentant des spins appariés). La configuration électronique et le diagramme orbital de l’hélium sont :
La coquille n = 1 est complètement remplie dans un atome d’hélium.
L’atome suivant est le métal alcalin lithium avec un numéro atomique de 3. Les deux premiers électrons du lithium remplissent l’orbitale 1s et ont les mêmes ensembles de quatre nombres quantiques que les deux électrons de l’hélium. L’électron restant doit occuper l’orbitale immédiatement inférieure en énergie, l’orbitale 2s (figure \(\PageIndex{3}\) ou \(\PageIndex{4}\)). Ainsi, la configuration électronique et le diagramme orbital du lithium sont :
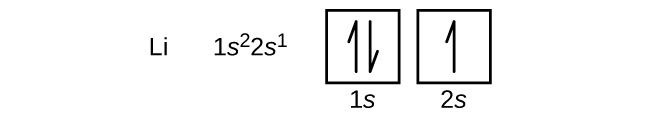
Un atome du métal alcalino-terreux béryllium, de numéro atomique 4, contient quatre protons dans le noyau et quatre électrons entourant le noyau. Le quatrième électron remplit l’espace restant dans l’orbitale 2s.
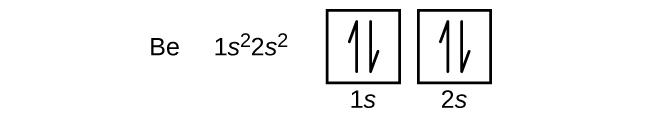
Un atome de bore (numéro atomique 5) contient cinq électrons. La coquille n = 1 est remplie de deux électrons et trois électrons occuperont la coquille n = 2. Comme toute sous-coquille s ne peut contenir que deux électrons, le cinquième électron doit occuper le niveau d’énergie suivant, qui sera une orbitale 2p. Il existe trois orbitales 2p dégénérées (ml = -1, 0, +1) et l’électron peut occuper l’une quelconque de ces orbitales p. Lorsque nous dessinons des diagrammes d’orbitales, nous incluons des cases vides pour représenter toute orbitale vide dans la même sous-coquille que celle que nous remplissons.
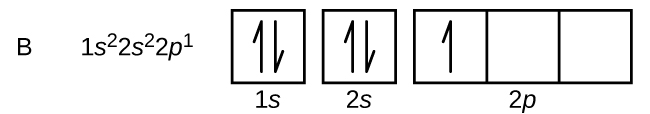
Le carbone (numéro atomique 6) possède six électrons. Quatre d’entre eux remplissent les orbitales 1s et 2s. Les deux électrons restants occupent la sous-coquille 2p. Nous avons maintenant le choix entre remplir l’une des orbitales 2p et apparier les électrons ou laisser les électrons non appariés dans deux orbitales p différentes, mais dégénérées. Les orbitales sont remplies comme décrit par la règle de Hund : la configuration la plus basse en énergie pour un atome avec des électrons dans un ensemble d’orbitales dégénérées est celle ayant le nombre maximum d’électrons non appariés. Ainsi, les deux électrons des orbitales 2p du carbone ont des nombres quantiques n, l et ms identiques et diffèrent par leur nombre quantique ml (conformément au principe d’exclusion de Pauli). La configuration électronique et le diagramme orbital du carbone sont :
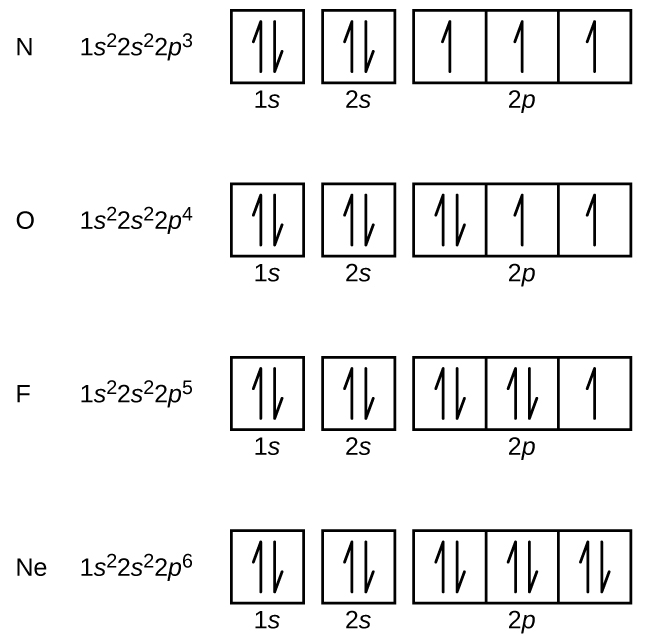
L’azote (numéro atomique 7) remplit les sous-coquilles 1s et 2s et possède un électron dans chacune des trois orbitales 2p, conformément à la règle de Hund. Ces trois électrons ont des spins non appariés. L’oxygène (numéro atomique 8) possède une paire d’électrons dans l’une des orbitales 2p (les électrons ont des spins opposés) et un électron unique dans chacune des deux autres. Le fluor (numéro atomique 9) possède une seule orbitale 2p contenant un électron non apparié. Tous les électrons du gaz noble néon (numéro atomique 10) sont appariés, et toutes les orbitales des coquilles n = 1 et n = 2 sont remplies. Les configurations électroniques et les diagrammes orbitaux de ces quatre éléments sont:
Le métal alcalin sodium (numéro atomique 11) possède un électron de plus que l’atome de néon. Cet électron doit aller dans la sous-coquille la plus basse en énergie disponible, l’orbitale 3s, ce qui donne une configuration 1s22s22p63s1. Les électrons qui occupent la ou les orbitales les plus extérieures de la coquille (valeur la plus élevée de n) sont appelés électrons de valence, et ceux qui occupent les orbitales intérieures de la coquille sont appelés électrons de noyau ( Figure \PageIndex5\PageIndex5). Comme les orbites des électrons de noyau correspondent aux configurations électroniques des gaz rares, nous pouvons abréger les configurations électroniques en écrivant le gaz rare qui correspond à la configuration électronique du noyau, ainsi que les électrons de valence dans un format condensé. Pour notre exemple du sodium, le symbole représente les électrons de noyau, (1s22s22p6) et notre configuration abrégée ou condensée est 3s1.

De même, la configuration abrégée du lithium peut être représentée par 2s1, où représente la configuration de l’atome d’hélium, identique à celle de la coquille interne remplie du lithium. Le fait d’écrire les configurations de cette manière souligne la similitude des configurations du lithium et du sodium. Les deux atomes, qui font partie de la famille des métaux alcalins, n’ont qu’un seul électron dans une sous-coquille s de valence en dehors d’un ensemble de coquilles internes remplies.
\\N{Na:}\,3s^1\\]
Le magnésium, métal alcalino-terreux (numéro atomique 12), avec ses 12 électrons dans une configuration 3s2, est analogue au membre de sa famille, le béryllium, 2s2. Les deux atomes ont une sous-coquille s remplie à l’extérieur de leur coquille interne remplie. L’aluminium (numéro atomique 13), avec 13 électrons et la configuration électronique 3s23p1, est analogue au membre de sa famille qu’est le bore, 2s22p1.
Les configurations électroniques du silicium (14 électrons), du phosphore (15 électrons), du soufre (16 électrons), du chlore (17 électrons) et de l’argon (18 électrons) sont analogues, dans les configurations électroniques de leurs coquilles extérieures, à celles des membres de leur famille correspondants, le carbone, l’azote, l’oxygène, le fluor et le néon, respectivement, sauf que le nombre quantique principal de la coquille extérieure des éléments les plus lourds a augmenté d’une unité pour atteindre n = 3. La figure \(\PageIndex{6}\) montre la configuration électronique la plus basse en énergie, ou état fondamental, pour ces éléments ainsi que celle des atomes de chacun des éléments connus.
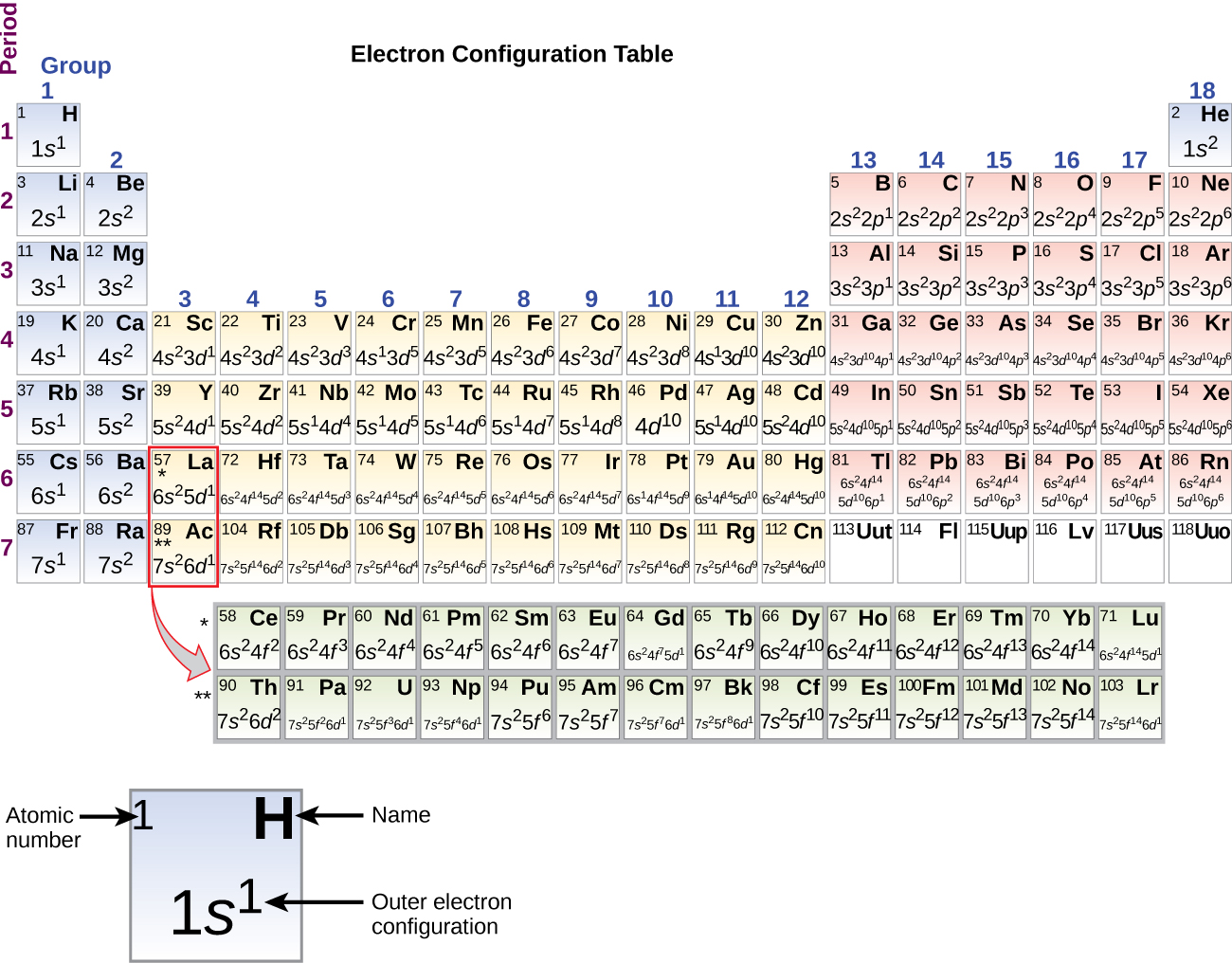
Lorsque nous arrivons à l’élément suivant du tableau périodique, le métal alcalin potassium (numéro atomique 19), nous pourrions nous attendre à ce que nous commencions à ajouter des électrons à la sous-coquille 3d. Cependant, toutes les preuves chimiques et physiques disponibles indiquent que le potassium est comme le lithium et le sodium, et que l’électron suivant n’est pas ajouté au niveau 3d mais plutôt au niveau 4s (Figure \(\PageIndex{3}\) ou \(\PageIndex{4}\)). Comme nous l’avons vu précédemment, l’orbitale 3d sans nœud radial est plus énergétique car elle est moins pénétrante et plus protégée du noyau que l’orbitale 4s, qui possède trois nœuds radiaux. Ainsi, le potassium a une configuration électronique de 4s1. Par conséquent, le potassium correspond à Li et à Na dans la configuration de sa coquille de valence. L’électron suivant est ajouté pour compléter la sous-coquille 4s et le calcium a une configuration électronique de 4s2. Cela donne au calcium une configuration électronique de coquille externe correspondant à celle du béryllium et du magnésium.
En commençant par le métal de transition scandium (numéro atomique 21), des électrons supplémentaires sont ajoutés successivement à la sous-coquille 3d. Cette sous-coquille est remplie jusqu’à sa capacité avec 10 électrons (rappelez-vous que pour l = 2 , il y a 2l + 1 = 5 valeurs de ml, ce qui signifie qu’il y a cinq orbitales d qui ont une capacité combinée de 10 électrons). La sous-coquille 4p se remplit ensuite. Notez que pour trois séries d’éléments, du scandium (Sc) au cuivre (Cu), de l’yttrium (Y) à l’argent (Ag), et du lutécium (Lu) à l’or (Au), un total de 10 électrons d sont successivement ajoutés à l’orbite (n – 1) à côté de l’orbite n pour porter cette orbite (n – 1) de 8 à 18 électrons. Pour deux séries, du lanthane (La) au lutécium (Lu) et de l’actinium (Ac) au lawrencium (Lr), 14 électrons f (l = 3, 2l + 1 = 7 valeurs ml ; donc sept orbitales d’une capacité combinée de 14 électrons) sont successivement ajoutés à la coquille (n – 2) pour porter cette coquille de 18 électrons à un total de 32 électrons.
Exemple \(\PageIndex{1}\) : Nombres quantiques et configurations électroniques
Quelle est la configuration électronique et le diagramme orbital d’un atome de phosphore ? Quels sont les quatre nombres quantiques pour le dernier électron ajouté ?
Solution
Le numéro atomique du phosphore est 15. Ainsi, un atome de phosphore contient 15 électrons. L’ordre de remplissage des niveaux d’énergie est 1s, 2s, 2p, 3s, 3p, 4s, … . Les 15 électrons de l’atome de phosphore vont se remplir jusqu’à l’orbitale 3p, qui contiendra trois électrons :
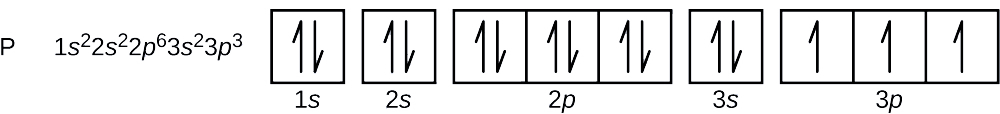
Le dernier électron ajouté est un électron 3p. Par conséquent, n = 3 et, pour une orbitale de type p, l = 1. La valeur de ml pourrait être -1, 0 ou +1. Les trois orbitales p sont dégénérées, donc n’importe laquelle de ces valeurs ml est correcte. Pour les électrons non appariés, la convention attribue la valeur de \(+\dfrac{1}{2}\) pour le nombre quantique de spin ; ainsi, \(m_s=+\dfrac{1}{2}\).
Exercice \(\PageIndex{1}\)
Identifiez les atomes à partir des configurations électroniques données :
- 4s23d5
- 5s24d105p6
Réponse a
Mn
Réponse b
Xe
Le tableau périodique peut être un outil puissant pour prédire la configuration électronique d’un élément. Cependant, nous trouvons des exceptions à l’ordre de remplissage des orbitales qui sont présentées dans la figure \(\PageIndex{3}\) ou \(\PageIndex{4}\). Par exemple, les configurations électroniques des métaux de transition chrome (Cr ; numéro atomique 24) et cuivre (Cu ; numéro atomique 29), entre autres, ne sont pas celles auxquelles on pourrait s’attendre. En général, ces exceptions impliquent des sous-coquilles avec une énergie très similaire, et de petits effets peuvent conduire à des changements dans l’ordre de remplissage.
Dans le cas de Cr et Cu, nous constatons que les sous-coquilles à moitié remplies et complètement remplies représentent apparemment des conditions de stabilité préférentielle. Cette stabilité est telle qu’un électron se déplace de l’orbitale 4s vers l’orbitale 3d pour gagner la stabilité supplémentaire d’une sous-coquille 3d à moitié remplie (dans Cr) ou d’une sous-coquille 3d remplie (dans Cu). D’autres exceptions existent également. Par exemple, le niobium (Nb, numéro atomique 41) est censé avoir la configuration électronique 5s24d3. Expérimentalement, nous observons que sa configuration électronique à l’état fondamental est en fait 5s14d4. Nous pouvons rationaliser cette observation en disant que les répulsions électron-électron subies par l’appariement des électrons dans l’orbitale 5s sont plus importantes que l’écart d’énergie entre les orbitales 5s et 4d. Il n’existe pas de méthode simple pour prédire les exceptions pour les atomes où l’ampleur des répulsions entre électrons est plus grande que les petites différences d’énergie entre les sous-coquilles.