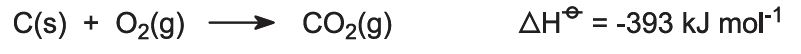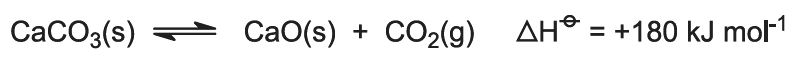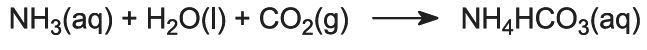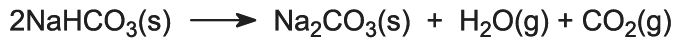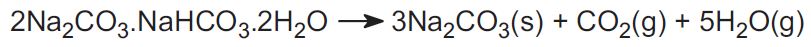- Utilisations du carbonate de sodium
- Production annuelle de carbonate de sodium
- Fabrication de carbonate de sodium
- (a) A partir de chlorure de sodium et de carbonate de calcium
- (1) Ammoniation de la saumure
- (2) Formation d’oxyde de calcium et de dioxyde de carbone
- (3) La tour Solvay
- (4) Séparation de l’hydrocarbonate de sodium solide
- (5) Formation de carbonate de sodium
- (6) Formation d’hydroxyde de calcium
- (7) Régénération de l’ammoniac
- (b) À partir de minerais de trona et de nahcolite
Utilisations du carbonate de sodium
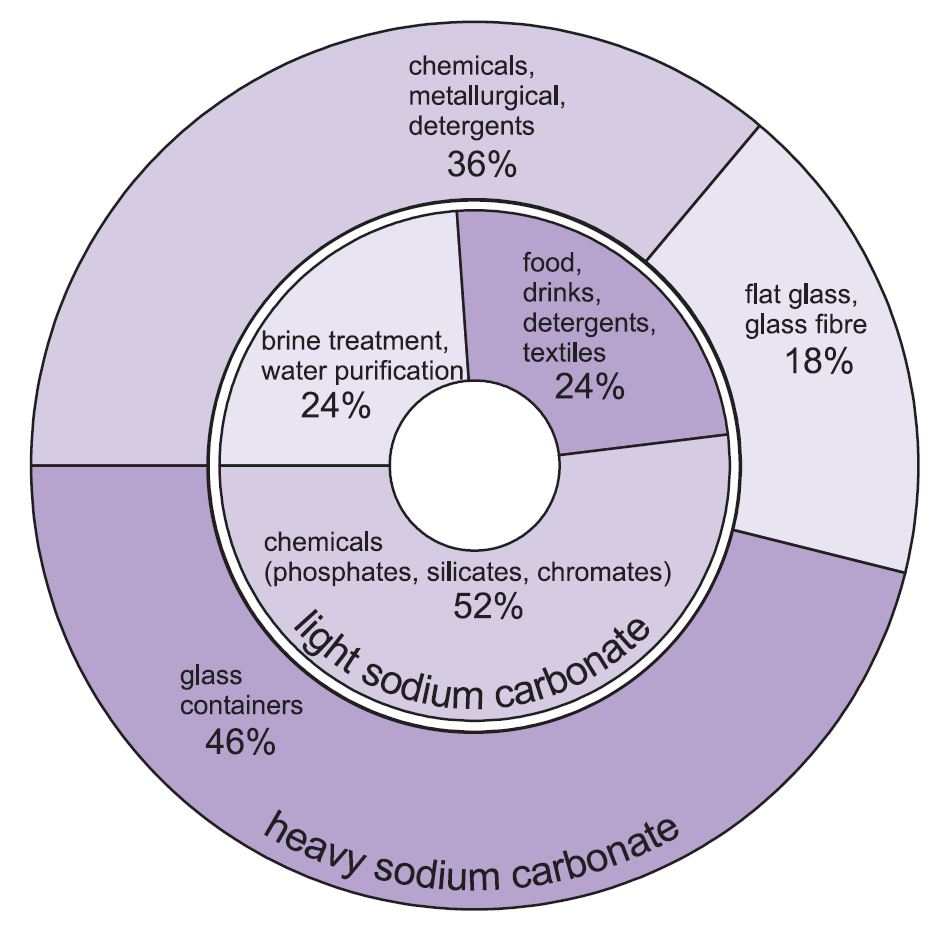
Deux formes de carbonate de sodium (carbonate de soude) sont utilisées -lourde et légère. La forme légère est obtenue en premier et une partie est ensuite transformée en forme lourde. Le carbonate de sodium léger contient moins de 0,5 % de chlorure de sodium. Le carbonate de sodium lourd est obtenu en hydratant le carbonate de sodium léger jusqu’au monohydrate (Na2CO3.H2O), puis en le déshydratant pour obtenir un produit dont la taille des cristaux et la densité sont accrues.
Les deux qualités ont des utilisations différentes.
Les principales utilisations du carbonate de sodium lourd sont sous forme solide, notamment dans la fabrication du verre, où il est utilisé comme flux dans la fusion de la silice (sable).
Les utilisations du carbonate de sodium léger sont traditionnellement où le produit chimique est requis en solution.
Figure 1 Utilisations du carbonate de sodium lourd et léger.
Au total, environ 50% de la production totale de carbonate de sodium est utilisée pour fabriquer du verre, 18% pour fabriquer d’autres produits chimiques et 10% dans les savons et les détergents.
Production annuelle de carbonate de sodium
La Chine est le plus grand producteur mondial de carbonate de sodium, représentant 46% de la production mondiale et les États-Unis 23%. (IHS Markit, 2015)
| Monde | 52 millions de tonnes1,2 |
| Chine | 25 millions de tonnes3 |
| États-Unis. | 12 millions de tonnes1 |
| Europe | 11 millions de tonnes |
| Russie | 0.71 millions de tonnes4 |
Données provenant :
1. 2018 Elements of the Business of Chemistry, American Chemistry Council.
2. Sur ce total, 14,7 tonnes sont extraites. La grande majorité est extraite aux États-Unis (11,7 millions de tonnes) et en Turquie (2 millions de tonnes). Le reste est fabriqué à partir de chlorure de sodium et de carbonate de calcium.
3. IHS Markit, 2015
4. Service fédéral des statistiques d’État : Fédération de Russie 2011
Fabrication de carbonate de sodium
Il existe deux sources principales de carbonate de sodium :
a) à partir de sel et de carbonate de calcium (par le procédé de la soude à l’ammoniac (Solvay))
b) à partir de minerais de carbonate de sodium et d’hydrogénocarbonate (trona et nahcolite)
(a) A partir de chlorure de sodium et de carbonate de calcium
La réaction globale peut être considérée comme celle entre le carbonate de calcium et le chlorure de sodium :
Cependant, le carbonate de calcium est trop insoluble pour réagir avec une solution de sel. Au lieu de cela, le produit est obtenu par une série de sept étapes.
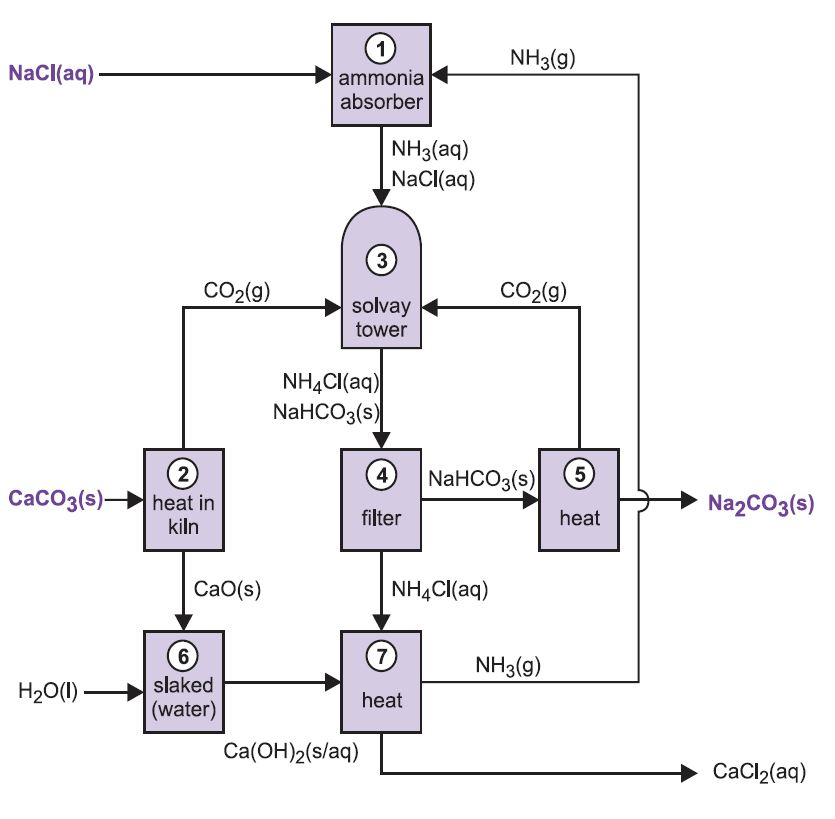
Le procédé est connu sous le nom de procédé ammoniaque-soude ou procédé Solvay, du nom du chimiste industriel belge qui l’a breveté en 186I.
Les différentes étapes du procédé Solvay sont liées entre elles, comme le montrent le schéma et la description ci-dessous.
Figure 2 Différentes étapes du procédé Solvay.
(1) Ammoniation de la saumure
Le gaz ammoniac est absorbé dans une saumure concentrée pour donner une solution contenant à la fois du chlorure de sodium et de l’ammoniac. Des ions Na+(aq), Cl-(aq), NH4+(aq), OH-(aq) et NH3(aq) sont présents.
(2) Formation d’oxyde de calcium et de dioxyde de carbone
Des fours sont alimentés par un mélange calcaire/coke (13:1 en masse). Le coke brûle dans un contre-courant d’air préchauffé:
La chaleur de combustion élève la température du four et le calcaire se décompose:
Le gaz, contenant environ 40% de dioxyde de carbone, est débarrassé de la poussière de chaux et envoyé dans les tours de carbonatation (Solvay). Le résidu, l’oxyde de calcium, est utilisé pour la récupération de l’ammoniac (voir l’étape 7 ci-dessous).
(3) La tour Solvay
C’est l’étape clé du procédé. La saumure ammoniacale de l’étape (1) est descendue dans la tour Solvay tandis que le dioxyde de carbone des étapes (2) et (5) y est remonté. La tour Solvay est haute et contient un ensemble de chicanes en forme de champignon qui ralentissent et brisent l’écoulement du liquide afin que le dioxyde de carbone puisse être absorbé efficacement par la solution. Le dioxyde de carbone, en se dissolvant, réagit avec l’ammoniac dissous pour former de l’hydrogénocarbonate d’ammonium :
La solution contient maintenant des ions Na+(aq), Cl-(aq), NH4+(aq) et HCO3-(aq). Parmi les quatre substances qui pourraient être formées par différentes combinaisons de ces ions, l’hydrogénocarbonate de sodium (NaHCO3) est la moins soluble. Il précipite sous forme solide dans la partie inférieure de la tour, qui est refroidie. Le procédé net est le suivant :
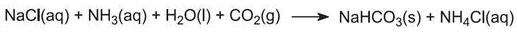
Une suspension d’hydrogénocarbonate de sodium solide dans une solution de chlorure d’ammonium s’écoule de la base de la tour.
(4) Séparation de l’hydrocarbonate de sodium solide
La suspension est filtrée pour séparer l’hydrogénocarbonate de sodium solide de la solution de chlorure d’ammonium, qui est ensuite utilisée dans l’étape (7).
(5) Formation de carbonate de sodium
L’hydrogénocarbonate de sodium est chauffé dans des fours rotatifs à 450 K de sorte qu’il se décompose en carbonate de sodium, en eau et en dioxyde de carbone :
Le dioxyde de carbone est renvoyé à la tour Solvay pour être utilisé dans l’étape (3). Le produit du procédé, le carbonate de sodium anhydre, est obtenu sous forme d’une fine poudre blanche appelée carbonate de sodium léger.
(6) Formation d’hydroxyde de calcium
Les deux dernières étapes, (6) et (7), concernent la régénération de l’ammoniac à partir du chlorure d’ammonium (réalisé à l’étape 3). La chaux vive de l’étape (2) est éteinte avec un excès d’eau donnant du lait de chaux :
(7) Régénération de l’ammoniac
Cette suspension d’hydroxyde de calcium est mélangée avec la solution de chlorure d’ammonium restante de l’étape (4) et chauffée :
L’ammoniac est ainsi récupéré, et renvoyé à l’étape (1). Le chlorure de calcium est le seul sous-produit de l’ensemble du procédé.
Le procédé global est élégant. En théorie, les seules matières premières sont le calcaire et la saumure. Inévitablement, il y a des pertes d’ammoniac, et celles-ci sont compensées par l’ajout de fournitures supplémentaires, comme requis dans l’étape (1).
(b) À partir de minerais de trona et de nahcolite
Le procédé Solvay n’est pas utilisé aux États-Unis. Au lieu de cela, l’industrie utilise deux minerais et cela représente environ 30% de la production mondiale. Le premier est le trona, que l’on trouve en grandes quantités dans le Wyoming. Le trona a la formule:
Le minerai est extrait sous forme solide et chauffé pour chasser le dioxyde de carbone, pour donner du carbonate de sodium:
L’autre minerai est la nahcolite qui est de l’hydrogénocarbonate de sodium. En chauffant, il forme du carbonate de sodium.