Lewis usava semplici diagrammi (ora chiamati diagrammi di Lewis) per tenere traccia di quanti elettroni erano presenti nel guscio più esterno, o valenza, di un dato atomo. Il nucleo dell’atomo, cioè il nucleo insieme agli elettroni interni, è rappresentato dal simbolo chimico, e solo gli elettroni di valenza sono disegnati come punti che circondano il simbolo chimico. Così i tre atomi mostrati nella Figura 1 di Elettroni e Valenza possono essere rappresentati dai seguenti diagrammi di Lewis:
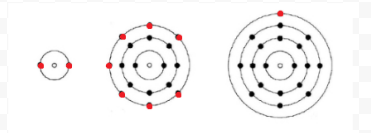

Se l’atomo è un atomo di gas nobile, sono possibili due procedure alternative. O possiamo considerare l’atomo con zero elettroni di valenza o possiamo considerare il guscio più esterno riempito come il guscio di valenza. I primi tre gas nobili possono quindi essere scritti come:
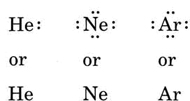
Esempio \(\PageIndex{1}): Strutture di Lewis
Disegna i diagrammi di Lewis per un atomo di ciascuno dei seguenti elementi: Li, N, F, Na
Soluzione
Dalla tavola periodica all’interno della copertina troviamo che il Li ha un numero atomico di 3. Contiene quindi tre elettroni, uno in più del gas nobile He. Questo significa che il guscio più esterno, o di valenza, contiene un solo elettrone, e il diagramma di Lewis è
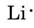
Seguendo lo stesso ragionamento, N ha sette elettroni, cinque in più di He, mentre F ha nove elettroni, sette in più di He, dando
![]()
Na ha nove elettroni in più di He, ma otto di essi sono nel nucleo, corrispondenti agli otto elettroni nel guscio più esterno di Ne. Poiché Na ha solo 1 elettrone in più di Ne, il suo diagramma di Lewis è
![]()
Nota dall’esempio precedente che i diagrammi di Lewis dei metalli alcalini sono identici tranne che per i loro simboli chimici. Questo concorda bene con il comportamento chimico molto simile dei metalli alcalini. Allo stesso modo, i diagrammi di Lewis per tutti gli elementi di altri gruppi, come le terre alcaline o gli alogeni, hanno lo stesso aspetto.
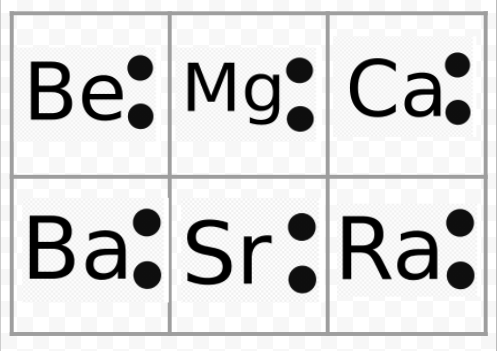
I diagrammi di Lewis possono anche essere usati per predire le valenze degli elementi. Lewis suggerì che il numero di valenze di un atomo era uguale al numero di elettroni nel suo guscio di valenza o al numero di elettroni che avrebbero dovuto essere aggiunti al guscio di valenza per ottenere la struttura del guscio elettronico del gas nobile successivo. Come esempio di questa idea, consideriamo gli elementi Be e O. I loro diagrammi di Lewis e quelli dei gas nobili He e Ne sono

Confrontando Be con He, vediamo che il primo ha due elettroni in più e quindi dovrebbe avere una valenza di 2. L’elemento O potrebbe avere una valenza di 6 o una valenza di 2 poiché ha sei elettroni di valenza – due in meno di Ne. Usando le regole di valenza sviluppate in questo modo, Lewis fu in grado di spiegare l’aumento e la diminuzione regolare dei pedici dei composti nella tabella trovata nella sezione Valenza, e qui riprodotta. Inoltre è stato in grado di rendere conto di più del 50% delle formule nella tabella. (Quelli che sono d’accordo con le sue idee sono ombreggiati in colore nella tabella. Potete fare riferimento a quella tabella ora e verificare che alcune delle formule indicate seguono le regole di Lewis). Il successo di Lewis a questo proposito diede una chiara indicazione che gli elettroni erano il fattore più importante nel tenere insieme gli atomi quando si formavano le molecole.
Nonostante questi successi, ci sono anche difficoltà da trovare nelle teorie di Lewis, in particolare per gli elementi oltre il calcio nella tavola periodica. L’elemento Br (Z = 35), per esempio, ha 17 elettroni in più del gas nobile Ar (Z = 18). Questo ci porta a concludere che Br ha 17 elettroni di valenza, il che rende imbarazzante spiegare perché Br assomiglia così tanto a Cl e F anche se questi due atomi hanno solo sette elettroni di valenza.
| Elemento | Peso atomico | Idrogeno Composti | Composti dell’ossigeno | Composti del cloro |
|---|---|---|---|---|
| Idrogeno | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | Nessuno formato | Nessuno formato | Nessuno formato |
| Litio | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbonio | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogeno | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Ossigeno | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluoro | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Nessuno formato | Nessuno formato | Nessuno formato |
| Sodio | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesio | 24.31 | MgH2 | MgO | MgCl2 |
| Alluminio | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silicio | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Fosforo | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Zolfo | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Cloro | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potassio | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | Nessuno formato | Nessuno formato | Nessuno formato |
| Calcio | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relativamente instabile | Sc2O3 | ScCl3 |
| Titanio | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadio | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Cromo | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributori
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, e Adam Hahn.