Il principio di Aufbau
Per determinare la configurazione elettronica di ogni particolare atomo, possiamo “costruire” le strutture in ordine di numero atomico. Iniziando con l’idrogeno, e continuando attraverso i periodi della tavola periodica, aggiungiamo un protone alla volta al nucleo e un elettrone al sottoguscio appropriato fino a quando abbiamo descritto le configurazioni elettroniche di tutti gli elementi. Questa procedura è chiamata principio dell’Aufbau, dalla parola tedesca Aufbau (“costruire”). Ogni elettrone aggiunto occupa il sottoguscio di più bassa energia disponibile (nell’ordine mostrato nella figura \(\PageIndex{3})), soggetto alle limitazioni imposte dai numeri quantici ammessi secondo il principio di esclusione di Pauli. Gli elettroni entrano nei sottogusci a più alta energia solo dopo che i sottogusci a più bassa energia sono stati riempiti completamente. La figura \(\PageIndex{3}) illustra il modo tradizionale di ricordare l’ordine di riempimento degli orbitali atomici.
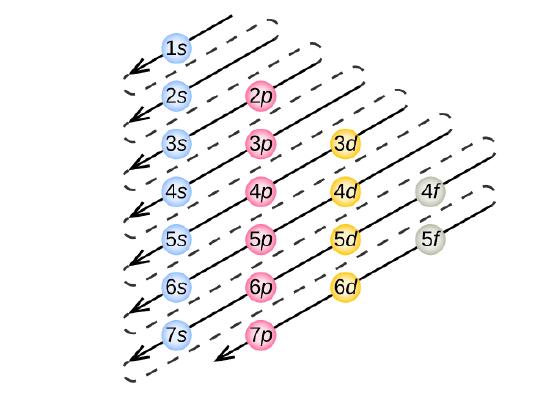
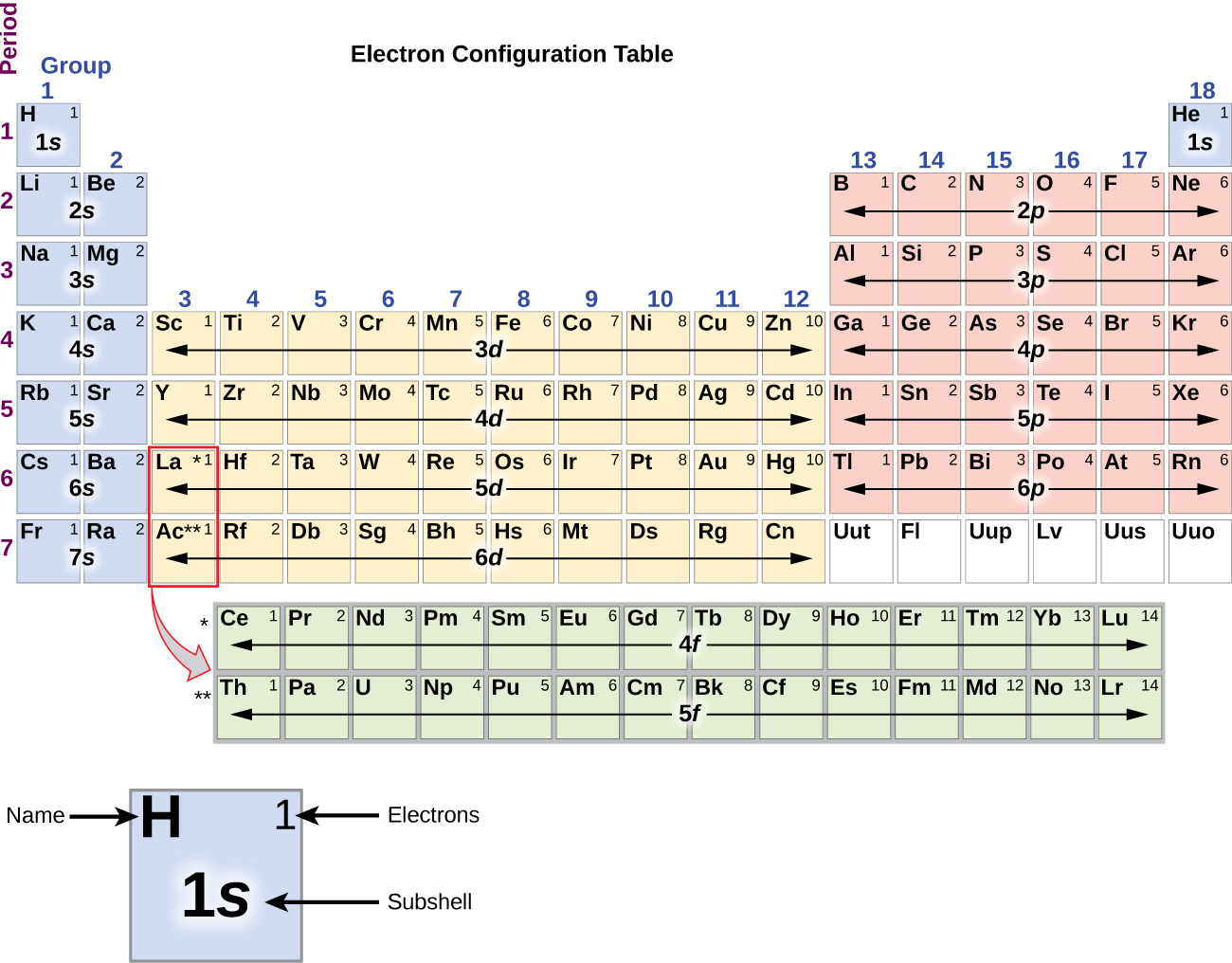
Siccome la disposizione della tavola periodica è basata sulle configurazioni degli elettroni, la figura \(\PageIndex{4}\ fornisce un metodo alternativo per determinare la configurazione degli elettroni. L’ordine di riempimento inizia semplicemente dall’idrogeno e include ogni sottoguscio man mano che si procede in ordine Z crescente. Per esempio, dopo aver riempito il blocco 3p fino ad Ar, vediamo che l’orbitale sarà 4s (K, Ca), seguito dagli orbitali 3d.
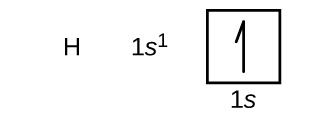
Costruiremo ora la configurazione degli elettroni e il diagramma orbitale dello stato fondamentale per una selezione di atomi nel primo e secondo periodo della tavola periodica. I diagrammi orbitali sono rappresentazioni pittoriche della configurazione elettronica, che mostrano i singoli orbitali e la disposizione di coppia degli elettroni. Iniziamo con un singolo atomo di idrogeno (numero atomico 1), che consiste di un protone e un elettrone. Facendo riferimento alla figura \(\PageIndex{3}) o \(\PageIndex{4}), ci aspettiamo di trovare l’elettrone nell’orbitale 1s. Per convenzione, il valore di \(m_s=+dfrac{1}{2}}) viene solitamente riempito per primo. La configurazione elettronica e il diagramma orbitale sono:
Dopo l’idrogeno c’è il gas nobile elio, che ha un numero atomico di 2. L’atomo di elio contiene due protoni e due elettroni. Il primo elettrone ha gli stessi quattro numeri quantici dell’elettrone dell’atomo di idrogeno (n = 1, l = 0, ml = 0, \(m_s=+\dfrac{1}{2}\)). Anche il secondo elettrone va nell’orbitale 1s e riempie quell’orbitale. Il secondo elettrone ha gli stessi numeri quantici n, l e ml, ma deve avere il numero quantico di spin opposto, \(m_s=-dfrac{1}{2}). Questo è in accordo con il principio di esclusione di Pauli: due elettroni nello stesso atomo non possono avere lo stesso insieme di quattro numeri quantici. Per i diagrammi orbitali, questo significa che due frecce vanno in ogni casella (rappresentando due elettroni in ogni orbitale) e le frecce devono puntare in direzioni opposte (rappresentando spin accoppiati). La configurazione elettronica e il diagramma orbitale dell’elio sono:
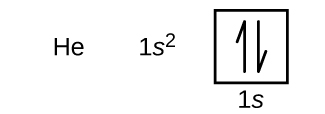
Il guscio n = 1 è completamente riempito in un atomo di elio.
Il prossimo atomo è il litio, metallo alcalino con un numero atomico di 3. I primi due elettroni nel litio riempiono l’orbitale 1s e hanno gli stessi set di quattro numeri quantici dei due elettroni nell’elio. L’elettrone rimanente deve occupare l’orbitale di energia immediatamente inferiore, l’orbitale 2s (Figura \PageIndex{3} o \PageIndex{4}). Così, la configurazione elettronica e il diagramma degli orbitali del litio sono:
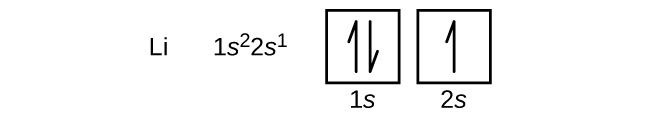
Un atomo del berillio, metallo alcalino-terroso, con un numero atomico di 4, contiene quattro protoni nel nucleo e quattro elettroni che circondano il nucleo. Il quarto elettrone riempie lo spazio rimanente nell’orbitale 2s.
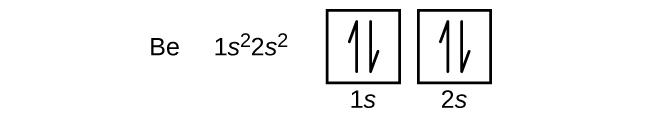
Un atomo di boro (numero atomico 5) contiene cinque elettroni. Il guscio n = 1 è riempito con due elettroni e tre elettroni occuperanno il guscio n = 2. Poiché ogni sottoguscio s può contenere solo due elettroni, il quinto elettrone deve occupare il livello energetico successivo, che sarà un orbitale 2p. Ci sono tre orbitali 2p degeneri (ml = -1, 0, +1) e l’elettrone può occupare uno qualsiasi di questi orbitali p. Quando disegniamo i diagrammi degli orbitali, includiamo caselle vuote per rappresentare qualsiasi orbitale vuoto nello stesso sottoguscio che stiamo riempiendo.
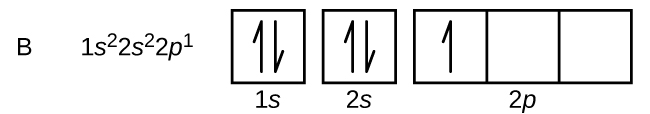
Il carbonio (numero atomico 6) ha sei elettroni. Quattro di essi riempiono gli orbitali 1s e 2s. I due elettroni rimanenti occupano il sottoguscio 2p. Ora abbiamo la scelta di riempire uno degli orbitali 2p e accoppiare gli elettroni o di lasciare gli elettroni non accoppiati in due orbitali p diversi, ma degenerati. Gli orbitali vengono riempiti come descritto dalla regola di Hund: la configurazione a più bassa energia per un atomo con elettroni all’interno di un insieme di orbitali degenerati è quella che ha il massimo numero di elettroni spaiati. Così, i due elettroni negli orbitali 2p del carbonio hanno identici numeri quantici n, l e ms e differiscono nel loro numero quantico ml (in accordo con il principio di esclusione di Pauli). La configurazione elettronica e il diagramma orbitale del carbonio sono:
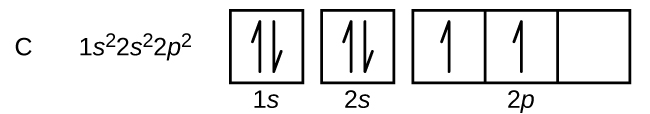
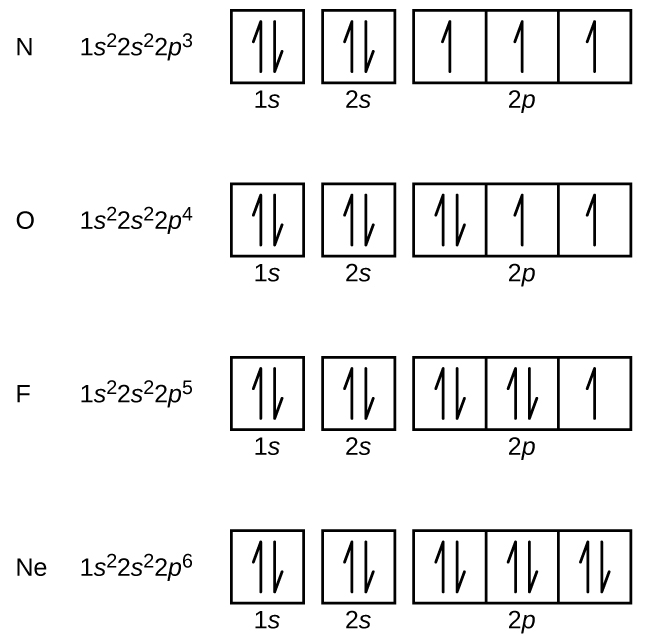
L’azoto (numero atomico 7) riempie i sottogusci 1s e 2s e ha un elettrone in ognuno dei tre orbitali 2p, in accordo con la regola di Hund. Questi tre elettroni hanno spin non accoppiati. L’ossigeno (numero atomico 8) ha una coppia di elettroni in uno qualsiasi degli orbitali 2p (gli elettroni hanno spin opposti) e un singolo elettrone in ciascuno degli altri due. Il fluoro (numero atomico 9) ha solo un orbitale 2p che contiene un elettrone spaiato. Tutti gli elettroni nel gas nobile neon (numero atomico 10) sono accoppiati, e tutti gli orbitali nei gusci n = 1 e n = 2 sono pieni. Le configurazioni elettroniche e i diagrammi orbitali di questi quattro elementi sono:
Il sodio metallo alcalino (numero atomico 11) ha un elettrone in più dell’atomo di neon. Questo elettrone deve andare nel sottoguscio a più bassa energia disponibile, l’orbitale 3s, dando una configurazione 1s22s22p63s1. Gli elettroni che occupano gli orbitali del guscio più esterno (il valore più alto di n) sono chiamati elettroni di valenza, e quelli che occupano gli orbitali del guscio interno sono chiamati elettroni del nucleo (Figura \PageIndex5\PageIndex5). Dato che i gusci degli elettroni del nucleo corrispondono alle configurazioni degli elettroni dei gas nobili, possiamo abbreviare le configurazioni degli elettroni scrivendo il gas nobile che corrisponde alla configurazione degli elettroni del nucleo, insieme agli elettroni di valenza in un formato condensato. Per il nostro esempio del sodio, il simbolo rappresenta gli elettroni del nucleo, (1s22s22p6) e la nostra configurazione abbreviata o condensata è 3s1.

Similmente, la configurazione abbreviata del litio può essere rappresentata come 2s1, dove rappresenta la configurazione dell’atomo di elio, che è identica a quella dello strato interno pieno del litio. Scrivere le configurazioni in questo modo sottolinea la somiglianza delle configurazioni del litio e del sodio. Entrambi gli atomi, che sono nella famiglia dei metalli alcalini, hanno solo un elettrone in un sottoguscio di valenza s al di fuori di un insieme di gusci interni riempiti.
{{Na:},2s^1}{Na:},3s^1\]
Il magnesio, metallo alcalino terrestre (numero atomico 12), con i suoi 12 elettroni in una configurazione 3s2, è analogo al suo membro della famiglia berillio, 2s2. Entrambi gli atomi hanno un sottoguscio s pieno fuori dai loro gusci interni pieni. L’alluminio (numero atomico 13), con 13 elettroni e la configurazione elettronica 3s23p1, è analogo al suo familiare boro, 2s22p1.
Le configurazioni elettroniche di silicio (14 elettroni), fosforo (15 elettroni), zolfo (16 elettroni), cloro (17 elettroni), e argon (18 elettroni) sono analoghe nelle configurazioni elettroniche dei loro gusci esterni ai loro corrispondenti membri familiari carbonio, azoto, ossigeno, fluoro e neon, rispettivamente, tranne che il numero quantico principale del guscio esterno degli elementi più pesanti è aumentato di uno a n = 3. La figura \(\PageIndex{6}) mostra la configurazione degli elettroni a più bassa energia, o stato fondamentale, per questi elementi e quella per gli atomi di ciascuno degli elementi conosciuti.
Quando arriviamo al prossimo elemento della tavola periodica, il potassio, metallo alcalino (numero atomico 19), potremmo aspettarci che si comincino ad aggiungere elettroni al sottoguscio 3d. Tuttavia, tutte le prove chimiche e fisiche disponibili indicano che il potassio è come il litio e il sodio, e che l’elettrone successivo non è aggiunto al livello 3d ma è, invece, aggiunto al livello 4s (Figura \PageIndex{3} o \PageIndex{4}). Come discusso in precedenza, l’orbitale 3d senza nodi radiali è più alto in energia perché è meno penetrante e più schermato dal nucleo rispetto al 4s, che ha tre nodi radiali. Così, il potassio ha una configurazione elettronica di 4s1. Quindi, il potassio corrisponde a Li e Na nella sua configurazione del guscio di valenza. Il prossimo elettrone viene aggiunto per completare il sottoguscio 4s e il calcio ha una configurazione elettronica di 4s2. Questo dà al calcio una configurazione elettronica del guscio esterno corrispondente a quella del berillio e del magnesio.
A partire dal metallo di transizione scandio (numero atomico 21), vengono aggiunti successivamente altri elettroni al sottoguscio 3d. Questo sottoguscio è riempito fino alla sua capacità con 10 elettroni (ricordate che per l = 2, ci sono 2l + 1 = 5 valori di ml, il che significa che ci sono cinque orbitali d che hanno una capacità combinata di 10 elettroni). Il sottoguscio 4p si riempie dopo. Si noti che per tre serie di elementi, scandio (Sc) attraverso rame (Cu), ittrio (Y) attraverso argento (Ag), e lutezio (Lu) attraverso oro (Au), un totale di 10 elettroni d sono successivamente aggiunti al guscio (n – 1) accanto al guscio n per portare quel guscio (n – 1) da 8 a 18 elettroni. Per due serie, il lantanio (La) attraverso il lutezio (Lu) e l’attinio (Ac) attraverso il laurenzio (Lr), 14 elettroni f (l = 3, 2l + 1 = 7 valori ml; quindi, sette orbitali con una capacità combinata di 14 elettroni) sono aggiunti successivamente al guscio (n – 2) per portare quel guscio da 18 elettroni a un totale di 32 elettroni.
Esempio \(\PageIndex{1}}): Numeri quantici e configurazioni degli elettroni
Qual è la configurazione elettronica e il diagramma degli orbitali per un atomo di fosforo? Quali sono i quattro numeri quantici per l’ultimo elettrone aggiunto?
Soluzione
Il numero atomico del fosforo è 15. Così, un atomo di fosforo contiene 15 elettroni. L’ordine di riempimento dei livelli di energia è 1s, 2s, 2p, 3s, 3p, 4s, . . . I 15 elettroni dell’atomo di fosforo si riempiranno fino all’orbitale 3p, che conterrà tre elettroni:
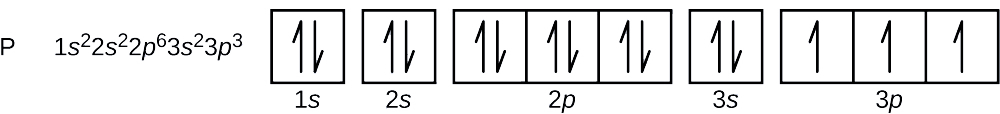
L’ultimo elettrone aggiunto è un elettrone 3p. Pertanto, n = 3 e, per un orbitale di tipo p, l = 1. Il valore ml potrebbe essere -1, 0 o +1. I tre orbitali p sono degenerati, quindi uno qualsiasi di questi valori ml è corretto. Per gli elettroni spaiati, la convenzione assegna il valore di \(+dfrac{1}{2}) per il numero quantico di spin; quindi, \(m_s=+dfrac{1}{2}).
Esercizio \(\PageIndex{1})
Identifica gli atomi dalle configurazioni elettroniche date:
- 4s23d5
- 5s24d105p6
Risposta a
Mn
Risposta b
Xe
La tavola periodica può essere un potente strumento per prevedere la configurazione elettronica di un elemento. Tuttavia, troviamo delle eccezioni all’ordine di riempimento degli orbitali che sono mostrati nella figura \(\PageIndex{3}) o \(\PageIndex{4}). Per esempio, le configurazioni elettroniche dei metalli di transizione cromo (Cr; numero atomico 24) e rame (Cu; numero atomico 29), tra gli altri, non sono quelle che ci aspetteremmo. In generale, tali eccezioni coinvolgono sottogusci con energia molto simile, e piccoli effetti possono portare a cambiamenti nell’ordine di riempimento.
Nel caso del Cr e del Cu, troviamo che i sottogusci riempiti per metà e completamente rappresentano apparentemente condizioni di stabilità preferita. Questa stabilità è tale che un elettrone si sposta dal 4s all’orbitale 3d per guadagnare la stabilità extra di un sottoguscio 3d mezzo pieno (in Cr) o di un sottoguscio 3d pieno (in Cu). Ci sono anche altre eccezioni. Per esempio, il niobio (Nb, numero atomico 41) è previsto avere la configurazione elettronica 5s24d3. Sperimentalmente, osserviamo che la sua configurazione elettronica di stato terra è in realtà 5s14d4. Possiamo razionalizzare questa osservazione dicendo che le repulsioni elettrone-elettrone sperimentate dall’accoppiamento degli elettroni nell’orbitale 5s sono più grandi del divario di energia tra gli orbitali 5s e 4d. Non esiste un metodo semplice per prevedere le eccezioni per gli atomi in cui la grandezza delle repulsioni tra gli elettroni è maggiore delle piccole differenze di energia tra i sottogruppi.