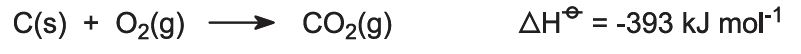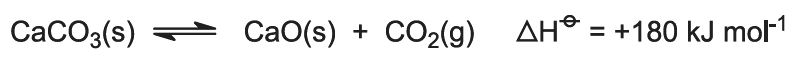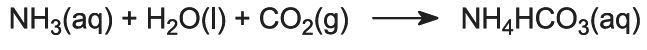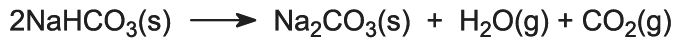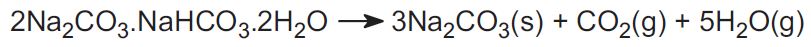- Usi del carbonato di sodio
- Produzione annuale di carbonato di sodio
- Produzione di carbonato di sodio
- (a) Da cloruro di sodio e carbonato di calcio
- (1) Ammonizzazione della salamoia
- (2) Formazione di ossido di calcio e anidride carbonica
- (3) La torre Solvay
- (4) Separazione dell’idrocarbonato di sodio solido
- (5) Formazione di carbonato di sodio
- (6) Formazione di idrossido di calcio
- (7) Rigenerazione dell’ammoniaca
- (b) Da minerali di trona e nahcolite
Usi del carbonato di sodio
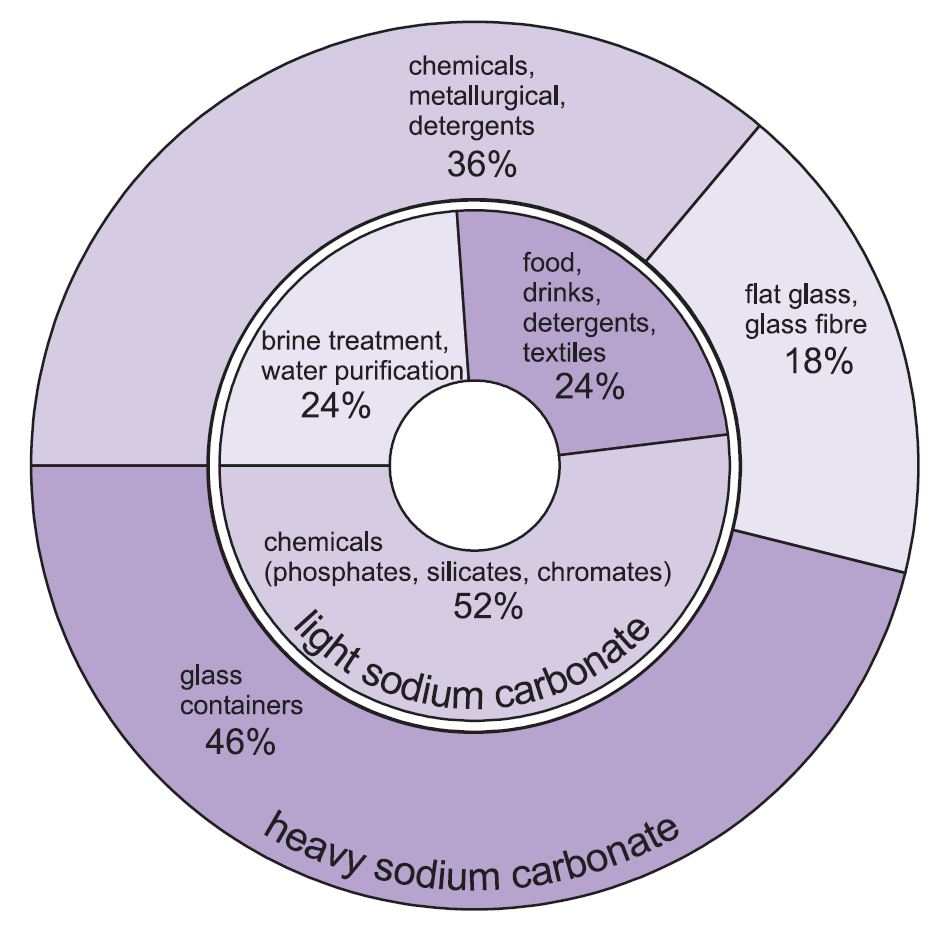
Sono usate due forme di carbonato di sodio (soda) – pesante e leggero. La forma leggera si ottiene prima e una parte viene poi convertita nella forma pesante. Il carbonato di sodio leggero contiene meno dello 0,5% di cloruro di sodio. Il carbonato di sodio pesante si ottiene idratando il carbonato di sodio leggero fino al monoidrato (Na2CO3.H2O) e poi disidratandolo per ottenere un prodotto con una dimensione dei cristalli e una densità maggiori.
I due tipi hanno usi diversi.
I principali usi del carbonato di sodio pesante sono come solido, in particolare nella fabbricazione del vetro, dove viene utilizzato come flusso nella fusione della silice (sabbia).
Gli usi del carbonato di sodio leggero sono tradizionalmente dove il prodotto chimico è richiesto in soluzione.
Figura 1 Usi del carbonato di sodio pesante e leggero.
In totale, circa il 50% della produzione totale di carbonato di sodio è usato per fare vetro, il 18% per fare altri prodotti chimici e il 10% in saponi e detergenti.
Produzione annuale di carbonato di sodio
La Cina è il maggior produttore mondiale di carbonato di sodio, rappresentando il 46% della produzione mondiale e gli Stati Uniti il 23%. (IHS Markit, 2015)
| Mondo | 52 milioni di tonnellate1,2 |
| Cina | 25 milioni di tonnellate3 |
| USA. | 12 milioni di tonnellate1 |
| Europa | 11 milioni di tonnellate |
| Russia | 0.71 milioni di tonnellate4 |
Dati tratti da:
1. 2018 Elements of the Business of Chemistry, American Chemistry Council.
2. Di queste, 14,7 tonnellate sono estratte. La grande maggioranza è estratta negli Stati Uniti (11,7 milioni di tonnellate) e in Turchia (2 milioni di tonnellate). Il resto è ricavato dal cloruro di sodio e dal carbonato di calcio.
3. IHS Markit, 2015
4. Federal State Statistics Service: Federazione Russa 2011
Produzione di carbonato di sodio
Ci sono due fonti principali di carbonato di sodio:
a) da sale e carbonato di calcio (attraverso il processo di soda ammoniacale (Solvay))
b) da carbonato di sodio e minerali di idrogenocarbonato (trona e nahcolite)
(a) Da cloruro di sodio e carbonato di calcio
La reazione complessiva può essere considerata come tra carbonato di calcio e cloruro di sodio:
Tuttavia, il carbonato di calcio è troppo insolubile per reagire con una soluzione di sale. Invece il prodotto è ottenuto da una serie di sette fasi.
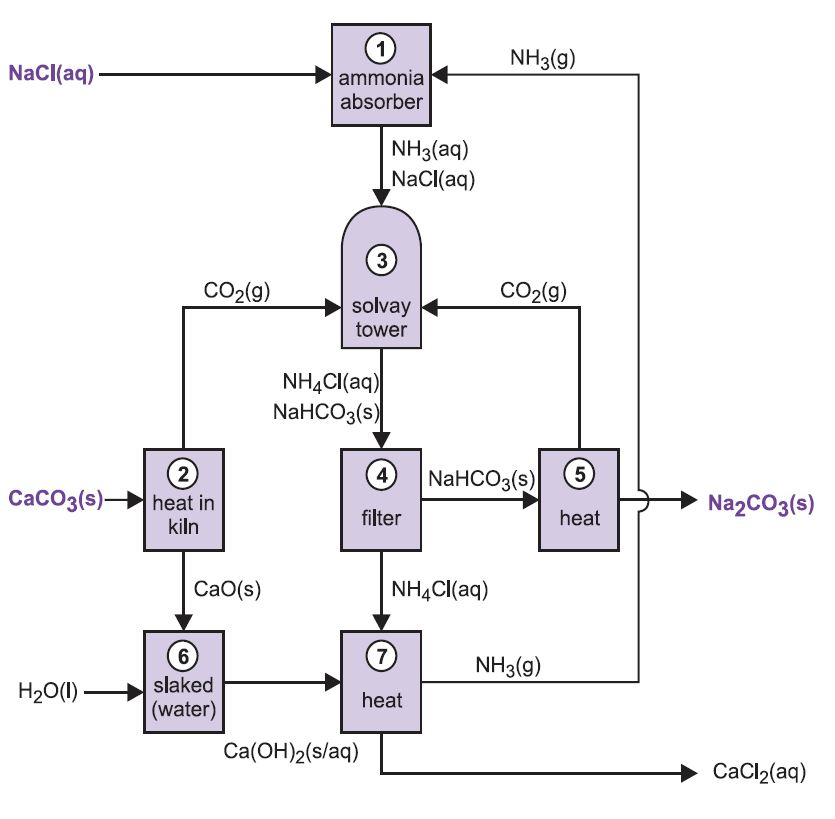
Il processo è conosciuto come il processo ammoniaca-soda o il processo Solvay, dal nome del chimico industriale belga che lo brevettò nel 186I.
Le varie fasi del processo Solvay sono collegate tra loro come si può vedere dal diagramma e dalla descrizione qui sotto.
Figura 2 Diverse fasi del processo Solvay.
(1) Ammonizzazione della salamoia
Il gas ammoniaca viene assorbito nella salamoia concentrata per dare una soluzione contenente sia cloruro di sodio che ammoniaca. Sono presenti Na+(aq), Cl-(aq), NH4+(aq), ioni OH-(aq) e NH3(aq).
(2) Formazione di ossido di calcio e anidride carbonica
I forni sono alimentati con una miscela di calcare/coke (13:1 in massa). Il coke brucia in una contro-corrente di aria preriscaldata:
Il calore della combustione aumenta la temperatura del forno e il calcare si decompone:
Il gas, contenente circa il 40% di anidride carbonica, viene liberato dalla polvere di calcare e inviato alle torri di carbonatazione (Solvay). Il residuo, l’ossido di calcio, è usato nel recupero dell’ammoniaca (vedi passo 7 sotto).
(3) La torre Solvay
Questa è la fase chiave del processo. La salamoia ammoniacata della fase (1) viene fatta passare attraverso la Torre Solvay mentre l’anidride carbonica delle fasi (2) e (5) viene fatta salire. La torre Solvay è alta e contiene una serie di deflettori a forma di fungo per rallentare e spezzare il flusso del liquido in modo che l’anidride carbonica possa essere assorbita efficacemente dalla soluzione. L’anidride carbonica, dissolvendosi, reagisce con l’ammoniaca dissolta per formare idrogenocarbonato di ammonio:
La soluzione ora contiene ioni Na+(aq), Cl-(aq), NH4+(aq) e HCO3-(aq). Delle quattro sostanze che potrebbero essere formate da diverse combinazioni di questi ioni, l’idrogenocarbonato di sodio (NaHCO3) è il meno solubile. Precipita come solido nella parte inferiore della torre, che viene raffreddata. Il processo netto è:
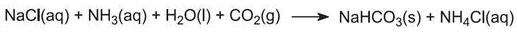
Una sospensione di idrogenocarbonato di sodio solido in una soluzione di cloruro di ammonio viene fatta uscire dalla base della torre.
(4) Separazione dell’idrocarbonato di sodio solido
La sospensione viene filtrata per separare l’idrogenocarbonato di sodio solido dalla soluzione di cloruro di ammonio, che viene poi usata nella fase (7).
(5) Formazione di carbonato di sodio
L’idrogenocarbonato di sodio viene riscaldato in forni rotanti a 450 K in modo che si decomponga in carbonato di sodio, acqua e anidride carbonica:
L’anidride carbonica viene rimandata alla Torre Solvay per essere usata nella fase (3). Il prodotto del processo, carbonato di sodio anidro, è ottenuto come una polvere bianca fine conosciuta come carbonato di sodio leggero.
(6) Formazione di idrossido di calcio
Le ultime due fasi, (6) e (7), riguardano la rigenerazione dell’ammoniaca dal cloruro di ammonio (fatto nella fase 3). La calce viva della fase (2) è schiacciata con acqua in eccesso per ottenere latte di calce:
(7) Rigenerazione dell’ammoniaca
Questa sospensione di idrossido di calcio è mescolata con la soluzione di cloruro di ammonio rimasta dalla fase (4) e riscaldata:
L’ammoniaca è così recuperata, e rimandata alla fase (1). Il cloruro di calcio è l’unico sottoprodotto dell’intero processo.
Il processo complessivo è elegante. In teoria, le uniche materie prime sono il calcare e la salamoia. Inevitabilmente, ci sono perdite di ammoniaca, e queste sono compensate dall’aggiunta di forniture extra, come richiesto nella fase (1).
(b) Da minerali di trona e nahcolite
Il processo Solvay non è usato negli USA. Invece, l’industria usa due minerali e questo rappresenta circa il 30% della produzione mondiale. Uno è il trona, che si trova in grandi quantità nel Wyoming. Trona ha la formula:
Il minerale viene estratto come solido e riscaldato per cacciare l’anidride carbonica, per produrre carbonato di sodio:
L’altro minerale è la nahcolite che è idrogenocarbonato di sodio. Al riscaldamento si forma il carbonato di sodio.
Il secondo minerale è la nahcolite che è idrogenocarbonato di sodio.