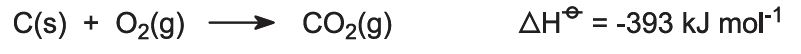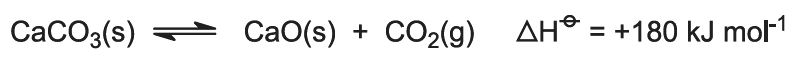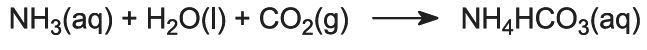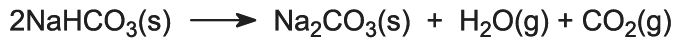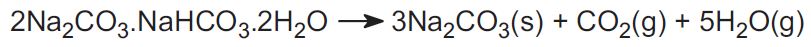- Usos del carbonato de sodio
- Producción anual de carbonato de sodio
- Fabricación de carbonato de sodio
- a) A partir de cloruro de sodio y carbonato de calcio
- (1) Amonificación de la salmuera
- (2) Formación de óxido de calcio y dióxido de carbono
- (3) La torre Solvay
- (4) Separación del hidrocarbonato de sodio sólido
- (5) Formación de carbonato de sodio
- (6) Formación de hidróxido de calcio
- (7) Regeneración del amoníaco
- (b) A partir de minerales de trona y nahcolita
Usos del carbonato de sodio
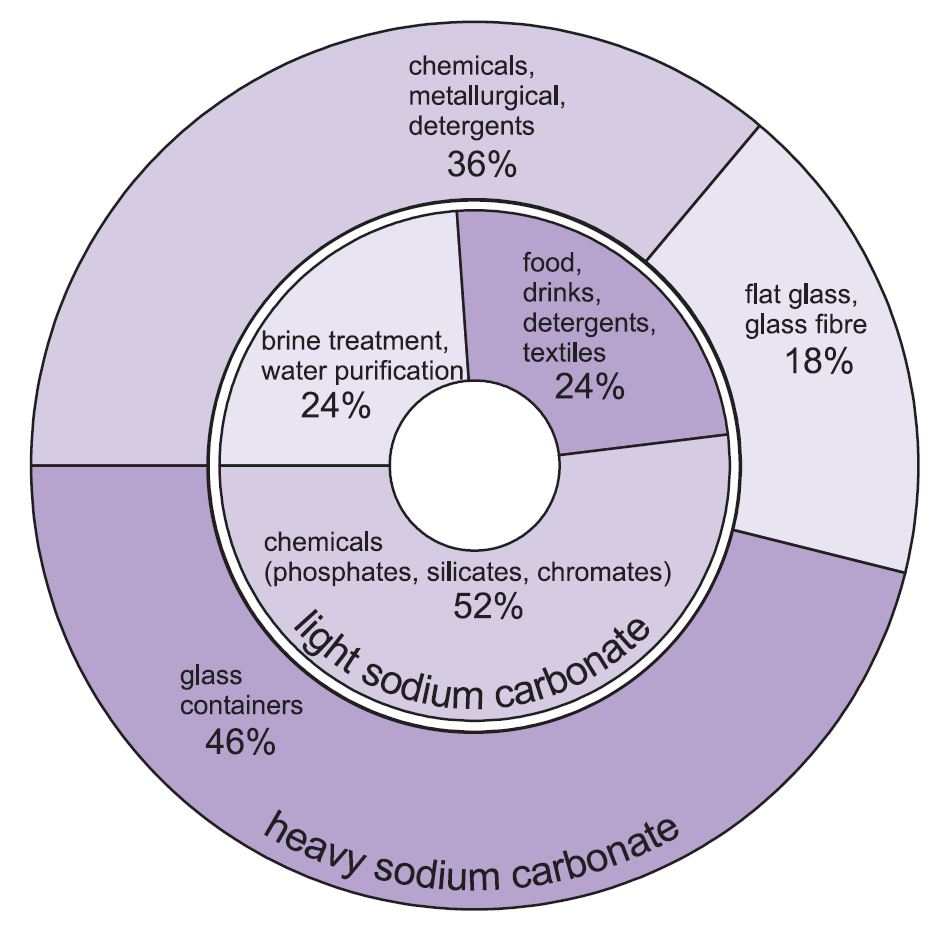
Se utilizan dos formas de carbonato de sodio (ceniza de sosa): la pesada y la ligera. Primero se obtiene la forma ligera y luego se convierte una parte en la forma pesada. El carbonato de sodio ligero contiene menos del 0,5% de cloruro de sodio. El carbonato de sodio pesado se obtiene hidratando el carbonato de sodio ligero hasta convertirlo en monohidrato (Na2CO3.H2O) y deshidratándolo a continuación para obtener un producto con un tamaño de cristal y una densidad mayores.
Los dos grados tienen usos diferentes.
Los principales usos del carbonato de sodio pesado son como sólido, especialmente en la fabricación de vidrio, donde se utiliza como fundente en la fusión de la sílice (arena).
Los usos del carbonato de sodio ligero son tradicionalmente cuando se requiere el producto químico en solución.
Figura 1 Usos del carbonato de sodio pesado y ligero.
En general, alrededor del 50% de la producción total de carbonato de sodio se utiliza para fabricar vidrio, el 18% para fabricar otros productos químicos y el 10% en jabones y detergentes.
Producción anual de carbonato de sodio
China es el mayor productor mundial de carbonato de sodio, representando el 46% de la producción mundial y Estados Unidos el 23%. (IHS Markit, 2015)
| Mundial | 52 millones de toneladas1,2 |
| China | 25 millones de toneladas3 |
| Estados Unidos. | 12 millones de toneladas1 |
| Europa | 11 millones de toneladas |
| Rusia | 0.71 millones de toneladas4 |
Datos de:
1. 2018 Elements of the Business of Chemistry, American Chemistry Council.
2. De ellas, 14,7 toneladas se extraen. La gran mayoría se extrae en Estados Unidos (11,7 millones de toneladas) y Turquía (2 millones de toneladas). El resto se hace a partir de cloruro de sodio y carbonato de calcio.
3. IHS Markit, 2015
4. Servicio Federal de Estadísticas del Estado: Federación Rusa 2011
Fabricación de carbonato de sodio
Hay dos fuentes principales de carbonato de sodio:
a) a partir de sal y carbonato de calcio (mediante el proceso de sosa amoniacal (Solvay))
b) a partir de minerales de carbonato de sodio e hidrogenocarbonato (trona y nahcolita)
a) A partir de cloruro de sodio y carbonato de calcio
La reacción global puede considerarse entre carbonato de calcio y cloruro de sodio:
Sin embargo, el carbonato de calcio es demasiado insoluble para reaccionar con una solución de sal. En su lugar, el producto se obtiene mediante una serie de siete etapas.
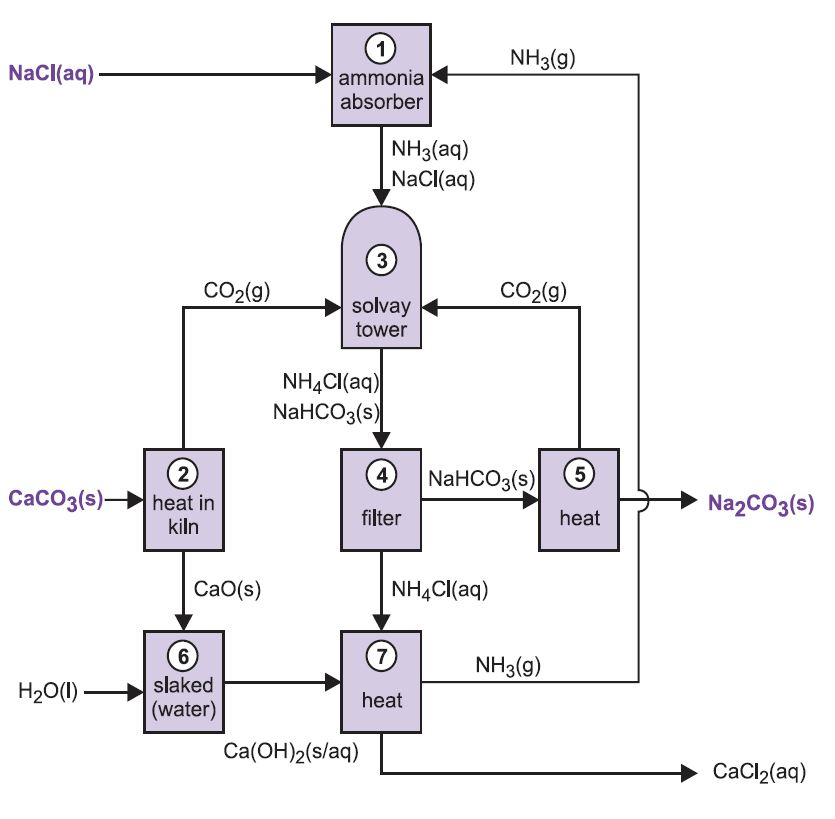
El proceso se conoce como proceso de amoníaco-sosa o proceso Solvay, que recibe el nombre del químico industrial belga que lo patentó en 186I.
Las distintas etapas del proceso Solvay están interrelacionadas, como se puede ver en el diagrama y la descripción siguientes.
Figura 2 Diferentes etapas del proceso Solvay.
(1) Amonificación de la salmuera
El gas amoníaco se absorbe en la salmuera concentrada para dar una solución que contiene cloruro de sodio y amoníaco. Están presentes los iones Na+(aq), Cl-(aq), NH4+(aq), OH-(aq) y NH3(aq).
(2) Formación de óxido de calcio y dióxido de carbono
Se alimentan hornos con una mezcla de piedra caliza/coque (13:1 en masa). El coque arde en una corriente de aire precalentado:
El calor de la combustión eleva la temperatura del horno y la piedra caliza se descompone:
El gas, que contiene aproximadamente un 40% de dióxido de carbono, se libera del polvo de cal y se envía a las torres de carbonatación (Solvay). El residuo, el óxido de calcio, se utiliza en la recuperación del amoníaco (véase el paso 7 más adelante).
(3) La torre Solvay
Esta es la etapa clave del proceso. La salmuera amoniacada de la etapa (1) desciende por la Torre Solvay mientras que el dióxido de carbono de las etapas (2) y (5) asciende por ella. La torre Solvay es alta y contiene un conjunto de deflectores en forma de seta para ralentizar y romper el flujo de líquido de manera que el dióxido de carbono pueda ser absorbido eficazmente por la solución. El dióxido de carbono, al disolverse, reacciona con el amoníaco disuelto para formar hidrogenocarbonato de amonio:
La solución contiene ahora iones Na+(aq), Cl-(aq), NH4+(aq) y HCO3-(aq). De las cuatro sustancias que podrían formarse por diferentes combinaciones de estos iones, el hidrogenocarbonato de sodio (NaHCO3) es el menos soluble. Se precipita como un sólido en la parte inferior de la torre, que se enfría. El proceso neto es:
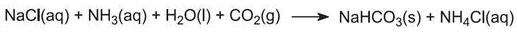
Una suspensión de hidrogenocarbonato de sodio sólido en una solución de cloruro de amonio sale por la base de la torre.
(4) Separación del hidrocarbonato de sodio sólido
La suspensión se filtra para separar el hidrogenocarbonato de sodio sólido de la solución de cloruro de amonio, que se utiliza en la etapa (7).
(5) Formación de carbonato de sodio
El hidrogenocarbonato de sodio se calienta en hornos giratorios a 450 K para que se descomponga en carbonato de sodio, agua y dióxido de carbono:
El dióxido de carbono se envía de nuevo a la Torre Solvay para utilizarlo en la etapa (3). El producto del proceso, el carbonato de sodio anhidro, se obtiene como un polvo blanco fino conocido como carbonato de sodio ligero.
(6) Formación de hidróxido de calcio
Las dos últimas etapas, (6) y (7), se refieren a la regeneración del amoníaco a partir del cloruro de amonio (realizado en la etapa 3). La cal viva de la etapa (2) se apaga con un exceso de agua dando leche de cal:
(7) Regeneración del amoníaco
Esta suspensión de hidróxido de calcio se mezcla con la solución de cloruro de amonio que queda de la etapa (4) y se calienta:
Se recupera así el amoníaco, que se envía de nuevo a la etapa (1). El cloruro de calcio es el único subproducto de todo el proceso.
El proceso global es elegante. En teoría, las únicas materias primas son la piedra caliza y la salmuera. Inevitablemente, hay pérdidas de amoníaco, que se compensan con la adición de suministros adicionales, como se requiere en el paso (1).
(b) A partir de minerales de trona y nahcolita
El proceso Solvay no se utiliza en los Estados Unidos. En su lugar, la industria utiliza dos minerales y esto representa alrededor del 30% de la producción mundial. Uno es la trona, que se encuentra en grandes cantidades en Wyoming. La trona tiene la fórmula:
El mineral se extrae como sólido y se calienta para expulsar el dióxido de carbono, para producir carbonato de sodio:
El otro mineral es la nahcolita, que es hidrogenocarbonato de sodio. Al calentarla se forma carbonato de sodio.