- Introduction
- Metody
- Włączanie i wyłączanie pacjentów
- Standardowe zatwierdzenia protokołu i zgody pacjentów
- Program badania
- Statystyki
- Wyniki
- Frequency of IDNA in RLS Patients
- Clinical Features of RLS Patients With IDNA Compared to NID
- Clinical Features of RLS Patients With IDNA Compared to IDA
- Hematologiczne cechy w kontrolnych obiektach
- Dyskusja
- Cechy kliniczne IDNA w RLS
- Is IDNA an Early Stage Prior to IDA in RLS?
- Accessing and Diagnosing IDNA w RLS
- Wnioski
- Oświadczenie o dostępności danych
- Oświadczenie o etyce
- Author Contributions
- Funding
- Konflikt interesów
- Podziękowania
- Materiały uzupełniające
- Skróty
Introduction
Restless Legs Syndrome (RLS) jest powszechnym zaburzeniem neurologicznym (1), a niedobór żelaza odgrywa kluczową rolę w jego patogenezie (2, 3). Niedobór żelaza jest powszechny w RLS i niedokrwistość z niedoboru żelaza (IDA) jest znaną przyczyną wtórnego RLS (4, 5), który jest związany z sześciokrotnym wzrostem ryzyka dla RLS w populacji ogólnej (6). Niedobór żelaza bez niedokrwistości (IDNA, również nieanemiczny niedobór żelaza) jest zwykle podstępny, a ostatnio przyciąga uwagę ze względu na jego powszechne występowanie na całym świecie oraz wyzwania związane z diagnostyką i postępowaniem (7). Pomimo wyraźnego związku między klinicznym znaczeniem RLS w populacji IDA (6), częstość występowania i cechy IDNA w RLS nie były systematycznie badane. Nie wiadomo, czy IDNA stanowi podgrupę RLS i czy IDNA jest wczesnym etapem poprzedzającym IDA w RLS. W tym badaniu, mamy na celu zbadanie cech klinicznych RLS z IDNA w porównaniu z tymi bez niedoboru żelaza (NID, również non-iron deficiency) i z pacjentami IDA w kolejnej kohorcie chińskich pacjentów z RLS.
Metody
Włączanie i wyłączanie pacjentów
W sposób ciągły rekrutowaliśmy pacjentów z naszej Specjalistycznej Kliniki RLS i Kliniki Zaburzeń Ruchowych w Departamencie Neurologii, Shanghai General Hospital, Shanghai Jiao Tong University School of Medicine między Janem 2017 a Oct 2018. RLS rozpoznano zgodnie z kryteriami diagnostycznymi International Restless Legs Syndrome Study Group (RLSSG) z 2014 roku (1). Pacjenci z innymi zaburzeniami neurologicznymi, słabą współpracą lub zaburzeniami poznawczymi zostali wykluczeni z badania. Dobrane pod względem wieku i płci zdrowe grupy kontrolne bez niedokrwistości zostały zrekrutowane w tym samym okresie w Centrum Badań Zdrowotnych w naszym szpitalu. Kontrole były wolne od chorób neurologicznych, w tym RLS, na podstawie wywiadu twarzą w twarz.
Standardowe zatwierdzenia protokołu i zgody pacjentów
Badanie zostało zatwierdzone przez Shanghai General Hospital Institutional Review Board, a wszyscy pacjenci i zdrowe kontrole włączone do badania wyrazili pisemną zgodę.
Program badania
Pacjenci z RLS byli oceniani tak, jak wcześniej opisaliśmy (8). Krótko mówiąc, przeprowadzaliśmy wywiady z pacjentami twarzą w twarz w naszej przychodni. Pacjenci uznani za pozytywnych dla RLS byli diagnozowani przez dwóch neurologów specjalizujących się w RLS. Zanotowaliśmy informacje demograficzne, historię choroby, objawy, leki, ogólne badania neurologiczne i lekarskie oraz MMSE u wszystkich rekrutowanych pacjentów. Następnie przeprowadzono ocenę za pomocą półstrukturalnego kwestionariusza, który obejmował wiek wystąpienia RLS, historię rodzinną RLS (znajomość zdefiniowana jako „krewni pierwszego stopnia”), rodzaj i topografię doznań oraz czy objawy RLS korelowały ze zmiennością sezonową. Nasilenie RLS przez 1 tydzień przed wywiadem oceniano przy użyciu Międzynarodowej Skali Oceny RLS (IRLSRS) (9). Badania, takie jak ultrasonografia naczyniowa, badanie prędkości przewodzenia nerwów, elektromiografia itp. były wykonywane, jeśli było to wskazane klinicznie, w celu wykluczenia możliwych naśladownictw RLS, takich jak polineuropatie obwodowe, zastój żylny, obrzęki naczyniowe, reumatoidalne zapalenie stawów itp. Wykluczono również osoby z historią leczenia neuroleptykami lub innymi lekami, które autorzy uznali za potencjalnie związane z RLS w ciągu ostatnich trzech miesięcy. Wykluczyliśmy osoby z godnymi uwagi chorobami współistniejącymi, które były związane z wtórnym RLS, takimi jak przewlekła niewydolność nerek, ciąża, choroba Parkinsona, neuropatia obwodowa, udar mózgu i ataksja. Oceniono badania krwi na hemoglobinę i obwodowy status żelaza, w tym ferrytynę w surowicy, żelazo, transferynę i całkowitą zdolność wiązania żelaza (TIBC). Nasycenie transferyny (TSAT) obliczono jako stężenie żelaza w surowicy/TIBC × 100. Prawidłowy poziom hemoglobiny zdefiniowano jako kobiety ≥ 113 g/L i mężczyźni ≥ 131 g/L zgodnie z wartością normalną w naszym szpitalu. IDNA jest definiowane jako ferrytyna w surowicy <75 μg/L (lub ferrytyna ≥ 75 μg/L, ale TSAT <20%) z prawidłowym poziomem hemoglobiny (10, 11). IDA rozpoznaje się, gdy hemoglobina <113 g/L (kobiety) lub <131 g/L (mężczyźni), a także ferrytyna w surowicy <75 μg/L (lub ferrytyna w surowicy ≥ 75 μg/L, ale TSAT <20%).
Statystyki
Dane analizowano przy użyciu programu SPSS 21.0 for Windows (IBM Co., USA). Wszystkie dane przedstawiono jako średnie ± odchylenia standardowe. Ponieważ większość zmiennych nie miała rozkładu normalnego, zastosowano test Kruskala-Wallisa do porównań pojedynczych zmiennych między trzema grupami oraz post-hoc Manna-Whitneya, gdy P < 0,05. Różnice w proporcjach analizowano za pomocą testu chi-squared Pearsona lub dokładnego testu Fishera, gdy było to właściwe. P < 0,05 były uważane za znaczące. Biorąc pod uwagę potencjalny wpływ terapii lekowej na objaw RLS i inne cechy, obliczyliśmy wszystkie dane dwukrotnie w całkowitej grupie pacjentów z RLS i w grupie pacjentów z RLS bez leków, odpowiednio.
Wyniki
W sposób ciągły zapisaliśmy łącznie 196 pierwotnych pacjentów z RLS bez niedokrwistości (IDNA RLS i NID RLS) w tym badaniu, w tym 66 mężczyzn (33,7%) i 130 kobiet (66,3%). Średnia wieku wynosiła 53,0 ± 13,5 roku. 65,8% (129/196) pacjentów z RLS nie przyjmowało leków na RLS (109 pacjentów nie przyjmowało leków, a 20 było wolnych od leków przez ponad 2 tygodnie w momencie przeprowadzania wywiadu). Do badania włączono również 26 pacjentów z RLS z IDA (22 nie przyjmowało leków). Wykluczyliśmy pięciu anemicznych pacjentów z RLS (Hb <113 g/L dla kobiet i Hb <131 g/L dla mężczyzn), którzy nie mieli dowodów na niedobór żelaza (ferrytyna w surowicy ≥ 75 μg/L, jak również TIBC ≥ 20%, średnia ferrytyna w surowicy 236,1 ± 119,3 μg/L). Żaden z pacjentów z RLS z IDA nie miał żadnych objawów infekcji, a przyczyny RLS z IDA zostały wymienione (Tabela 1). Ponadto zebraliśmy 63 zdrowe osoby z grupy kontrolnej, w tym 22 mężczyzn (34,9%) i 41 kobiet (65,1%), a średni wiek grupy kontrolnej wynosił 51,0 ± 12,0 lat (średnia wieku 51,0 ± 10,4 i 51,0 ± 12,8 odpowiednio dla mężczyzn i kobiet). Nie stwierdzono istotnych różnic zarówno pod względem płci (RLS vs. kontrola: 66,3 vs. 65,1% dla kobiet, P > 0,05), jak i wieku (RLS vs. kontrola: 53,0 ± 13,5 vs. 51,0 ± 12,0, P > 0,05) między pacjentami z RLS a grupą kontrolną. Szczegółowe informacje demograficzne pacjentów z RLS w każdej grupie są pokazane (Tabela 2).
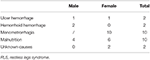
Tabela 1. Możliwe przyczyny niedoboru żelaza u anemicznych pacjentów z RLS.
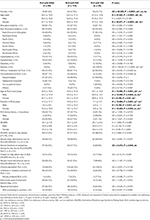
Tabela 2. Informacje demograficzne i kliniczne cechy pacjentów RLS z IDNA, NID, i IDA.
Frequency of IDNA in RLS Patients
Of the 196 RLS pacjentów (130 kobiet, 66 mężczyzn) bez niedokrwistości albo innych comorbidities, 83 (42.3%) miał niedobór żelaza. Częstość występowania IDNA u kobiet (58,5%, 76/130) jest znacznie wyższa niż u mężczyzn (10,6%, 7/66) w tej kohorcie pacjentów z RLS bez niedokrwistości (Tabela 2), z ryzykiem względnym 5,51 (95% przedział ufności 2,70-11,27, p < 0,0001).
Clinical Features of RLS Patients With IDNA Compared to NID
In female RLS patients without anemia, the IDNA group had a younger age both at interview and at RLS onset when compared to the NID group (P < 0.01; Table 2). Chociaż nie było różnicy w ciężkości RLS według IRLSRS, znaleźliśmy więcej pacjentów z ciężkim/bardzo ciężkim zmęczeniem lub sennością w ciągu dnia w grupie IDNA w porównaniu z grupą NID (32,5 vs. 17,7%, P < 0,05; Tabela 2). Nie stwierdzono różnic w zakresie wywiadu rodzinnego, ciężkości, lateralności, lokalizacji i sezonowych fluktuacji RLS między grupą IDNA i NID, ani u mężczyzn, ani u kobiet. Grupa IDNA RLS przedstawiła niższą ferrytynę w surowicy (mężczyźni i kobiety, P < 0,0001), jak również wyższe wartości transferyny i TIBC (kobiety, P < 0,0001) w porównaniu z grupą NID RLS (Figura 1, Tabela 3).
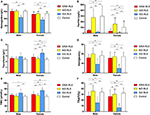
Figura 1. Parametry hematologiczne i żelazowe w zależności od grupy i płci (A) Hemoglobina. (B) Ferrytyna. (C) Transferyna. (D) Żelazo. (E) TIBC. (F) TSAT. **P < 0,01, *P < 0,05, test Kruskala-Wallisa i test post-hoc Manna-Whitneya. Dane porównane między IDNA RLS (n = 83), NID RLS (n = 113), IDA RLS (n = 26) i kontrolami (n = 63). ##P < 0,01, #P < 0,05, test U Manna-Whitneya. Dane porównane między mężczyznami i kobietami w każdej grupie IDNA RLS, NID RLS, IDA RLS i kontroli. Niedobór żelaza był zdefiniowany jako poziom ferrytyny <75 μg/L, lub ferrytyna 75 μg/L, jednak TSAT <20%. IDA, niedokrwistość z niedoboru żelaza; IDNA, niedobór żelaza bez niedokrwistości; NID, zespół niespokojnych nóg; RLS, zespół niespokojnych nóg; TIBC, całkowita zdolność wiązania żelaza; TSAT, nasycenie transferyny.
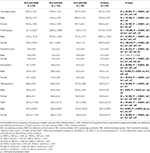
Tabela 3. Dane hematologiczne pacjentów z RLS z IDNA, NID, IDA i grupy kontrolnej.
Po wykluczeniu pacjentów z RLS otrzymujących leki na RLS, grupa IDNA RLS nadal wykazywała wyższe wskaźniki ciężkiego/bardzo ciężkiego zmęczenia/senności w ciągu dnia w porównaniu z grupą NID RLS, chociaż nie na znaczącym poziomie (35 vs. 18,8%, P = 0,078). Inne cechy między IDNA RLS i NID RLS były podobne (Tabela uzupełniająca 1).
Clinical Features of RLS Patients With IDNA Compared to IDA
Grupa IDA miała bardziej poważnie zaburzone parametry metabolizmu żelaza w surowicy niż grupa IDNA, w tym niższą ferrytynę (mężczyzna, P < 0.05; kobieta, P < 0.0001), wyższą transferynę (kobieta, P < 0.0001), niższe żelazo (mężczyzna, P < 0.05; kobieta, P < 0.0001), wyższe TIBC (kobieta, P < 0.0001) i niższe wartości TSAT (mężczyzna, P < 0.05; kobieta, P < 0.0001) w surowicy (Figura 1, Tabela 3). IDNA RLS miał dłuższy czas trwania choroby (P < 0,01 u mężczyzn, P < 0,05 u kobiet) i młodszy wiek w momencie rozpoczęcia (istotny tylko u mężczyzn z P < 0,05) niż IDA RLS. Nie było różnic dotyczących dodatniego wywiadu rodzinnego, ciężkości (IRLSRS), lateralności, lokalizacji i sezonowych fluktuacji RLS między IDNA RLS i IDA RLS, zarówno u mężczyzn, jak i u kobiet chorych na RLS (Tabela 2). Wyniki były podobne po wykluczeniu pacjentów RLS z lekami dla RLS (Uzupełniająca Tabela 1).
Hematologiczne cechy w kontrolnych obiektach
Diagnostyczne kryteria dla niedoboru żelaza są różne między ogólną populacją i pacjentami RLS (jak dyskusja poniżej). Zgodnie z wartością odcięcia naszego szpitala dla niedoboru żelaza w populacji ogólnej (20 μg/L), znaleźliśmy żaden z męskich przedmiotów w grupie kontrolnej miał niedobór żelaza, podczas gdy cztery żeńskie przedmioty kontroli pokazały niedobór żelaza (dwa przedmioty z ferrytyną surowicy <20 μg/L, i dwa przedmioty z ferrytyną ≥ 20 μg/L ale TSAT <20%). Nie stwierdzono istotnej różnicy w częstości występowania niedoboru żelaza w grupie kontrolnej między mężczyznami (0%, 0/22) i kobietami (9,8%, 4/41; P = 0,288). Testy hematologiczne na hemoglobinie i żelaznych parametrach w grupie kontrolnej były najbardziej podobne z grupą NID RLS w porównaniu do grupy IDNA albo IDA (Figura 1, Tabela 3).
Dyskusja
Patofizjologia pierwotnego i wtórnego RLS jest niekompletnie zrozumiana. Mózgowy niedobór żelaza ma fundamentalną rolę w patogenezie RLS i warunki charakteryzujące się systemowym niedoborem żelaza, takie jak niedokrwistość i ciąża, są związane z wyższą prewalencją symptomów RLS (2, 3, 5, 6). IDA jest uznaną chorobą współwystępującą z wtórnym RLS (4-6, 12). IDNA przebiega bardziej podstępnie, a jego cechy są mniej znane u pacjentów z RLS.
Cechy kliniczne IDNA w RLS
Ogólnie rzecz biorąc, kobiety są bardziej podatne na RLS (1, 13, 14). Kobiety wieku rozrodczego są też bardziej z niedoborem żelaza niż mężczyźni w populacji ogólnej (15). W tym badaniu na pacjentach RLS bez anemii, znaleźliśmy też znaczącą dyskryminację zależną od płci. Kobiecy pacjenci RLS są na znacznie wyższym ryzyku dla IDNA niż męscy pacjenci RLS (względne ryzyko 5,51, p < 0,0001). Mniej męskich pacjentów RLS cierpiało na niedobór żelaza, z lub bez anemii. W kontrolach, chociaż bez znaczenia statystycznego, znaleźliśmy 9,8% kobiet cierpiało z powodu niedoboru żelaza, podczas gdy żaden z mężczyzn nie zrobił. Niedobór żelaza jest rzadki w płci męskiej, więc jeśli męscy pacjenci RLS mają niedobór żelaza, dodatkowe zapytania powinny być zrobione by ocenić dla drugorzędnych przyczyn takich jak chroniczne krwawienie i niedożywienie z powodu zaburzeń żołądkowo-jelitowych.
Kiedy porównany do „normalnej” NID grupy RLS, IDNA grupa RLS pokazała wcześniejszy wiek początku RLS i młodszy wiek przy wywiadzie w kobietach, ale nie w mężczyznach (Tabela 2). We wcześniejszym badaniu stwierdziliśmy, że RLS o wczesnym początku wykazywał więcej pozytywnego wywiadu rodzinnego w kierunku RLS i bardziej poważnie zaburzone obwodowe parametry żelaza (niższa ferrytyna w surowicy i wyższe wartości transferyny i TIBC w surowicy) w porównaniu z RLS o późnym początku (8). Ostatnio stwierdziliśmy, że IDNA w RLS przewiduje pewne czynniki genetyczne w porównaniu do NID w RLS (dane niepublikowane). Potencjalny podtyp w powiązaniu z podłożem genetycznym, niedoborem żelaza i wczesnym początkiem RLS zasługuje na dalsze badania. Zmęczenie, osłabienie, trudności w koncentracji, spadek pamięci, jak również słaba wydajność pracy są niespecyficznymi objawami, które często wiążą się z niedoborem żelaza (7, 16). Allen i wsp. (6) wcześniej zgłosili IDA cierpiących z RLS wykazały większe zmęczenie, gorszą jakość snu i zmniejszenie energii w ciągu dnia w porównaniu do IDA pacjentów bez RLS. Stwierdziliśmy, że pacjenci z RLS z IDNA również częściej cierpieli z powodu objawów ciężkiego/bardzo ciężkiego zmęczenia lub senności w ciągu dnia z powodu RLS w porównaniu z pacjentami z RLS z NID (punkt odcięcia przy 75 μg/L, 32,5 vs. 17,7%, P < 0,05, Tabela 2). Podczas ponownej analizy tylko u pacjentów z RLS bez leków, pacjenci z RLS z IDNA nadal wykazywali tendencję do większej podatności na ciężkie/bardzo ciężkie zmęczenie lub senność w ciągu dnia, chociaż nie osiągając istotności statystycznej (35 vs. 18,8%, P = 0,078, Tabela uzupełniająca 1). Żadna różnica między IDNA RLS i IDA RLS nie była znaleziona między ciężkim/bardzo ciężkim zmęczeniem w ciągu dnia albo sennością w tym badaniu (Tabela 2). Zubożenie zasobów żelaza, na kontinuum od IDA do IDNA, jest związane ze zmniejszoną aktywnością enzymów zależnych od żelaza, zmniejszoną zdolnością oksydacyjną komórek, jak również zmniejszoną wydajnością energetyczną (17-19). Kiedy zastosowaliśmy bardziej rygorystyczną definicję IDNA (wartość odcięcia ferrytyny w surowicy ustalona na 50 μg/L), nadal stwierdziliśmy, że więcej pacjentów z IDNA RLS cierpiało z powodu ciężkiego/bardzo ciężkiego zmęczenia lub senności w ciągu dnia w porównaniu z pacjentami z NID RLS (32,3 vs. 19,8%), jednak nie było to znaczące (P > 0,05; Tabela uzupełniająca 2). Okresowe ruchy nóg we śnie (PLMS) są ściśle związane z RLS, a locus w obrębie genu BTBD9 jest skorelowane z ryzykiem zarówno PLMS, jak i RLS (20, 21). Zwraca uwagę fakt, że jakość snu ocenialiśmy jedynie za pomocą subitemu 4 IRLSRS, a nie przeprowadzaliśmy szczegółowej oceny stanu snu za pomocą pomiaru polisomnograficznego (PSG). W związku z tym niedostępne były dane dotyczące PLMS i innych parametrów związanych ze snem, które mogą w istotny sposób przyczyniać się do zmęczenia lub senności w ciągu dnia. Dlatego też związek pomiędzy zmęczeniem/sennością w ciągu dnia a IDNA wymaga dalszych badań. Nie znaleźliśmy znaczącej różnicy w ciężkości RLS między grupą IDNA i NID. Obwodowy niedobór żelaza będzie zwiększać ryzyko dla RLS prewalencji w poprzednich badaniach klinicznych (6). Zmniejszone stężenia żelaza surowicy globalnie zmniejszają poziomy żelaza mózgu i leczenie żelaza przynosi korzyści pacjentom RLS z niskimi poziomami obwodowego żelaza (10). Niemniej jednak, wielu pacjentów z RLS bez systemowego niedoboru żelaza nadal wykazuje specyficzny dla mózgu deficyt żelaza (22). Badania w gryzoniach zrelacjonowały status żelaza surowicy nie był skorelowany z regionalnymi poziomami żelaza mózgu, dlatego może być ograniczony do cech RLS (23, 24).
Is IDNA an Early Stage Prior to IDA in RLS?
Niedobór żelaza może być sklasyfikowany do dwóch poziomów, IDNA i IDA, według wartości pomiaru hemoglobiny. W tym badaniu, pacjenci RLS z IDA mieli najniższą hemoglobinę, ferrytynę i poziomy żelaza, jak również najwyższe wartości transferyny i TIBC w porównaniu do IDNA RLS i NID RLS (Figura 1, Tabela 3). Chociaż nie było istotnych różnic w poziomie hemoglobiny między IDNA RLS i NID RLS (zarówno u mężczyzn, jak i u kobiet z RLS), hemoglobina w surowicy u pacjentów z IDNA RLS była niższa w porównaniu z kontrolami (tylko u kobiet, P < 0,05, Figura 1, Tabela 3). Ponadto, wartości parametrów żelaza w grupie IDNA RLS były pomiędzy tymi z NID RLS lub grupy kontrolnej i grupy IDA RLS (Figura 1, Tabela 3). Wyniki te są zgodne z punktem widzenia IDNA jest łagodniejszy niedobór żelaza przed rozwojem niedokrwistości. Z uwagi, surowicy żelazne parametry są uważane za odzwierciedlające obwodowy żelazny status głównie w erytronach (25), podczas gdy żelazne magazynowanie w innych organach (takich jak wątroba, mózg, itp.) potrzebują zatwierdzonego w IDNA subjects.
Niemniej, przyczyny i cechy IDNA RLS i IDA RLS nie są całkowicie podobne. W tym badaniu, większość pacjentów z RLS z IDA miała godne uwagi choroby towarzyszące związane z niedożywieniem lub przewlekłą nadmierną utratą krwi, w tym krwotok z przewodu pokarmowego, krwotok z hemoroidów i menorrhagia (Tabela 1), co jest zgodne z poprzednim badaniem (12). Warto podkreślić, że menorrhagia jest częstą przyczyną IDA u kobiet w wieku reprodukcyjnym, która może być następstwem włókniaków macicy, adenomiozy i innych schorzeń ginekologicznych. Niedożywienie może być wtórne do zaburzeń żołądkowo-jelitowych, diety wegetariańskiej i błędnych przekonań dotyczących obrazu własnego ciała u młodych kobiet. Tak więc, niedobór żelaza w większości IDA RLS pacjentów w tym badaniu są „absolutny niedobór żelaza”. W przeciwieństwie do tego, pacjenci z RLS z IDNA zazwyczaj nie mają znaczących chorób współistniejących. Przyczyny IDNA RLS są podstępne i IDNA w RLS ogólnie należy do zakresu pierwotnego RLS (4) związanego z „funkcjonalnym niedoborem żelaza.” Jednak nie możemy wykluczyć jakichkolwiek podstępnych wtórnych przyczyn w IDNA RLS pacjentach, które mogą prowadzić do niedostatecznego zaopatrzenia w żelazo w organizmie.
Porównując do RLS z IDNA, pacjenci z IDA mieli starszy wiek początku RLS, jak również krótszy czas trwania RLS zarówno u mężczyzn jak i kobiet (bardziej znaczący u mężczyzn; Tabela 2), który był zgodny z punktem widzenia , że wtórny RLS zwykle ma starszy wiek początku (26). Zgodnie z naszym doświadczeniem, ci IDA RLS pacjenci z godnymi uwagi przyczynami (takimi jak ostra utrata krwi) zwykle wykazują krótszy czas trwania choroby i szybszy powrót do zdrowia lub ulgę, gdy uleczalne zaburzenia towarzyszące są skorygowane i status żelaza przywrócony. Zazwyczaj nie wymagają oni długotrwałego leczenia RLS, co różni ich nieco od pacjentów z pierwotnym RLS. Przyszłe badania podłużne są konieczne, aby potwierdzić efekty leczenia suplementacją żelaza u pacjentów z RLS z IDA. Inne studia nad współwystępującym RLS ciąży (27) i mocznicy (28) zrelacjonowały poprawę po porodzie i przeszczepie nerki, sugerując zmiany w powiązanych metabolicznych czynnikach mogą wywołać RLS w podatnych podmiotach (5).
Dlatego, są heterogeniczności w zarówno IDA RLS jak i IDNA RLS. Chociaż IDNA jest ogólnie uważany za wczesny etap poprzedzający anemię (7), IDNA RLS nie jest prawdopodobnie po prostu prodromalnym etapem poprzedzającym IDA RLS.
Accessing and Diagnosing IDNA w RLS
Ale biopsja szpiku kostnego jest uważana za najlepszy wskaźnik statusu żelaza, to jest rzadko wykonywane z powodu potencjalnego ryzyka infekcji albo krwawienia w miejscu biopsji (29). Najpowszechniej stosowanymi laboratoryjnymi wskaźnikami statusu żelaza jest ferrytyna, która odzwierciedla albo tkankowe zapasy żelaza albo adekwatność żelaza łatwo dostępnego dla erytropoezy (30). Chociaż ferrytyna w surowicy jest czułym markerem do oceny całkowitego zapasu żelaza w organizmie, inne warunki, takie jak stan zapalny, wiek i czynność nerek mogą być czynnikami zakłócającymi, zwiększając poziom ferrytyny w surowicy (31). Ferrytyna i transferyna są również reaktorami ostrej fazy, a poziom ferrytyny może być zwiększony, a poziom transferyny zmniejszony w warunkach zapalnych (32). Dlatego nawet ferrytyna w surowicy ≥ 75 μg/L i TSAT <20% mogą nadal mieć rzeczywisty niedobór żelaza (11, 33).
Punkt odcięcia stężenia ferrytyny w surowicy <30 μg/L jest najbardziej czuły i specyficzny do identyfikacji potencjalnego niedoboru żelaza w populacji ogólnej (17, 18), a IDNA jest klasyfikowany jako mający normalny poziom hemoglobiny z obniżonym poziomem ferrytyny w surowicy (<20 μg/L) (34, 35). Laboratoria kliniczne zwykle ustalają dolną granicę zakresu referencyjnego dla ferrytyny w surowicy na poziomie 10-20 μg/L w populacji ogólnej (36) (w naszym szpitalu dolna granica została ustalona na poziomie 20 μg/L). Znacznie wyższe poziomy progowe dla ferrytyny w surowicy są zwykle stosowane do definiowania niedoboru żelaza w przewlekłych schorzeniach, takich jak niewydolność serca i przewlekła choroba nerek (7, 17). Kryteria oceny w celu zdefiniowania niedoboru żelaza w RLS również różnią się od tych w zdrowych kontrolach, chociaż dokładna wartość odcięcia dla ferrytyny w celu oznaczenia IDNA w RLS nie osiągnęła jeszcze konsensusu. Ostatnie badania sugerują, że pacjentów z RLS należy uznać za osoby z niedoborem żelaza, gdy stężenie ferrytyny jest u nich niższe niż 75 μg/L (10, 11, 27). Jednak wcześniejsze badania w większości określały stężenie ferrytyny poniżej 50 μg/L jako „niski status żelaza” w RLS (37, 38). Ponieważ nie są dostępne dane dotyczące opisów różnych punktów odcięcia, porównaliśmy cechy IDNA RLS i NID RLS używając zarówno 75 jak i 50 μg/L jako wartości odcięcia ferrytyny dla niedoboru żelaza. Stwierdziliśmy, że przy użyciu 50 μg/L jako dolnej granicy ferrytyny, 33,2% (65/196) pacjentów z RLS spełnia kryteria IDNA. Wyniki były dość podobne dla dwóch używanych progów, z wyjątkiem tego, że zwiększone ciężkie/bardzo ciężkie zmęczenie lub senność w ciągu dnia w IDNA RLS w porównaniu z NID RLS nie było znaczące, gdy wartość odcięcia ferrytyny została ustalona na 50 μg/L (Tabela 2, Tabela uzupełniająca 2).
Nasze badanie miało pewne ograniczenia: Po pierwsze, było to badanie przekrojowe, a brak danych podłużnych utrudniał określenie ewolucji objawów RLS i efektów leczenia. Co więcej, może istnieć błąd wycofania. Po drugie, było to badanie przeprowadzone w jednym ośrodku, ponieważ około jedna czwarta pacjentów była lokalnymi mieszkańcami Szanghaju, a większość pacjentów pochodziła z Chin Wschodnich. Biorąc pod uwagę rozległe terytorium Chin i możliwe różne czynniki środowiskowe, może wystąpić błąd selekcji. Po trzecie, nie wykonaliśmy pomiarów PSG, aby ocenić szczegółowy stan snu u pacjentów z RLS i w grupie kontrolnej. Po czwarte, około jedna trzecia pacjentów z RLS w tym badaniu była na terapii dopaminergicznej i/lub gabapentynie enacarbil (tylko jeden pacjent otrzymywał terapię uzupełniającą żelazem), co może wpływać na cechy kliniczne. Obliczyliśmy jednak wszystkie dane ponownie u pacjentów z RLS bez leków i wyciągnęliśmy te same wnioski. Mimo to, nasze badanie ma pewne zalety. Zbadaliśmy szczegółowo spektrum kliniczne RLS i wykluczyliśmy inne choroby współistniejące lub naśladujące RLS. Z każdym pacjentem przeprowadziliśmy wywiad twarzą w twarz i starannie wykluczyliśmy tych nietypowych pacjentów z RLS podczas obserwacji. Istnieją ograniczone badania dotyczące cech IDNA w RLS, zbadaliśmy szczegółową charakterystykę kliniczną IDNA u kolejnych chińskich pacjentów z RLS.
Wnioski
IDNA występuje często u pacjentów z RLS, szczególnie u kobiet i ma pewne szczególne cechy kliniczne. W porównaniu z NID u pacjentek z RLS, IDNA charakteryzowała się młodszym wiekiem zarówno w momencie przeprowadzania wywiadu, jak i w momencie wystąpienia RLS. IDNA nie jest zbyt częste u mężczyzn z RLS, a mężczyźni z niedoborem żelaza powinni być oceniani pod kątem współistniejących zaburzeń. Cechy charakterystyczne dla pacjentów z RLS z IDNA różnią się od RLS z IDA. RLS z IDNA stanowi ważny i pomijany problem zdrowia publicznego, który zasługuje na większą uwagę kliniczną i powinien być uwzględniony w strategii leczenia. Regularne badania przesiewowe obwodowych parametrów żelaza, nawet u pacjentów z prawidłową morfologią krwi, są zalecane w celu uzyskania odpowiedniego leczenia w odpowiednim czasie.
Oświadczenie o dostępności danych
Zestawy danych wygenerowane dla tego badania są dostępne na żądanie odpowiedniego autora.
Oświadczenie o etyce
Badania z udziałem ludzi zostały przejrzane i zatwierdzone przez Shanghai General Hospital Institutional Review Board. The patients/participants provided their written informed consent to participate in this study.
Author Contributions
X-YZ conception/design/execution of the project/drafting the manuscript. T-TW: wykonanie projektu/zbieranie i interpretacja danych/redagowanie manuskryptu. H-MW i JS: pomiary laboratoryjne. XL, L-YN, T-JC, i M-YQ: wykonanie projektu/zbieranie i interpretacja danych. TL i WO: krytyczna weryfikacja manuskryptu pod kątem istotnych treści intelektualnych. Y-CW: koncepcja/projekt/nadzór nad projektem, krytyczna korekta manuskryptu pod kątem ważnych treści intelektualnych. All authors: manuscript preparation.
Funding
This work was sponsored by Shanghai Municipal Planning Commission of Science and Research Fund (201740017), the Clinical Research Innovation Plan of Shanghai General Hospital (CTCCR-2018C02), the Interdisciplinary Program of Shanghai Jiao Tong University (YG2015QN21), and National Natural Science Foundation of China (No. 81671251).
Konflikt interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Dziękujemy wszystkim pacjentom i zdrowym osobom z grupy kontrolnej, którzy wzięli udział w tym badaniu. Dziękujemy personelowi Physical Examination Center w Shanghai General Hospital. Dziękujemy również Department of Bioinformatics and Biostatistics, School of Life Sciences and Biotechnology, Shanghai Jiao Tong University, Yue Zhang za konsultację statystyczną.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć online pod adresem: https://www.frontiersin.org/articles/10.3389/fneur.2020.00298/full#supplementary-material
Skróty
CI, przedział ufności; IRLSSG, International Restless Legs Study Group; MMSE, Mini-Mental State Examination; NID, bez niedoboru żelaza; RLS, zespół niespokojnych nóg; IDA, niedokrwistość z niedoboru żelaza; IDNA, niedobór żelaza bez niedokrwistości; IRLSRS, International Restless Legs Syndrome Rating Scale; TIBC, całkowita zdolność wiązania żelaza; TSAT, wysycenie transferyny.
1. Allen RP, Picchietti DL, Garcia-Borreguero D, Ondo WG, Walters AS, Winkelman JW, et al. Restless legs syndrome/Willis-Ekbom disease diagnostic criteria: updated International Restless Legs Syndrome Study Group (RLSSG) consensus criteria-history, rationale, description, and significance. Sleep Med. (2014) 15:860-73. doi: 10.1016/j.sleep.2014.03.025
CrossRef Full Text | Google Scholar
2. Connor JR, Boyer PJ, Menzies SL, Dellinger B, Allen RP, Ondo WG, et al. Badanie neuropatologiczne sugeruje upośledzone nabywanie żelaza w mózgu w zespole niespokojnych nóg. Neurology. (2003) 61:304-9. doi: 10.1212/01.WNL.0000078887.16593.12
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Allen RP, Earley CJ. The role of iron in restless legs syndrome. Mov disord. (2007) 18(22 Suppl):S440-8. doi: 10.1002/mds.21607
CrossRef Full Text | Google Scholar
4. Trenkwalder C, Allen R, Hogl B, Clemens S, Patton S, Schormair B, et al. Comorbidities, treatment, and pathophysiology in restless legs syndrome. Lancet Neurol. (2018) 17:994-1005. doi: 10.1016/S1474-4422(18)30311-9
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Trenkwalder C, Allen R, Hogl B, Paulus W, Winkelmann J. Restless legs syndrome associated with major diseases: a systematic review and new concept. Neurology. (2016) 86:1336-43. doi: 10.1212/WNL.000000002542
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Allen RP, Auerbach S, Bahrain H, Auerbach M, Earley CJ. The prevalence and impact of restless legs syndrome on patients with iron deficiency anemia. Am J Hematol. (2013) 88:261-4. doi: 10.1002/ajh.23397
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Soppi ET. Niedobór żelaza bez niedokrwistości – wyzwanie kliniczne. Clin Case Rep. (2018) 6:1082-6. doi: 10.1002/ccr3.1529
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Zhu XY, Wu TT, Wang HM, Ni LY, Li X, Liu Y, et al. Clinical features and subtypes of restless legs syndrome in Chinese population: a study of 359 patients. Sleep Med. (2019) 59:15-23. doi: 10.1016/j.sleep.2019.01.053
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP, et al. International Restless Legs Syndrome Study, Validation of the International Restless Legs Syndrome Study Group rating scale for restless legs syndrome. Sleep Med. (2003) 4:121-32. doi: 10.1016/S1389-9457(02)00258-7
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. International Restless Legs Syndrome Study, Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report. Sleep Med. (2018) 41:27-44. doi: 10.1016/j.sleep.2017.11.1126
CrossRef Full Text | Google Scholar
11. Trenkwalder C, Winkelmann J, Oertel W, Virgin G, Roubert B, Mezzacasa A, et al. Ferric carboxymaltose in patients with restless legs syndrome and nonanemic iron deficiency: a randomized trial. Mov Disord. (2017) 32:1478-82. doi: 10.1002/mds.27040
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Mehmood T, Auerbach M, Earley CJ, Allen RP. Odpowiedź na dożylne podawanie żelaza u pacjentów z niedokrwistością z niedoboru żelaza (IDA) i zespołem niespokojnych nóg (choroba Willisa-Ekboma). Sleep Med. (2014) 15:1473-6. doi: 10.1016/j.sleep.2014.08.012
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Thomas K, Watson CB. Zespół niespokojnych nóg u kobiet: przegląd. J Womens Health. (2008) 17:859-68. doi: 10.1089/jwh.2007.0515
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Ohayon MM, O’Hara R, Vitiello MV. Epidemiologia zespołu niespokojnych nóg: synteza literatury. Sleep Med Rev. (2012) 16:283-95. doi: 10.1016/j.smrv.2011.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Umbreit J. Niedobór żelaza: zwięzły przegląd. Am J Hematol. (2005) 78:225-31. doi: 10.1002/ajh.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Sawada T, Konomi A, Yokoi K. Niedobór żelaza bez anemii jest związany z gniewem i zmęczeniem u młodych japońskich kobiet. Biol Trace Elem Res. (2014) 159:22-31. doi: 10.1007/s12011-014-9963-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Camaschella C. Niedokrwistość z niedoboru żelaza. N Engl J Med. (2015) 372:1832-43. doi: 10.1056/NEJMra1401038
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Iron deficiency anaemia. Lancet. (2016) 387:907-16. doi: 10.1016/S0140-6736(15)60865-0
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Haas JD, Brownlie T. Niedobór żelaza zmniejszona zdolność do pracy: krytyczny przegląd badań w celu określenia związku przyczynowego. J Nutr. (2001) 131:676S-88S; dyskusja 688S-90S. doi: 10.1093/jn/131.2.676S
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Stefansson H, Rye DB, Hicks A, Petursson H, Ingason A, Thorgeirsson TE, et al. A genetic risk factor for periodic limb movements in sleep. N Engl J Med. (2007) 357:639-47. doi: 10.1056/NEJMoa072743
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Li G, Tang H, Wang C, Qi X, Chen J, Chen S, et al. Stowarzyszenie BTBD9 i MAP2K5/SKOR1 z zespołem niespokojnych nóg w populacji chińskiej. Sleep. (2017) 40:zsx028. doi: 10.1093/sleep/zsx028
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Earley CJ, Connor J, Garcia-Borreguero D, Jenner P, Winkelman J, Zee PC, et al. Altered brain iron homeostasis and dopaminergic function in Restless Legs Syndrome (Willis-Ekbom Disease). Sleep Med. (2014) 15:1288-301. doi: 10.1016/j.sleep.2014.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Erikson KM, Pinero DJ, Connor JR, Beard JL. Regionalne stężenia żelaza, ferrytyny i transferryny w mózgu podczas niedoboru żelaza i uzupełniania żelaza u rozwijających się szczurów. J Nutr. (1997) 127:2030-8. doi: 10.1093/jn/127.10.2030
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Yin L, Unger EL, Jellen LC, Earley CJ, Allen RP, Tomaszewicz A, et al. Systems genetic analysis of multivariate response to iron deficiency in mice. Am J Physiol Regul Integr Comp Physiol. (2012) 302:R1282-96. doi: 10.1152/ajpregu.00634.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hallberg L, Hulthen L. Perspectives on iron absorption. Blood Cells Mol Dis. (2002) 29:562-73. doi: 10.1006/bcmd.2002.0603
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Shukla G, Gupta A, Pandey RM, Kalaivani M, Goyal V, Srivastava A, et al. What features differentiate unilateral from bilateral restless legs syndrome? Porównawcze badanie obserwacyjne 195 pacjentów. Sleep Med. (2014) 15:714-9. doi: 10.1016/j.sleep.2014.01.025
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Picchietti DL, Hensley JG, Bainbridge JL, Lee KA, Manconi M, McGregor JA, et al. International Restless Legs Syndrome Study, Consensus clinical practice guidelines for the diagnosis and treatment of restless legs syndrome/Willis-Ekbom disease during pregnancy and lactation. Sleep Med Rev. (2015) 22:64-77. doi: 10.1016/j.smrv.2014.10.009
CrossRef Full Text | Google Scholar
28. Winkelmann J, Stautner A, Samtleben W, Trenkwalder C. Long-term course of restless legs syndrome in dialysis patients after kidney transplantation. Mov Disord. (2002) 17:1072-6. doi: 10.1002/mds.10231
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Bain BJ. Zachorowalność na biopsję szpiku kostnego: przegląd 2003 roku. J Clin Pathol. (2005) 58:406-8. doi: 10.1136/jcp.2004.022178
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Baynes RD. Ocena statusu żelaza. Clin Biochem. (1996) 29:209-15. doi: 10.1016/0009-9120(96)00010-K
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Wish JB. Ocena stanu żelaza: poza ferrytyną w surowicy i nasyceniem transferyny. Clin J Am Soc Nephrol. (2006) 1(1 Suppl):S4-8. doi: 10.2215/CJN.01490506
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Tietz NW, Rinker AD, Morrison SR. Kiedy żelazo w surowicy jest naprawdę żelazem w surowicy? Status pomiarów żelaza w surowicy. Clin Chem. (1994) 40:546-1. doi: 10.1093/clinchem/40.4.546
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Mackie S, Winkelman JW. Normalna ferrytyna u pacjenta z niedoborem żelaza i RLS. J Clin Sleep Med. (2013) 9:511-3. doi: 10.5664/jcsm.2680
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Porównanie dwóch dawek żelaza elementarnego w leczeniu utajonego niedoboru żelaza: skuteczność, skutki uboczne i możliwości zaślepienia. Nutrients. (2014) 6:1394-405. doi: 10.3390/nu6041394
PubMed Abstract | CrossRef Full Text | Google Scholar
35. D’Adamo CR, Novick JS, Feinberg TM, Dawson VJ, Miller LE. Pochodzący z żywności suplement diety zawierający niską dawkę żelaza poprawił markery statusu żelaza wśród kobiet bez niedokrwistości z niedoborem żelaza. J Am Coll Nutr. (2018) 37:342-9. doi: 10.1080/07315724.2018.1427158
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Goodnough LT, Nemeth E, Ganz T. Detection, evaluation, and management of iron-restricted erythropoiesis. Blood. (2010) 116:4754-61. doi: 10.1182/blood-2010-05-286260
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Lee CS, Lee SD, Kang SH, Park HY, Yoon IY. Comparison of the efficacy of oral iron and pramipexole for the treatment of restless legs syndrome patients with low serum ferritin. Eur J Neurol. (2014) 21:260-6. doi: 10.1111/ene.12286
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Tilma J, Tilma K, Norregaard O, Ostergaard JR. Early childhood-onset restless legs syndrome: symptoms and effect of oral iron treatment. Acta Paediatr. (2013) 102:e221-6. doi: 10.1111/apa.12173
PubMed Abstract | CrossRef Full Text | Google Scholar
.