- Introduction
- Materiały i metody
- Badanie kliniczne pacjentów
- Ethic Standard Protocol Approvals, Registration, and Patient Consent
- Interwencja neurochirurgiczna
- Analiza statystyczna
- Results
- Patient Characteristics and Symptoms
- Symptoms, Clinical Signs, and Findings 1 Week after Surgery
- Symptoms, Clinical Signs, and Findings 3 Months after Surgery
- Dyskusja
- Oświadczenie etyczne
- Wkład autorów
- Oświadczenie o konflikcie interesów
- Podziękowania
- Finansowanie
- Materiały uzupełniające
Introduction
Malformacja Chiariego obejmuje grupę jednostek patologicznych charakteryzujących się obecnością anatomicznych deformacji móżdżku i pnia mózgu. Typowymi objawami są potyliczne bóle głowy, nasilające się przy kaszlu, zaburzenia ruchowe i/lub czuciowe, zwłaszcza kończyn górnych, oraz niezdarność (1, 2).
Obecne leczenie obejmuje dekompresję okolicy podpotylicznej w celu powiększenia średnicy otworu wielkiego oraz resekcję tylnego łuku C1. Jednak wiele krytycznych dyskusji dotyczyło tego, czy należy otworzyć pajęczynówkę i usunąć również migdałki móżdżku (3). Ryzyko pooperacyjne takiego postępowania wydaje się być większe, włączając w to pseudomeningocele i tworzenie się krwiaków, zapalenie opon mózgowych i bóle głowy (2). Z drugiej strony, wystarczająca dekompresja pnia mózgu jest bardziej prawdopodobna, gdy manipuluje się pajęczynówką i migdałkami (1, 4) (szczegóły w Arkuszu Danych S1 w Materiałach Uzupełniających). Dane dotyczące wyników klinicznych po leczeniu chirurgicznym różnią się ze względu na różne metody chirurgiczne, kohorty pacjentów i objawy. W różnych badaniach poprawę stanu klinicznego i poprawę funkcjonowania w życiu codziennym opisywano u 50-75% pacjentów (2, 3). Dysfunkcje motoryki oka poprawiły się u 75-100% pacjentów (5-7).
Doświadczenia z uszkodzeniami móżdżku, tj. z powodu zawałów niedokrwiennych, uczą nas, że zmiany migdałków mogą prowadzić do znacznych deficytów motoryki oka, powodując upośledzające zawroty głowy (8). Jednak wpływ jednostronnej tonsillektomii na motorykę oka i funkcję móżdżku nie był dotychczas systematycznie badany. Głównym celem naszej pracy była ocena, czy zabieg operacyjny dekompresji podpotylicznej, w tym redukcja jednego migdałka móżdżkowego, prowadzi do deficytów ruchowych oczu, przedsionkowych lub móżdżkowych u pacjentów z malformacją Chiariego typu I.
Materiały i metody
Badanie kliniczne pacjentów
Czternastu kolejnych pacjentów z radiologicznymi dowodami malformacji Chiari typu 1 zostało przebadanych w tym badaniu na Oddziałach Neurologii i Neurochirurgii Szpitala Uniwersyteckiego w Monachium. Trzech pacjentów miało łagodne objawy kliniczne i było leczonych zachowawczo. Jedenastu poddano interwencji chirurgicznej z resekcją lub redukcją jednego migdałka móżdżku i włączono do badania. Jeden pacjent nie był badany.
Pacjenci byli badani przed i w dwóch punktach czasowych po interwencji chirurgicznej: jeden bezpośrednio po i jeden w obserwacji około 3 miesiące po operacji. Pacjenci otrzymali standaryzowany kwestionariusz dotyczący typowych dolegliwości. Pacjentów pytano o ból głowy lub szyi (rodzaj i czynniki prowokujące), niestabilność chodu, zawroty głowy lub zawroty głowy (rodzaj i czynniki prowokujące), problemy wzrokowe, problemy audiologiczne, objawy ruchowe, deficyty czuciowe i deficyty dolnych nerwów czaszkowych.
Badanie składało się ze standaryzowanego badania neurologicznego, neurooftalmologicznego i neuro-otologicznego. To zawierało test głowy pchnięcia, ocenę dla spontanicznego oczopląsu z okularami Frenzla w podstawowej pozycji i podczas odchylenia spojrzenia, gładkiego pościgu, sakkad, oczopląsu optokinetycznego, wizualnej fiksacji tłumienia przedsionkowo-ocznego odruchu (VOR), oczopląsu potrząsania głową i określenia subiektywnego wizualnego pionu (SVV). Odchylenia powyżej 2,5° uznawano za patologiczne (9). Funkcję móżdżku oceniano za pomocą skal oceny ataksji, a mianowicie Scale for the Assessment and Rating of Ataxia (SARA) (10) oraz Spinocerebellar Ataxia Functional Index (SCAFI) (11). W trakcie 3-miesięcznej obserwacji badano neurofizjologicznie funkcję układu przedsionkowego, wykonując badanie kaloryczności bithermalnej za pomocą EyeSeeCam System® (patologiczna różnica stron wg wzoru Jongkee’go większa niż 25%) oraz potencjały miogenne wywołane przedsionkowo-okoruchowo (c/oVEMP) z przewodnictwem powietrznym w odcinku szyjnym i kostnym za pomocą Interacoustics Eclipse System® (12). Współczynnik asymetrii powinien wynosić poniżej 35% (13). Pomiary posturograficzne przeprowadzono w pozycji stojącej, stosując standardowy protokół z 10 różnymi warunkami o rosnącym stopniu trudności (14). Subiektywna poprawa była mierzona za pomocą wywiadu. Pacjentów pytano o wszystkie dolegliwości łącznie, czy uzyskali poprawę w zakresie objawów 3 miesiące po interwencji. Subiektywne upośledzenie w odniesieniu do zawrotów głowy mierzono za pomocą Inwentarza Upośledzenia Zawrotów Głowy (Dizziness Handicap Inventory – DHI) (15, 16). DHI jest kwestionariuszem samooceny z minimalną liczbą punktów 0 i maksymalną liczbą punktów 100 (maksymalny wpływ zawrotów głowy na życie codzienne). Istotny klinicznie wynik zmiany między stanem przed i po leczeniu w oryginalnej pracy wynosi 18 (16). U wszystkich pacjentów wykonano rutynowe pooperacyjne MRI po 3 miesiącach. W przypadku istniejących syrinx, rozmiar (długość i średnica w milimetrach) został zmierzony i porównany z przedoperacyjnymi skanami MRI.
Ethic Standard Protocol Approvals, Registration, and Patient Consent
To badanie zostało przeprowadzone zgodnie z zaleceniami Institutional Review Board komisji etycznej Uniwersytetu Ludwig-Maximilian w Monachium z pisemną świadomą zgodą wszystkich uczestników. Wszyscy badani wyrazili pisemną świadomą zgodę zgodnie z Deklaracją Helsińską. Protokół został zatwierdzony przez Institutional Review Board of the ethics committee of the Ludwig-Maximilian University Munich. Wskazania do interwencji chirurgicznej zostały dostarczone niezależnie od udziału w tym badaniu.
Interwencja neurochirurgiczna
Pacjentów poddano śródoperacyjnemu monitorowaniu elektrofizjologicznemu dla dolnych nerwów czaszkowych, potencjałów wywołanych ruchowo i potencjałów wywołanych somatosensorycznie w celu uniknięcia dodatkowego wpływu na pień mózgu w wyniku przesadnego pochylenia głowy. W pozycji leżącej na brzuchu głowę chorego unieruchomiono w zacisku Mayfielda. Interwencja chirurgiczna polegała na podpotylicznym przyśrodkowym rozcięciu mięśnia szyi, odsłaniając łuk C1 i potylicę wokół otworu wielkiego (foramen magnum). Najpierw poszerzono otwór wielki przez kraniektomię osteoklastyczną o wymiarach ok. 3 cm × 4 cm, szerokość dostosowano do wielkości otworu wielkiego. Następnie wykonano laminektomię łuku C1 do tej samej szerokości kanału kręgowego. Ultrasonografia śródoperacyjna pozwalała na uwidocznienie wierzchołków migdałków w celu odbarczenia ich tak daleko w dół, jak to było konieczne. Czasami konieczna była laminotomia górnego brzegu łuku C2. Nigdy nie wykonywano laminektomii C2, aby uniknąć niestabilności kręgosłupa szyjnego. Następnie otwierano oponę twardą w kształcie litery „Y” i zszywano ją z okostną kości potylicznej. Po starannym przecięciu pajęczynówki zidentyfikowano dłuższy i większy migdałek móżdżku, a także dolną część pnia mózgu i rdzeń kręgowy. Zidentyfikowany migdałek został najpierw obkurczony przez koagulację zewnętrznej i przyśrodkowej powierzchni bez naruszania naczyń wewnątrzczaszkowych. Następnie nacięto oponę twardą skoagulowanego migdałka i usunięto tkankę migdałkową przez delikatne odsysanie i koagulację bipolarną. Ostatecznie zredukowany migdałek układano na poziomie otworu wielkiego (foramen magnum). Średnia objętość usuniętej tkanki migdałka wynosiła od 0,6 do 2,7 cm3 (średnia 1,4 cm3, SD 0,6 cm3). Na koniec dokonano inspekcji okolicy obexu w celu zapewnienia swobodnego odpływu z kanału centralnego w obrębie rdzenia kręgowego, jeśli tylko było to możliwe. Aby dodatkowo powiększyć przestrzeń czaszkowo-szyjną, wszczepiono substytut duralu (Lyoplant®, B. Braun) i zaszyto go w sposób wodoszczelny. Na koniec ranę starannie zamknięto w kilku warstwach, np. mięśniach, powięzi, podskórnej i cutis, aby zapobiec wyciekowi płynu mózgowo-rdzeniowego.
Analiza statystyczna
Analizę statystyczną przeprowadzono przy użyciu programu SPSS Statistics 20 (IBM, Armonk, NY, USA). Ponieważ dane nie były normalnie dystrybuowane, przeprowadzono nieparametryczne testy parami, używając testu Wilcoxona dla porównania dwóch powiązanych próbek i testu U Manna-Whitneya dla porównań między grupami. Różnice zostały uznane za istotne, jeśli p < 0,05. This study design was exploratory.
Results
Patient Characteristics and Symptoms
Ten patients with a Chiari malformation type 1 confirmed by MRI (6 females, mean age 37 years, range 18-57) were included in this study. Podane wartości są wartościami średnimi ± odchylenie standardowe. Uczestnicy byli badani przed operacją (27 ± 48 dni przed operacją; zakres od 1 dnia do 5 miesięcy, n = 10) oraz w dwóch punktach czasowych po interwencji chirurgicznej. Więcej szczegółów dotyczących danych klinicznych znajduje się w tabeli 1. W naszej kohorcie średni czas trwania objawów wynosił 4 ± 3 lata (zakres 3 miesiące-11 lat). Czas od początku objawów do postawienia prawidłowej diagnozy wynosił 3 ± 3 lata (zakres 3 miesiące-10 lat). W badaniu MRI syringomielia była obecna u 70% pacjentów. Zejście krętarza wahało się od 0,7 do 2,2 cm (średnio 1,4 cm, SD 0,6 cm). Długość syringomielii wahała się od jednego do ponad 10 segmentów kręgosłupa, a wielkość od 1,5 do 0,3 mm średnicy maksymalnej. Rycina 1 przedstawia pacjenta numer cztery z istotną syringomielią spowodowaną malformacją Chiariego typu I przed i pooperacyjnie.
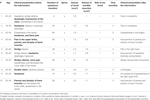
Tabela 1. Obraz kliniczny i przebieg po interwencji chirurgicznej.
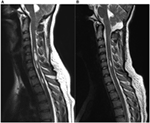
Rysunek 1. Syringomielia spowodowana malformacją Chiariego typu I przed (A) i 3 miesiące po (B) dekompresji chirurgicznej. (A) Ta 19-letnia kobieta skarżyła się na potyliczny ból głowy, niedoczulicę kończyn górnych oraz napady zawrotów głowy. Przedoperacyjne obrazy MR w płaszczyźnie strzałkowej T2 wykazały obniżenie migdałków aż do dolnego brzegu łuku C2 i znaczną wieloprzedziałową syringomielię w szyjnym rdzeniu kręgowym. (B) Pooperacyjne obrazy MR wyraźnie uwidaczniają wyraźne zmniejszenie istniejącej wcześniej syrinx, jak również zmniejszenie długości migdałka przy rozwidleniu magnum. Pacjentka zgłosiła znaczną poprawę objawów po chirurgicznej dekompresji.
Głównymi objawami były nawracające ataki zawrotów głowy (60%), bóle głowy i szyi, nasilające się podczas kaszlu i specyficznych ruchów głowy (50%) oraz dys-/hipestezja w kończynach górnych (50%).
W zakresie charakterystyki kliniczno-neurologicznej, głównymi objawami były ataksja w kończynach górnych (dysmetria palcowo-skroniowa, drżenie zamiarowe, dysdiadochokineza) (6/10 pacjentów) oraz dys- i hipestezja (5/10 pacjentów). Dalsze szczegóły dotyczące badania klinicznego, patrz Tabela 2 (A).
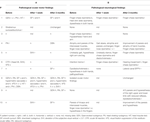
Tabela 2. Motoryka oka (A) i wyniki neurologiczne (B) przed i po interwencji chirurgicznej.
W badaniu neurooftalmologicznym, u pięciu pacjentów stwierdzono nieprawidłowe wyniki ruchów gałek ocznych, w tym oczopląs wywołany potrząsaniem głową (n = 3), oczopląs wywołany spojrzeniem, zaburzoną fiksacyjną supresję VOR, patologiczny test impulsu głowy (każdy n = 2), odchylenie SVV, pochylenie głowy, hipermetryczne sakkady, oczopląs z odbicia, sakkadyczny gładki pościg i oczopląs w dół (DBN) (każdy n = 1). Dla dalszych informacji, zobacz Tabelę 2 (B).
Pacjenci mieli łagodne deficyty móżdżkowe w badanych punktach. Średnia całkowita punktacja SARA wynosiła 0,6 ± 0,9 (zakres punktacji od 0 = brak ataksji do 40 = ciężka ataksja). Średni czas 8MW wynosił 5,1 ± 0,5 s. Czas wykonania testu 9-Hole peg test (9HPT) dla ręki dominującej wynosił 20,1 ± 2,2 s, a dla ręki niedominującej 21,3 ± 2,6 s. Średni wskaźnik PATA wynosił 27,9 ± 3,9. Więcej informacji znajduje się w tabeli 3.

Tabela 3. Funkcja móżdżku oceniona przez Skalę dla Oceny i Oceny Ataksji (SARA) i Spinocerebellar Ataxia Functional Index (SCAFI) przed i po interwencji chirurgicznej.
Dziewięciu z 10 pacjentów przeszło test kaloryczny przed interwencją chirurgiczną, ośmiu o/cVEMP. Sześciu pacjentów miało nieprawidłową funkcję przedsionkową w tych testach: trzech pacjentów (nr 2, 3, i 7) miało patologiczną różnicę stron w testach kalorycznych, sugerując deficyt w funkcji kanału poziomego; trzech innych pacjentów miało patologiczne testy o/cVEMP, wskazując na deficyt w funkcji otolitu (nr 1, 9, i 10).
Całkowity średni DHI był 17 (zakres 0-70), sugerując łagodne upośledzenie. W celu uzyskania dalszych informacji, patrz Tabela 4.

Tabela 4. Badanie przedsionkowe kanału poziomego (test kaloryczny), funkcji sakkularnej i utrykularnej, jak również subiektywne upośledzenie, mierzone Inwentarzem Upośledzenia Zawrotów Głowy (DHI), przed i 3 miesiące po interwencji chirurgicznej.
Pacjenci mieli tendencję do gorszych wyników w posturografii w porównaniu do zdrowych kontroli opublikowanych w innych badaniach w naszym ośrodku (17). Stojąc na twardym podłożu, dziewięciu z 10 pacjentów wykazywało wzorzec kołysania podobny do fobicznego posturalnego zawrotu głowy w sztucznej sieci (14). Dla dalszych informacji, zobacz Tabelę 5.

Tabela 5. Ekstrakt danych posturograficznych z całkowitym i kierunkowym kołysaniem, średnią kwadratową (RMS) oraz szybką transformacją Fouriera (FFT) przed i po interwencji chirurgicznej w czterech wybranych badaniach.
Symptoms, Clinical Signs, and Findings 1 Week after Surgery
Badanie neurooftalmologiczne ujawniło odchylenie SVV w prawo po resekcji lewego migdałka (pacjent nr 5 5,2° i pacjent nr 10 4,5°) i nowe deficyty płynnej gonitwy (nr 1). Dalsze informacje, patrz Tabela 2.
Symptoms, Clinical Signs, and Findings 3 Months after Surgery
Wystarczająca dekompresja podpotyliczna doprowadziła do poprawy objawów (mierzonych za pomocą wywiadu dotyczącego wszystkich objawów przed interwencją) u 9/10 pacjentów w obserwacji bez wpływu strony resekowanego migdałka. Dwóch pacjentów było wolnych od dolegliwości po interwencji neurochirurgicznej (nr 1, 2). U 7 chorych (nr 3-8, nr 10) nastąpiła poprawa objawów. U jednego chorego doszło do poważnych powikłań z powodu wycieku płynu mózgowo-rdzeniowego i następowego zapalenia opon mózgowo-rdzeniowych. Wymagał on rewizji chirurgicznej z powodu przecieku duralowego, a objawy poprawiały się powoli w ciągu kilku tygodni (nr 9). W trakcie obserwacji utrzymywał się u niego resztkowy łagodny niedowład połowiczy prawostronny. U żadnego z pozostałych pacjentów nie wystąpiły inne powikłania. U wszystkich pacjentów zmniejszyła się wielkość i długość istniejącej wcześniej syringomielii. Dalsze informacje, patrz tabele 1 i 2 (B).
Neurooftalmologicznie, oczopląs głowy, VOR, reakcja pochylenia oczu i DBN poprawiły się u wszystkich dotkniętych pacjentów. Częściowa poprawa mogła być obserwowana w oczopląsie wywołanym spojrzeniem i tłumieniu fiksacji VOR.
Nowymi zaburzeniami motoryki oka po operacji były deficyty gładkiego pościgu (nr 1, 7, 9, 10), DBN (nr 4) oraz oczopląs wywołany spojrzeniem i oczopląs z odbicia (nr 9). Wszyscy ci pacjenci byli bezobjawowi. Pacjent nr 9 z poważnymi powikłaniami pooperacyjnymi miał dalsze nowe dysfunkcje przedsionkowo-móżdżkowe, w tym oczopląs wywołany spojrzeniem, oczopląs z odbicia, deficyt gładkiego pościgu pionowego i deficyt przedsionkowy w teście kalorycznym oraz zgłaszał większe upośledzenie w DHI. Dla dalszych informacji, zobacz Tabelę 2 (A) i Tabelę 4.
Dwóch pacjentów z patologicznym cVEMP poprawiło się, jak jeden z trzech pacjentów z nienormalnym testem kalorycznym. Średni DHI poprawił się z 17 do 6 po interwencji chirurgicznej (p = 0,273), szczególnie na podstawie dwóch pacjentów (nr 2, 6), którzy mieli znaczącą poprawę upośledzenia z powodu zawrotów głowy i zawrotów głowy. Dalsze wyniki przedstawiono w tabeli 4.
W pomiarach posturograficznych po operacji całkowite kołysanie (i wartości RMS) nie uległy istotnej zmianie. Nie stwierdzono typowego móżdżkowego kołysania o częstotliwości 3 Hz. Dalsze informacje, patrz Tabela 5.
Dyskusja
Główne wnioski z tego prospektywnego badania są następujące.
Po pierwsze, przedoperacyjne badanie neurooftalmologiczne ujawniło nieprawidłowe wyniki u 50% pacjentów, w tym oczopląs wywołany potrząsaniem głową, oczopląs wywołany spojrzeniem, zaburzone tłumienie fiksacji VOR, odchylenie SVV, pochylenie głowy, hipermetryczne sakkady, oczopląs z odbicia, sakkadyczny smooth pursuit i DBN. 70% pacjentów miało nieprawidłową funkcję przedsionkową: dwóch pacjentów miało patologiczny test impulsów głowowych wskazujący na deficyt VOR o wysokiej częstotliwości, trzech pacjentów miało patologiczny test kaloryczny testujący funkcję VOR o niskiej częstotliwości, a trzech miało nieprawidłową funkcję otolitu testowaną za pomocą potencjałów miogennych wywołanych przedsionkowo.
Pacjenci mieli tylko łagodne lub umiarkowane objawy móżdżkowe (szczególnie dysmetrię gonitwy palców). Objawy kliniczne u naszych pacjentów z Chiari były podobne do tych w innych badaniach (1, 2, 18) z wyjątkiem większych objawów przedsionkowych, co potwierdza wcześniejsze wyniki, że wykrywalność jest wyższa na oddziałach specjalizujących się w neurootologii (6). W badaniu przeprowadzonym w ciągu kilku lat w specjalistycznym oddziale z udziałem 77 pacjentów z Chiari, u 55% pacjentów stwierdzono przedoperacyjne nieprawidłowości w badaniach układu ruchowego oka, w tym oczopląs spontaniczny poziomy (27%), sakkadowy smooth pursuit (29%), oczopląs wywołany pozycją (21%), dysmetrię sakkadową (10%) i DBN (7%) (18). Duża liczba pacjentów ze spontanicznym oczopląsem poziomym nie mogła być odtworzona przez nasze dane, nawet jeśli trzech pacjentów (39%) miało poziomy oczopląs potrząsania głową, sugerując, że magazynowanie prędkości było dotknięte.
Po drugie, interwencja chirurgiczna, w tym tonsillektomia, doprowadziła do subiektywnej i obiektywnej poprawy objawów u 9/10 pacjentów. Umiejętności w zakresie motoryki drobnej i chodu mierzone za pomocą SCAFI uległy znacznej poprawie. Upośledzona funkcja przedsionkowa (kanał poziomy, sakkularna i utricularna) poprawiła się u pięciu z siedmiu pacjentów z upośledzoną funkcją przed operacją, szczególnie w zakresie funkcji VOR wysokiej częstotliwości i funkcji otolitu sakkularnego. Zaburzenia motoryki oka poprawiły się u wszystkich pacjentów pod względem oczopląsu głowy, VOR, reakcji pochylenia gałki ocznej i DBN. U niektórych pacjentów można było zaobserwować dalszą poprawę w zakresie oczopląsu wywołanego spojrzeniem i tłumienia fiksacji VOR.
Subiektywna poprawa w naszej serii przekracza tę z serii przypadków i przeglądów, które generalnie wykazują poprawę około 75% (3). Jednak resekcja migdałków została opisana tylko u 27% pacjentów z dekompresją podpotyliczną według przeglądu na temat serii chirurgicznej w latach 1965-2013 (3). W innej serii 177 pacjentów, poddanych operacji w tylnym dole czaszki, u 137 pacjentów, u których wykonano resekcję migdałków z następowym powiększeniem cystern podpajęczynówkowych, stwierdzono wyraźniejsze zmniejszenie rozmiarów syringomielii, a następnie większą poprawę objawów (1). W innym badaniu obserwacyjnym przeprowadzonym na 77 pacjentach, resekcja migdałków dała dobre wyniki u 100% w porównaniu do 64,8% u pacjentów, u których wykonano jedynie dekompresję foramen magnum (4). W dużej serii 371 pacjentów, u których zastosowano dekompresję tylnego dołu czaszki bez resekcji migdałków, poprawę objawów przedoperacyjnych opisano tylko u 73,6% pacjentów (19).
Po trzecie, badanie neurooftalmologiczne po dekompresji podpotylicznej, w tym redukcji migdałków, ujawniło u pięciu pacjentów nowe, ale w większości bezobjawowe, deficyty motoryki oka, w tym deficyty płynnej gonitwy, oczopląs wywołany spojrzeniem poziomym, oczopląs z odbicia i DBN. Kontralateralne (w stronę redukcji migdałków) odchylenie SVV było przejściowe u 20% pacjentów i zostało wyrównane w dalszej obserwacji. Poprzednie retrospektywne badania dotyczące objawów przedsionkowo-ocznych w malformacji Chiariego lub syringomielii wykazały znaczne ustąpienie zaburzeń motoryki oka na poziomie 75-100% po odbarczeniu bez tonsillektomii (5-7). Procedura chirurgiczna w tych seriach składała się z dekompresji otworu wielkiego i laminektomii C1 wraz z duroplastyką bez resekcji migdałków. Z drugiej strony, badanie motoryki oka, które nie było wykonywane przez wyspecjalizowanych neurookulistów, nie było tak szczegółowe i wystandaryzowane jak w naszej serii.
Do tej pory nie było publikacji na temat działań niepożądanych ze strony motoryki oka, móżdżku i przedsionków po dekompresji podpotylicznej z jednostronną redukcją migdałka móżdżku, który w badaniach neuroanatomicznych uważany jest za ważną część przedsionkowo-móżdżkową. W doświadczeniach na zwierzętach chirurgiczne uszkodzenie płatka i migdałka prowadziło do upośledzenia płynnego pościgu, oczopląsu wywołanego spojrzeniem poziomym, oczopląsu z odbicia i DBN (20).
W naszym badaniu, opisaliśmy nowe oczne deficyty motoryczne po dekompresji podpotylicznej z redukcją jednego migdałka móżdżku, włączając deficyty gładkiego pościgu, poziomy oczopląs wywołany spojrzeniem, oczopląs odbicia i DBN jak również kontralateralne odchylenie SVV. Jak opisano, wyniki te są zgodne z wynikami badań na zwierzętach. Opis przypadku opisujący pacjenta z ostrym izolowanym jednostronnym zawałem migdałka móżdżku wykazał upośledzony smooth pursuit, oczopląs ipsilateralny, oczopląs wywołany spojrzeniem i łagodne kontralateralne odchylenie SVV (8). Podsumowując, nasze wyniki pokazują, że ludzki migdałek wydaje się głównie przyczyniać do płynnego pościgu i sieci utrzymywania spojrzenia (8). Jest to poparte przez anatomiczne badania łączności, jako że paraflocculus głównie otrzymuje wejście z kontralateralnych jąder pontyfikalnych (21), kontralateralnego jądra oliwkowego dolnego i drogi paramedycznej, sugerując ważną funkcję w adaptacyjnej ocznej kontroli motorycznej i sieci neuronalnego integratora (22).
Dlaczego deficyty po jednostronnej tonsillektomii są tak umiarkowane w porównaniu do klinicznych ustaleń nawet po małych zawałach migdałków? Prawdopodobnym wyjaśnieniem może być fakt, że funkcja została już upośledzona z powodu ucisku i deficyt ten został już skompensowany centralnie. Ponadto rozmiar okołooperacyjnej zmiany migdałka był mniejszy.
Jesteśmy świadomi ograniczeń naszego badania. Po pierwsze, projekt jest prospektywny, ale nie kontrolowany. Śródoperacyjne decyzje neurochirurgiczne, tj. po stronie zmniejszonego migdałka, nie były randomizowane. Liczba pacjentów jest raczej niewielka (n = 10) w porównaniu z badaniami retrospektywnymi (6, 18). Nasze wyniki opierały się na badaniu przez wyspecjalizowanych ortoptystów. Większość nowych zaburzeń motoryki oka była łagodna i możliwa do wykrycia tylko w szczegółowym badaniu motoryki oka i dlatego mogła zostać przeoczona w innych badaniach. Kolejnym ograniczeniem jest zakres czasowy, w którym odbywały się pooperacyjne badania kontrolne. Ponieważ wiadomo, że móżdżek ma niezwykłe zdolności kompensacyjne, mogło to wpłynąć na nasze wyniki. Podczas pierwszego badania pooperacyjnego dwóch pacjentów przyjmowało tyldę jako środek przeciwbólowy, która jak wiadomo wpływa na płynność ruchów (23). Dlatego też nie można obecnie wykluczyć interakcji medycznych. To badanie było eksploracyjne bez korekcji dla wielokrotnego testowania, które mogło wpłynąć na znaczenie testu SCAFI.
Dekompresja podpotyliczna obejmująca redukcję jednego migdałka móżdżku może prowadzić do podobnych ocznych deficytów motorycznych jak w zawałach niedokrwiennych; jednakże prawie wszyscy nasi pacjenci byli bezobjawowi. Z subiektywną i kliniczną poprawą u 9/10 naszych pacjentów, możemy promować resekcję jednego migdałka móżdżku, jeśli wielkość migdałka lub stopień przesunięcia w dół czyni to koniecznym. Neuroanatomicznie, nasze wyniki potwierdzają rolę migdałka w smooth pursuit i sieci utrzymywania spojrzenia (8, 24). W naszym badaniu zastosowano jednak złożony zabieg neurochirurgiczny polegający na odbarczeniu okolicy podpotylicznej z redukcją migdałka, co wyklucza precyzyjną lokalizację anatomiczną. Deficyty przedsionkowe wskazują na zaburzenia równowagi tonalnej dla kanału półkolistego i układu otolitowego, które są typowo lokalizowane w płacie lub pniu mózgu (25). Podsumowując, jest to pierwsze prospektywne badanie kliniczne dotyczące wpływu jednostronnej resekcji migdałka móżdżku na motorykę oka, funkcje przedsionkowe i móżdżkowe. Chirurgiczna dekompresja, w tym jednostronna redukcja/resekcja migdałka móżdżkowego, prowadzi do dobrego wyniku klinicznego w zakresie dolegliwości pacjentów, drobnych zdolności motorycznych i chodu bez wpływu strony resekowanego migdałka.
Niemniej jednak, szczegółowe badanie pooperacyjne może wykazać zaburzenia motoryki oka podobne do tych wynikających z zawałów niedokrwiennych (deficyty płynnej gonitwy, oczopląs wywołany spojrzeniem poziomym, oczopląs z odbicia i DBN oraz odchylenie SVV), potwierdzając anatomiczną rolę migdałka w płynnej gonitwie i sieci utrzymywania spojrzenia; jednakże objawy są łagodne i bezobjawowe w naszej kohorcie pacjentów z Chiari.
Oświadczenie etyczne
Badanie to przeprowadzono zgodnie z zaleceniami Institutional Review Board komisji etycznej Uniwersytetu Ludwig-Maximilian w Monachium za pisemną świadomą zgodą wszystkich badanych. Wszyscy badani wyrazili pisemną świadomą zgodę zgodnie z Deklaracją Helsińską. Protokół został zatwierdzony przez Institutional Review Board of the ethics committee of the Ludwig-Maximilian University Munich. Wskazania do interwencji chirurgicznej zostały przedstawione niezależnie od udziału w tym badaniu.
Wkład autorów
NG: projekt badawczy (koncepcja, organizacja, wykonanie, interpretacja danych), analiza statystyczna (projekt, wykonanie), przygotowanie manuskryptu (napisanie pierwszego projektu, recenzja). KF: projekt badawczy (koncepcja, organizacja, wykonanie), przygotowanie manuskryptu (recenzja i krytyka). FI i MK: projekt badawczy (wykonanie), przygotowanie manuskryptu (recenzja). SK: projekt badawczy (interpretacja danych), przygotowanie manuskryptu (recenzja). JT: projekt badawczy (pomysł na badanie, koncepcja, interpretacja danych), przygotowanie manuskryptu (recenzja i krytyka). MS: projekt badawczy (pomysł na badanie, koncepcja, interpretacja danych), przygotowanie manuskryptu (recenzja i krytyka), w tym medical writing for content. AP: projekt badawczy (koncepcja, organizacja, wykonanie, interpretacja danych), przygotowanie manuskryptu (recenzja i krytyka), w tym pisanie tekstów medycznych dla treści.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Autorzy dziękują Katie Göttlinger za skopiowanie tego manuskryptu, Monie Klemm za badanie ortoptyczne pacjentów oraz Andrei Lehner-Bauer za testy kaloryczne.
Finansowanie
To badanie było wspierane przez Niemieckie Ministerstwo Edukacji i Badań Naukowych (BMBF), grant 01EO1401 dla Niemieckiego Centrum Vertigo i Zaburzeń Równowagi (DSGZ).
Materiały uzupełniające
1. Batzdorf U, McArthur DL, Bentson JR. Surgical treatment of Chiari malformation with and without syringomyelia: experience with 177 adult patients. J Neurosurg (2013) 118(2):232-42. doi:10.3171/2012.10.JNS12305
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Arnautovic A, Splavski B, Boop FA, Arnautovic KI. Pediatric and adult Chiari malformation type I surgical series 1965-2013: a review of demographics, operative treatment, and outcomes. J Neurosurg Pediatr (2015) 15(2):161-77. doi:10.3171/2014.10.PEDS14295
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Guyotat J, Bret P, Jouanneau E, Ricci AC, Lapras C. Syringomyelia associated with type I Chiari malformation. A 21-year retrospective study on 75 cases treated by foramen magnum decompression with a special emphasis on the value of tonsils resection. Acta Neurochir (Wien) (1998) 140(8):745-54. doi:10.1007/s007010050175
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Liebenberg WA, Georges H, Demetriades AK, Hardwidge C. Does posterior fossa decompression improve oculomotor and vestibulo-ocular manifestations in Chiari 1 malformation? Acta Neurochir (Wien) (2005) 147(12):1239-40; dyskusja 40. doi:10.1007/s00701-005-0612-5
CrossRef Full Text | Google Scholar
9. Dieterich M, Brandt T. Ocular torsion and tilt of subjective visual vertical are sensitive brainstem signs. Ann Neurol (1993) 33(3):292-9. doi:10.1002/ana.410330311
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Bremova T, Bayer O, Agrawal Y, Kremmyda O, Brandt T, Teufel J, et al. Ocular VEMPs indicate repositioning of otoconia to the utricle after successful liberatory maneuvers in benign paroxysmal positioning vertigo. Acta Otolaryngol (2013) 133(12):1297-303. doi:10.3109/00016489.2013.829922
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jacobson GP, Newman CW. Rozwój Inwentarza Handicapu Zawrotów Głowy. Arch Otolaryngol Head Neck Surg (1990) 116(4):424-7. doi:10.1001/archotol.1990.01870040046011
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Zwergal A, la Fougere C, Lorenzl S, Rominger A, Xiong G, Deutschenbaur L, et al. Postural imbalance and falls in PSP correlate with functional pathology of the thalamus. Neurology (2011) 77(2):101-9. doi:10.1212/WNL.0b013e318223c79d
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Klekamp J. Surgical treatment of Chiari I malformation – analysis of intraoperative findings, complications, and outcome for 371 foramen magnum decompressions. Neurosurgery (2012) 71(2):365-80; discussion 80. doi:10.1227/NEU.0b013e31825c3426
CrossRef Full Text | Google Scholar
20. Zee DS, Yamazaki A, Butler PH, Gucer G. Effects of ablation of flocculus and paraflocculus of eye movements in primate. J Neurophysiol (1981) 46(4):878-99.
Google Scholar
22. Leigh RJ, Zee DS. The Neurology of Eye Movements. New York: Oxford University Press (2006).
Google Scholar
23. Thömke F. Augenbewegungsstörungen – Ein klinischer Leitfaden für Neurologen. 2nd ed. Stuttgart: Thieme (2008).
Google Scholar
24. Nagao S. Different role of flocculus and ventral paraflocculus for oculomotor control in the primate. Neuroreport (1992) 3(1):13-6. doi:10.1097/00001756-199201000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
.