- Introducción
- Materiales y métodos
- Examen clínico de los pacientes
- Aprobaciones del protocolo estándar ético, registro y consentimiento del paciente
- Intervención neuroquirúrgica
- Análisis estadístico
- Resultados
- Características y síntomas de los pacientes
- Síntomas, signos clínicos y hallazgos 1 semana después de la cirugía
- Síntomas, signos clínicos y hallazgos 3 meses después de la cirugía
- Discusión
- Declaración ética
- Contribuciones de los autores
- Declaración de conflicto de intereses
- Agradecimientos
- Financiación
- Material complementario
Introducción
La malformación de Chiari comprende un grupo de entidades patológicas caracterizadas por la presencia de deformidades anatómicas del cerebelo y del tronco cerebral. Los síntomas típicos incluyen cefaleas occipitales, que se exacerban al toser; alteraciones motoras y/o sensoriales, especialmente del miembro superior; y torpeza (1, 2).
El tratamiento actual incluye una descompresión de la región suboccipital para ampliar el diámetro del foramen magnum y la resección del arco posterior de C1. Pero ha habido mucha discusión crítica sobre si se debe abrir la aracnoides y extirpar también las amígdalas cerebelosas (3). Los riesgos postoperatorios de este procedimiento parecen ser mayores, incluyendo la formación de pseudomeningocele e higroma, meningitis y cefaleas (2). Por otro lado, es más probable que se produzca una descompresión suficiente del tronco cerebral cuando se manipulan la aracnoides y las amígdalas (1, 4) (detalles en la hoja de datos S1 del material suplementario). Los datos sobre el resultado clínico tras el tratamiento quirúrgico varían debido a los diferentes métodos quirúrgicos, cohortes de pacientes y síntomas. En diferentes estudios se ha descrito una mejora clínica y de la vida diaria en el 50-75% de los pacientes (2, 3). Las disfunciones motoras oculares mejoraron en el 75-100% de los pacientes (5-7).
Las experiencias con lesiones cerebelosas, es decir, debidas a infartos isquémicos, nos enseñan que las lesiones amigdalinas pueden provocar importantes déficits motores oculares que causan vértigo incapacitante (8). Sin embargo, aún no se ha examinado sistemáticamente el efecto de la amigdalectomía unilateral sobre la función motora ocular y cerebelosa. El objetivo principal de nuestro estudio fue evaluar si el procedimiento quirúrgico de descompresión suboccipital, que incluye la reducción de una amígdala cerebelosa, provoca déficits motores oculares, vestibulares o cerebelosos en pacientes con malformación de Chiari tipo I.
Materiales y métodos
Examen clínico de los pacientes
Cuatro pacientes consecutivos con evidencia radiológica de malformación de Chiari tipo 1 fueron seleccionados para este estudio en los Departamentos de Neurología y Neurocirugía del Hospital Universitario de Munich. Tres pacientes tenían signos clínicos leves y fueron tratados de forma conservadora. Once se sometieron a una intervención quirúrgica con resección o reducción de una amígdala cerebelosa y se incluyeron en el estudio. Un paciente se perdió en el seguimiento.
Los pacientes fueron examinados antes y en dos momentos después de la intervención quirúrgica: uno directamente después y otro en el seguimiento aproximadamente 3 meses después de la cirugía. Los pacientes recibieron un cuestionario estandarizado para las quejas típicas. Se preguntó a los pacientes sobre la cefalea o el dolor de cuello (tipo y factores que lo provocan), la inestabilidad de la marcha, el vértigo o el mareo (tipo y factores que lo provocan), los problemas visuales, los problemas audiológicos, los signos motores, los déficits sensoriales y los déficits de los nervios craneales inferiores.
El examen consistió en una exploración neurológica, neurooftalmológica y neurootológica estandarizada. Incluía la prueba de empuje de la cabeza, la evaluación del nistagmo espontáneo con las gafas de Frenzel en posición primaria y durante la desviación de la mirada, el seguimiento suave, las sacadas, el nistagmo optocinético, la supresión de la fijación visual del reflejo vestíbulo-ocular (VOR), el nistagmo de sacudida de la cabeza y la determinación de la vertical visual subjetiva (SVV). Las desviaciones superiores a 2,5° se consideraron patológicas (9). La función cerebelosa se evaluó mediante escalas de calificación de la ataxia, a saber, la Escala de Evaluación y Calificación de la Ataxia (SARA) (10) y el Índice Funcional de la Ataxia Espinocerebelosa (SCAFI) (11). Durante el seguimiento de 3 meses, la función vestibular se examinó neurofisiológicamente con pruebas calóricas bitérmicas utilizando el EyeSeeCam System® (diferencia lateral patológica según la fórmula de Jongkee superior al 25%) y potenciales miogénicos vestibulares oculares conducidos por aire y por hueso (c/oVEMP) utilizando el Interacoustics Eclipse System® (12). La relación de asimetría , debe ser inferior al 35% (13). Las mediciones posturográficas se realizaron en posición vertical utilizando el protocolo estándar con 10 condiciones diferentes con dificultad creciente (14). La mejora subjetiva se midió con una entrevista. Se preguntó a los pacientes, en relación con todas las quejas, si habían mejorado sus síntomas 3 meses después de la intervención. El deterioro subjetivo con respecto al vértigo y el mareo se midió con el Inventario de Dificultades de Mareo (DHI) (15, 16). El DHI es un inventario de autoevaluación con una puntuación mínima de 0 y una puntuación máxima de 100 (impacto máximo del mareo en la vida diaria). La puntuación de cambio clínicamente relevante entre el pre y el postratamiento en el trabajo original es de 18 (16). A todos los pacientes se les realizó una RMN postoperatoria rutinaria a los 3 meses. En el caso de la siringe existente, se midió el tamaño (longitud y diámetro en milímetros) y se comparó con las resonancias magnéticas preoperatorias.
Aprobaciones del protocolo estándar ético, registro y consentimiento del paciente
Este estudio se llevó a cabo de acuerdo con las recomendaciones de la Junta de Revisión Institucional del comité ético de la Universidad Ludwig-Maximilian de Múnich con el consentimiento informado por escrito de todos los sujetos. Todos los sujetos dieron su consentimiento informado por escrito de acuerdo con la Declaración de Helsinki. El protocolo fue aprobado por la Junta de Revisión Institucional del comité de ética de la Universidad Ludwig-Maximilian de Múnich. La indicación de la intervención quirúrgica se proporcionó independientemente de la participación en este estudio.
Intervención neuroquirúrgica
Los pacientes se sometieron a una monitorización electrofisiológica intraoperatoria de los nervios craneales inferiores, los potenciales evocados motores y los potenciales evocados somatosensoriales para evitar un efecto adicional en el tronco cerebral como resultado de la inclinación exagerada de la cabeza. En la posición de decúbito prono, la cabeza del paciente se fijó en una pinza de Mayfield. La intervención quirúrgica consistió en una disección medial suboccipital del músculo del cuello exponiendo el arco de C1 y el occipucio alrededor del foramen magnum. En primer lugar, se amplió el foramen magnum mediante una craniectomía osteoclástica de aproximadamente 3 cm × 4 cm, cuya anchura se adaptó al tamaño del foramen magnum. A continuación, se realizó una laminectomía del arco de C1 con la misma anchura del canal espinal. La ecografía intraoperatoria permitía visualizar las puntas de las amígdalas para descomprimir hasta donde fuera necesario. A veces era necesaria una laminotomía del borde superior del arco de C2. Nunca se realizó una laminectomía de C2 para evitar la inestabilidad cervical. A continuación, se abrió la duramadre en forma de «Y» y se suturó al periostio del occipucio. Tras una cuidadosa disección de la aracnoides, se identificó la amígdala cerebelosa más larga y grande, así como el tronco cerebral inferior y la médula espinal. La amígdala identificada se redujo primero mediante la coagulación de la superficie externa y medial sin afectar a los vasos intracraneales. Se realizó una incisión en la pia de la amígdala coagulada y se extrajo el tejido amigdalino mediante una suave succión y coagulación bipolar. Finalmente, la amígdala reducida se colocó a nivel del foramen magnum. El volumen medio de tejido amigdalar resecado osciló entre 0,6 y 2,7 cm3 (media de 1,4 cm3, DE 0,6 cm3). Por último, se inspeccionó la región del obex para proporcionar una salida libre del canal central dentro de la médula espinal siempre que fuera posible de forma segura. Para ampliar aún más el espacio craneocervical, se implantó un sustituto dural (Lyoplant®, B. Braun) y se suturó de forma estanca. Por último, la herida se cerró meticulosamente en varias capas, por ejemplo, los músculos, la fascia, el subcutis y el cutis para evitar la fuga de LCR.
Análisis estadístico
El análisis estadístico se realizó con el programa SPSS Statistics 20 (IBM, Armonk, NY, EE.UU.). Como los datos no estaban distribuidos normalmente, se realizaron pruebas no paramétricas por pares utilizando la prueba de pares emparejados de Wilcoxon para comparar dos muestras relacionadas y la prueba U de Mann-Whitney para las comparaciones entre grupos. Las diferencias se consideraron significativas si p < 0,05. El diseño de este estudio fue exploratorio.
Resultados
Características y síntomas de los pacientes
En este estudio se incluyeron diez pacientes con una malformación de Chiari tipo 1 confirmada por RMN (6 mujeres, edad media de 37 años, rango de 18 a 57). Los valores siguientes son valores medios ± desviación estándar. Los participantes fueron examinados en el preoperatorio (27 ± 48 días antes de la cirugía; rango de 1 día a 5 meses, n = 10) y en dos momentos después de la intervención quirúrgica. Para más detalles sobre los datos clínicos, véase la Tabla 1. En nuestra cohorte, la duración media de los síntomas fue de 4 ± 3 años (rango de 3 meses a 11 años). El tiempo transcurrido entre el inicio de los síntomas y el diagnóstico correcto fue de 3 ± 3 años (rango de 3 meses a 10 años). En la RMN, la siringomielia estaba presente en el 70% de los pacientes. El descenso de la amígdala osciló entre 0,7 y 2,2 cm (media de 1,4 cm, DE 0,6 cm). La longitud de la siringomielia variaba entre uno y más de 10 segmentos vertebrales, el tamaño entre 1,5 y 0,3 mm de diámetro máximo. La figura 1 muestra al paciente número cuatro con una siringomielia importante debida a una malformación de Chiari tipo I antes y después de la operación.
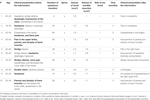
Tabla 1. Presentación clínica y evolución tras la intervención quirúrgica.
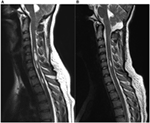
Figura 1. Siringomielia por malformación de Chiari tipo I antes (A) y 3 meses después (B) de la descompresión quirúrgica. (A) Esta mujer de 19 años se quejaba de cefalea occipital, hipoestesia de los miembros superiores, así como ataques de vértigo. Las imágenes preoperatorias de RMN sagital ponderada en T2 demuestran el descenso de las amígdalas hasta el margen inferior del arco de C2 y una significativa siringomielia multicompartimental en la médula espinal cervical. (B) Las imágenes de RM postoperatoria destacan claramente una marcada reducción de la siringe preexistente, así como una reducción de la longitud amigdalina en el foramen magnum. El paciente informó de una notable mejoría de los síntomas tras la descompresión quirúrgica.
Los principales síntomas eran ataques recurrentes de vértigo o mareo (60%), cefalea y dolor de cuello, que empeoraba al toser y al realizar movimientos específicos de la cabeza (50%) y dis/hipestesia en las extremidades superiores (50%).
En cuanto a las características clínico-neurológicas, los principales hallazgos fueron ataxia en los miembros superiores (dismetría de persecución de dedos, temblor de intención, disdiadococinesis) (6/10 pacientes) y dis- e hipoestesia (5/10 pacientes). Para más detalles del examen clínico, véase la Tabla 2 (A).
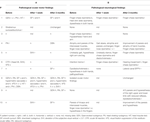
Tabla 2. Hallazgos oculares motores (A) y neurológicos (B) antes y después de la intervención quirúrgica.
En el examen neurooftalmológico, cinco pacientes presentaban hallazgos motores oculares anormales, incluyendo nistagmo con sacudida de cabeza (n = 3), nistagmo evocado por la mirada, supresión de fijación perturbada del VOR, prueba de impulso cefálico patológico (cada uno n = 2), desviación del SVV, inclinación de la cabeza, sacadas hipermetrópicas, nistagmo de rebote, persecución suave sacádica y nistagmo descendente (DBN) (cada uno n = 1). Para más información, véase la Tabla 2 (B).
Los pacientes tenían déficits cerebelosos leves en las puntuaciones examinadas. La puntuación total media de SARA fue de 0,6 ± 0,9 (la puntuación va de 0 = sin ataxia a 40 = ataxia grave). La media del 8MW fue de 5,1 ± 0,5 s. La prueba de la clavija de 9 agujeros (9HPT) de la mano dominante fue de 20,1 ± 2,2 s y de la mano no dominante de 21,3 ± 2,6 s. La media del PATA fue de 27,9 ± 3,9. Para más información, véase la Tabla 3.

Tabla 3. Función cerebelosa evaluada por la Escala para la Evaluación y Calificación de la Ataxia (SARA) y el Índice Funcional de Ataxia Espinocerebelosa (SCAFI) antes y después de la intervención quirúrgica.
Nueve de 10 pacientes se sometieron a pruebas calóricas antes de la intervención quirúrgica, ocho o/cVEMP. Seis pacientes tenían una función vestibular anormal en estas pruebas: tres pacientes (nº 2, 3 y 7) tenían una diferencia lateral patológica en las pruebas calóricas, lo que sugería un déficit en la función del canal horizontal; otros tres pacientes tenían pruebas de o/cVEMP patológicas, lo que indicaba un déficit en la función de los otolitos (nº 1, 9 y 10).
La media total del DHI era de 17 (rango 0-70), lo que sugería una discapacidad leve. Para más información, véase la Tabla 4.

Tabla 4. Pruebas vestibulares de la función del canal horizontal (prueba calórica), sacular , y utricular, así como el deterioro subjetivo, medido por el Inventario de Mareos (DHI), antes y 3 meses después de la intervención quirúrgica.
Los pacientes tenían una tendencia a un peor rendimiento en la posturografía en comparación con los controles sanos publicados en otros estudios en nuestro centro (17). De pie en suelo firme, nueve de cada 10 pacientes mostraron un patrón de balanceo similar al vértigo postural fóbico en red artificial (14). Para más información, véase la Tabla 5.

Tabla 5. Extracto de los datos de posturografía con balanceo total y direccional, raíz cuadrada media (RMS), así como transformación rápida de Fourier (FFT) antes y después de la intervención quirúrgica en cuatro exámenes seleccionados.
Síntomas, signos clínicos y hallazgos 1 semana después de la cirugía
El examen neurooftalmológico reveló una desviación del SVV hacia la derecha tras la resección de la amígdala izquierda (paciente nº 5 5,2º y paciente nº 10 4,5º) y nuevos déficits de seguimiento suave (nº 1). Para más información, véase la tabla 2.
Síntomas, signos clínicos y hallazgos 3 meses después de la cirugía
La descompresión suboccipital suficiente condujo a una mejora de los síntomas (medida con una entrevista relativa a todos los síntomas antes de la intervención) en 9/10 de los pacientes en seguimiento sin influencia del lado de la amígdala resecada. Dos pacientes no tenían quejas después de la intervención neuroquirúrgica (nº 1, 2). Los síntomas mejoraron en siete pacientes (nº 3-8, nº 10). Un paciente tuvo complicaciones importantes debido a la fuga de LCR y la posterior meningitis. Necesitó una revisión quirúrgica por la fuga dural, y los síntomas mejoraron lentamente durante varias semanas (nº 9). En el seguimiento, tenía una leve hemiparesia derecha residual. No hubo otras complicaciones en ninguno de los otros pacientes. El tamaño y la longitud de la siringomielia preexistente disminuyeron en todos los pacientes. Para más información, véanse las Tablas 1 y 2 (B).
Neurooftalmológicamente, el nistagmo con sacudida de cabeza, el VOR, la reacción de inclinación ocular y el DBN mejoraron en todos los pacientes afectados. Se pudo observar una mejora parcial en el nistagmo provocado por la mirada y la supresión de la fijación del VOR.
Las nuevas alteraciones motoras oculares después de la cirugía fueron déficits de persecución suave (nº 1, 7, 9, 10), DBN (nº 4), y nistagmo evocado por la mirada y nistagmo de rebote (nº 9). Todos estos pacientes estaban asintomáticos. El paciente número 9, con complicaciones postoperatorias importantes, presentó nuevas disfunciones vestibulocerebelosas, como nistagmo provocado por la mirada, nistagmo de rebote, déficit de persecución suave vertical y déficit vestibular en las pruebas calóricas, y comunicó una mayor afectación en el DHI. Para más información, véanse la Tabla 2 (A) y la Tabla 4.
Los dos pacientes con cVEMP patológico mejoraron, al igual que uno de los tres pacientes con pruebas calóricas anormales. La media del DHI mejoró de 17 a 6 después de la intervención quirúrgica (p = 0,273), especialmente en base a dos pacientes (nº 2, 6), que tuvieron una mejora significativa del deterioro por vértigo y mareo. Para más resultados, véase la Tabla 4.
En las mediciones posturográficas después de la cirugía, el balanceo total (y los valores RMS) no cambiaron significativamente. No hubo un balanceo cerebeloso típico de 3 Hz. Para más información, véase la Tabla 5.
Discusión
Los principales hallazgos de este estudio prospectivo son los siguientes.
En primer lugar, el examen neurooftalmológico preoperatorio reveló hallazgos anormales en el 50% de los pacientes, incluyendo nistagmo de sacudida de cabeza, nistagmo evocado por la mirada, supresión de fijación alterada del VOR, desviación del SVV, inclinación de la cabeza, sacadas hipermetrópicas, nistagmo de rebote, seguimiento suave sacádico y DBN. El 70% de los pacientes tenían una función vestibular anormal: dos pacientes tenían una prueba de impulso cefálico patológica que indicaba un déficit de alta frecuencia del VOR, tres pacientes tenían una prueba calórica patológica que probaba la función de baja frecuencia del VOR y tres tenían una función otolítica anormal probada con potenciales miogénicos evocados por el vestibular.
Los pacientes sólo tenían signos cerebelosos de leves a moderados (especialmente dismetría de persecución de dedos). Los síntomas clínicos de nuestros pacientes de Chiari fueron similares a los de otros estudios (1, 2, 18), excepto por los síntomas vestibulares más elevados, lo que apoya los resultados anteriores de que la detección es mayor en los departamentos especializados en neuro-otología (6). En un estudio con 77 pacientes de Chiari en un departamento especializado durante varios años, el 55% de los pacientes mostraron anomalías preoperatorias en los exámenes del sistema motor ocular, incluyendo nistagmo horizontal espontáneo (27%), seguimiento suave sacádico (29%), nistagmo posicional inducido (21%), dismetría sacádica (10%) y DBN (7%) (18). El gran número de pacientes con nistagmo horizontal espontáneo no pudo ser reproducido por nuestros datos, a pesar de que tres pacientes (39%) tenían un nistagmo horizontal de sacudida de cabeza, lo que sugiere que el almacenamiento de velocidad estaba afectado.
En segundo lugar, la intervención quirúrgica, incluyendo la amigdalectomía, condujo a una mejora subjetiva y objetiva de los síntomas en 9/10 de los pacientes. La motricidad fina y la marcha medida con SCAFI mejoraron significativamente. El deterioro de la función vestibular (canal horizontal, sacular y utricular) mejoró en cinco de los siete pacientes con deterioro de la función antes de la cirugía, especialmente en cuanto a la función del VOR de alta frecuencia y la función del otolito sacular. Las alteraciones motoras oculares mejoraron en todos los pacientes afectados en términos de nistagmo con sacudida de cabeza, VOR, reacción de inclinación ocular y DBN. En algunos pacientes, se observó una mejora adicional en cuanto al nistagmo provocado por la mirada y la supresión de la fijación del VOR.
La mejora subjetiva en nuestra serie supera la de las series de casos y las revisiones que generalmente muestran una mejora de alrededor del 75% (3). Sin embargo, la resección amigdalina se describió sólo en el 27% de los pacientes con descompresión suboccipital según una revisión sobre una serie quirúrgica entre 1965 y 2013 (3). En otra serie de 177 pacientes, sometidos a cirugía de la fosa posterior, los 137 pacientes sometidos a resección amigdalar con cisternas subaracnoideas posteriores más grandes mostraron una reducción más pronunciada del tamaño de la siringomielia y posteriormente una mayor mejoría de sus síntomas (1). En otro estudio observacional sobre 77 pacientes, la resección amigdalina tuvo buenos resultados en el 100% en comparación con el 64,8% en los que sólo se realizó la descompresión del foramen magnum (4). En una gran serie de 371 pacientes que utilizaron la descompresión de la fosa posterior sin resección amigdalar, se describió una mejora de los síntomas preoperatorios sólo en el 73,6% de los pacientes (19).
En tercer lugar, el examen neurooftalmológico después de la descompresión suboccipital, incluida la reducción amigdalar, reveló nuevos déficits motores oculares, aunque en su mayoría asintomáticos, en cinco pacientes, incluidos déficits de persecución suave, nistagmo evocado por la mirada horizontal, nistagmo de rebote y DBN. La desviación contralateral (hacia el lado de la reducción amigdalina) del SVV fue temporal en el 20% de los pacientes y se compensó en el seguimiento. Estudios retrospectivos anteriores sobre las manifestaciones vestíbulo-oculares en la malformación de Chiari o la siringomielia mostraron una notable resolución de los trastornos motores oculares del 75-100% tras la descompresión sin amigdalectomía (5-7). El procedimiento quirúrgico en estas series consistía en la descompresión del foramen magnum y la laminectomía de C1, incluida la duroplastia, sin resección amigdalar. Por otra parte, el examen motor ocular, que no fue realizado por neurooftalmólogos especializados, no fue tan detallado y estandarizado como en nuestra serie.
Hasta ahora no ha habido publicaciones sobre los efectos secundarios motores oculares, cerebelosos y vestibulares de la descompresión suboccipital con reducción unilateral de la amígdala cerebelosa, que se considera en los estudios neuroanatómicos como una parte importante del vestibulocerebelo. En experimentos con animales, las lesiones quirúrgicas del flóculo y el parafóculo condujeron a una alteración de la persecución suave, el nistagmo provocado por la mirada horizontal, el nistagmo de rebote y el DBN (20).
En nuestro estudio, describimos nuevos déficits motores oculares después de la descompresión suboccipital con reducción de una amígdala cerebelosa, incluyendo déficits de seguimiento suave, nistagmo evocado por la mirada horizontal, nistagmo de rebote y DBN, así como desviación contralateral del SVV. Como se ha descrito, estos hallazgos son coherentes con los estudios en animales. Un informe de un caso que describe a un paciente con infarto unilateral agudo de la amígdala cerebelosa mostró una alteración del seguimiento suave, un nistagmo ipsilateral, un nistagmo evocado por la mirada y una leve inclinación contralateral del SVV (8). En resumen, nuestros resultados demuestran que la amígdala humana parece contribuir principalmente al seguimiento suave y a la red de mantenimiento de la mirada (8). Esto está respaldado por los estudios de conectividad anatómica, ya que el parafloculus recibe principalmente la entrada de los núcleos pontinos contralaterales (21), el núcleo olivar inferior contralateral y el tracto paramediano, lo que sugiere una función importante en el control motor ocular adaptativo y la red integradora neural (22).
¿Por qué los déficits después de una amigdalectomía unilateral son tan moderados en comparación con los hallazgos clínicos incluso después de pequeños infartos amigdalinos? Una explicación probable podría ser que la función ya ha sido deteriorada debido a la compresión y este déficit ya ha sido compensado centralmente. Además, el tamaño de la lesión amigdalar perioperatoria era menor.
Somos conscientes de las limitaciones de nuestro estudio. En primer lugar, el diseño es prospectivo pero no controlado. Las decisiones neuroquirúrgicas intraoperatorias, es decir, en el lado de la amígdala reducida, no fueron aleatorias. El número de pacientes es bastante reducido (n = 10) en comparación con los estudios retrospectivos (6, 18). Nuestros resultados se basaron en el examen realizado por ortoptistas especializados. La mayoría de las nuevas disfunciones motoras oculares eran leves y sólo detectables en un examen motor ocular detallado, por lo que podrían pasar desapercibidas en otros estudios. Otra limitación es el intervalo de tiempo en el que se realizaron los exámenes de seguimiento postoperatorio. Como se sabe que el cerebelo tiene una notable capacidad de compensación, esto podría haber influido en nuestros resultados. Durante el primer examen postoperatorio, dos pacientes estaban tomando tilidina como analgésico, que se sabe que afecta al seguimiento suave (23). Por lo tanto, no se pueden descartar las interacciones médicas en este momento. Este estudio fue exploratorio sin corrección por pruebas múltiples, lo que podría haber influido en la significación de la prueba SCAFI.
La descompresión suboccipital que incluye la reducción de una amígdala cerebelosa puede provocar déficits motores oculares similares a los de los infartos isquémicos; sin embargo, casi todos nuestros pacientes estaban asintomáticos. Con una mejora subjetiva y clínica en 9/10 de nuestros pacientes, podemos promover la resección de una amígdala cerebelosa si el tamaño de la amígdala o el grado de desplazamiento hacia abajo lo hacen necesario. Desde el punto de vista neuroanatómico, nuestros resultados confirman el papel de la amígdala en la persecución suave y la red de mantenimiento de la mirada (8, 24). Sin embargo, nuestro estudio incluye un procedimiento neuroquirúrgico complejo con descompresión de la región suboccipital que incluye la reducción amigdalina, lo que excluye una localización anatómica precisa. Los déficits vestibulares indican un desequilibrio del tono del canal semicircular y del sistema otolítico, que suele localizarse en el flóculo o el tronco cerebral (25). En resumen, éste es el primer estudio clínico prospectivo sobre el efecto de la resección unilateral de la amígdala cerebelosa en la función motora ocular, vestibular y cerebelosa. La descompresión quirúrgica, incluida la reducción/resección unilateral de la amígdala cerebelosa, conduce a un buen resultado clínico en cuanto a las quejas de los pacientes, la motricidad fina y la marcha, sin ningún efecto del lado de la amígdala resecada.
Sin embargo, un examen postoperatorio detallado puede mostrar trastornos motores oculares similares a los resultantes de los infartos isquémicos (déficits de persecución suave, nistagmo evocado por la mirada horizontal, nistagmo de rebote y DBN, así como desviación del SVV), lo que confirma el papel anatómico de la amígdala en la persecución suave y la red de mantenimiento de la mirada; sin embargo, los síntomas son leves y asintomáticos en nuestra cohorte de pacientes de Chiari.
Declaración ética
Este estudio se llevó a cabo de acuerdo con las recomendaciones de la Junta de Revisión Institucional del comité de ética de la Universidad Ludwig-Maximilian de Múnich con el consentimiento informado por escrito de todos los sujetos. Todos los sujetos dieron su consentimiento informado por escrito de acuerdo con la Declaración de Helsinki. El protocolo fue aprobado por la Junta de Revisión Institucional del comité de ética de la Universidad Ludwig-Maximilian de Múnich. La indicación de la intervención quirúrgica se proporcionó independientemente de la participación en este estudio.
Contribuciones de los autores
NG: proyecto de investigación (concepción, organización, ejecución, interpretación de los datos), análisis estadístico (diseño, ejecución), preparación del manuscrito (redacción del primer borrador, revisión). KF: proyecto de investigación (concepción, organización, ejecución), preparación del manuscrito (revisión y crítica). FI y MK: proyecto de investigación (ejecución), preparación del manuscrito (revisión). SK: proyecto de investigación (interpretación de los datos), preparación del manuscrito (revisión). JT: proyecto de investigación (idea para el estudio, concepción, interpretación de los datos), preparación del manuscrito (revisión y crítica). MS: proyecto de investigación (idea para el estudio, concepción, interpretación de los datos), preparación del manuscrito (revisión y crítica), incluida la redacción médica del contenido. AP: proyecto de investigación (concepción, organización, ejecución, interpretación de los datos), preparación del manuscrito (revisión y crítica) incluyendo la redacción médica del contenido.
Declaración de conflicto de intereses
Los autores declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Los autores agradecen a Katie Göttlinger la corrección de este manuscrito, a Mona Klemm el examen ortopédico de los pacientes y a Andrea Lehner-Bauer las pruebas calóricas.
Financiación
Este estudio fue apoyado por el Ministerio Alemán de Educación e Investigación (BMBF), subvención 01EO1401 al Centro Alemán de Vértigo y Trastornos del Equilibrio (DSGZ).
Material complementario
1. Batzdorf U, McArthur DL, Bentson JR. Tratamiento quirúrgico de la malformación de Chiari con y sin siringomielia: experiencia con 177 pacientes adultos. J Neurosurg (2013) 118(2):232-42. doi:10.3171/2012.10.JNS12305
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Arnautovic A, Splavski B, Boop FA, Arnautovic KI. Serie quirúrgica de malformación de Chiari tipo I pediátrica y adulta 1965-2013: una revisión de la demografía, el tratamiento quirúrgico y los resultados. J Neurosurg Pediatr (2015) 15(2):161-77. doi:10.3171/2014.10.PEDS14295
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Guyotat J, Bret P, Jouanneau E, Ricci AC, Lapras C. Siringomielia asociada a la malformación de Chiari tipo I. A 21-year retrospective study on 75 cases treated by foramen magnum decompression with a special emphasis on the value of tonsils resection. Acta Neurochir (Wien) (1998) 140(8):745-54. doi:10.1007/s007010050175
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Liebenberg WA, Georges H, Demetriades AK, Hardwidge C. ¿La descompresión de la fosa posterior mejora las manifestaciones oculomotoras y vestibulooculares en la malformación de Chiari 1? Acta Neurochir (Wien) (2005) 147(12):1239-40; discusión 40. doi:10.1007/s00701-005-0612-5
CrossRef Full Text | Google Scholar
9. Dieterich M, Brandt T. La torsión ocular y la inclinación de la vertical visual subjetiva son signos sensibles del tronco cerebral. Ann Neurol (1993) 33(3):292-9. doi:10.1002/ana.410330311
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Bremova T, Bayer O, Agrawal Y, Kremmyda O, Brandt T, Teufel J, et al. Los VEMPs oculares indican el reposicionamiento de la otoconia al utrículo después de maniobras liberatorias exitosas en el vértigo paroxístico benigno de posicionamiento. Acta Otolaryngol (2013) 133(12):1297-303. doi:10.3109/00016489.2013.829922
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jacobson GP, Newman CW. The development of the Dizziness Handicap Inventory. Arch Otolaryngol Head Neck Surg (1990) 116(4):424-7. doi:10.1001/archotol.1990.01870040046011
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Zwergal A, la Fougere C, Lorenzl S, Rominger A, Xiong G, Deutschenbaur L, et al. El desequilibrio postural y las caídas en la PSP se correlacionan con la patología funcional del tálamo. Neurology (2011) 77(2):101-9. doi:10.1212/WNL.0b013e318223c79d
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Klekamp J. Tratamiento quirúrgico de la malformación de Chiari I: análisis de los hallazgos intraoperatorios, complicaciones y resultados de 371 descompresiones del foramen magnum. Neurosurgery (2012) 71(2):365-80; discusión 80. doi:10.1227/NEU.0b013e31825c3426
CrossRef Full Text | Google Scholar
20. Zee DS, Yamazaki A, Butler PH, Gucer G. Efectos de la ablación del flóculo y parafóculo de los movimientos oculares en primates. J Neurophysiol (1981) 46(4):878-99.
Google Scholar
22. Leigh RJ, Zee DS. La neurología de los movimientos oculares. Nueva York: Oxford University Press (2006).
Google Scholar
23. Thömke F. Augenbewegungsstörungen – Ein klinischer Leitfaden für Neurologen. 2nd ed. Stuttgart: Thieme (2008).
Google Scholar
24. Nagao S. Different roles of flocculus and ventral paraflocculus for oculomotor control in the primate. Neuroreport (1992) 3(1):13-6. doi:10.1097/00001756-199201000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar