Substâncias e Misturas puras
Uma substância química pura é qualquer matéria que tenha uma composição química fixa e propriedades características. O oxigênio, por exemplo, é uma substância química pura que é um gás incolor e inodoro a 25°C. Muito poucas amostras de matéria consistem em substâncias puras; em vez disso, a maioria são misturas, que são combinações de duas ou mais substâncias puras em proporções variáveis, nas quais as substâncias individuais mantêm a sua identidade. Ar, água da torneira, leite, queijo azul, pão e sujeira são todas misturas. Se todas as porções de um material estão no mesmo estado, não têm limites visíveis e são uniformes em toda a sua totalidade, então o material é homogéneo. Exemplos de misturas homogêneas são o ar que respiramos e a água da torneira que bebemos. As misturas homogêneas também são chamadas de soluções. Assim, o ar é uma solução de nitrogênio, oxigênio, vapor de água, dióxido de carbono e vários outros gases; a água da torneira é uma solução de pequenas quantidades de várias substâncias na água. As composições específicas de ambas as soluções não são fixas, mas dependem da fonte e da localização; por exemplo, a composição da água da torneira em Boise, Idaho, não é a mesma que a composição da água da torneira em Buffalo, Nova Iorque. Embora a maioria das soluções que encontramos sejam líquidas, as soluções também podem ser sólidas. A substância cinza ainda utilizada por alguns dentistas para preencher as cavidades dentárias é uma solução sólida complexa que contém 50% de mercúrio e 50% de um pó que contém principalmente prata, estanho e cobre, com pequenas quantidades de zinco e mercúrio. Soluções sólidas de dois ou mais metais são comumente chamadas ligas.
Se a composição de um material não é completamente uniforme, então é heterogênea (por exemplo, massa de bolacha de chocolate, queijo azul, e sujeira). Misturas que parecem ser homogêneas são frequentemente consideradas heterogêneas após exame microscópico. O leite, por exemplo, parece ser homogêneo, mas quando examinado ao microscópio, é claramente composto de pequenos glóbulos de gordura e proteína dispersos em água. Os componentes das misturas heterogéneas podem geralmente ser separados por meios simples. As misturas sólido-líquido como a areia na água ou as folhas de chá no chá são facilmente separadas por filtração, que consiste em passar a mistura através de uma barreira, como um coador, com orifícios ou poros menores que as partículas sólidas. Em princípio, as misturas de dois ou mais sólidos, como açúcar e sal, podem ser separadas por inspecção microscópica e triagem. Operações mais complexas são geralmente necessárias, como na separação de pepitas de ouro do cascalho do rio por panela. Primeiro o material sólido é filtrado da água do rio; depois os sólidos são separados por inspecção. Se o ouro está incrustado na rocha, ele pode ter que ser isolado usando métodos químicos.
-and-Milk-(left).jpg?revision=1)
Figure 1.2.2: Uma Mistura Heterogénica. Sob um microscópio, o leite integral é na verdade uma mistura heterogênea composta de glóbulos de gordura e proteína dispersos em água. Figura usada com permissão da Wikipedia
Misturas homogêneas (soluções) podem ser separadas em suas substâncias componentes por processos físicos que dependem de diferenças em algumas propriedades físicas, tais como diferenças em seus pontos de ebulição. Dois destes métodos de separação são a destilação e a cristalização. A destilação faz uso de diferenças na volatilidade, uma medida da facilidade com que uma substância é convertida em um gás a uma determinada temperatura. Um simples aparelho de destilação para separar uma mistura de substâncias, pelo menos uma das quais é um líquido. O componente mais volátil ferve primeiro e é condensado de volta a um líquido no condensador arrefecido por água, a partir do qual flui para o recipiente receptor. Se uma solução de sal e água é destilada, por exemplo, o componente mais volátil, água pura, se acumula no recipiente receptor, enquanto o sal permanece no recipiente de destilação.

Figure 1.2.3: A Destilação de uma Solução de Sal de Mesa em Água. A solução de sal em água é aquecida no balão de destilação até ferver. O vapor resultante é enriquecido no componente mais volátil (água), que se condensa a um líquido no condensador frio e depois é recolhido no recipiente de recepção.
Misturas de dois ou mais líquidos com diferentes pontos de ebulição podem ser separadas com um aparelho de destilação mais complexo. Um exemplo é o refino do petróleo bruto em uma gama de produtos úteis: combustível de aviação, gasolina, querosene, diesel e óleo lubrificante (na ordem aproximada de volatilidade decrescente). Outro exemplo é a destilação de bebidas alcoólicas, como o brandy ou o whisky. Este procedimento relativamente simples causou mais do que algumas dores de cabeça para as autoridades federais na década de 1920 durante a era da Proibição, quando alambiques ilegais proliferaram em regiões remotas dos Estados Unidos.
Crystallization separa misturas com base nas diferenças de solubilidade, uma medida de quanta substância sólida permanece dissolvida numa determinada quantidade de um líquido especificado. A maioria das substâncias são mais solúveis a temperaturas mais elevadas, portanto uma mistura de duas ou mais substâncias pode ser dissolvida a uma temperatura elevada e depois deixada arrefecer lentamente. Alternativamente, o líquido, chamado de solvente, pode ser deixado evaporar. Em ambos os casos, o menos solúvel das substâncias dissolvidas, o menos susceptível de permanecer em solução, geralmente forma cristais primeiro, e estes cristais podem ser removidos da solução restante por filtração.

Figure 1.2.4: A Cristalização do Acetato de Sódio a partir de uma Solução Concentrada de Acetato de Sódio em Água. A adição de um pequeno cristal de “semente” (a) faz com que o composto forme cristais brancos, que crescem e eventualmente ocupam a maior parte do frasco. O vídeo pode ser encontrado aqui: https://www.youtube.com/watch?v=BLq5NibwV5g
Muitas misturas podem ser separadas em substâncias puras, que podem ser elementos ou compostos. Um elemento, como o cinza, sódio metálico, é uma substância que não pode ser decomposta em substâncias mais simples por mudanças químicas; um composto, como o cloreto de sódio branco cristalino, contém dois ou mais elementos e tem propriedades químicas e físicas que normalmente são diferentes das dos elementos dos quais é composto. Com poucas excepções, um determinado composto tem a mesma composição elementar (os mesmos elementos nas mesmas proporções) independentemente da sua origem ou história. A composição química de uma substância é alterada em um processo chamado mudança química. A conversão de dois ou mais elementos, como sódio e cloro, em um composto químico, o cloreto de sódio, é um exemplo de mudança química, muitas vezes chamada de reação química. Atualmente, cerca de 115 elementos são conhecidos, mas milhões de compostos químicos foram preparados a partir desses 115 elementos. Os elementos conhecidos estão listados na tabela periódica.
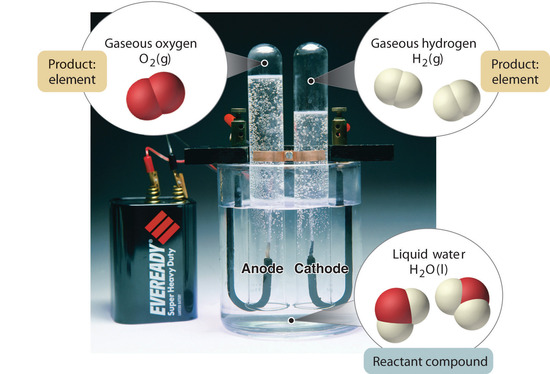
Figure 1.2.5: A Decomposição da Água em Hidrogênio e Oxigênio por Eletrólise. A água é um composto químico; hidrogénio e oxigénio são elementos.
Em geral, um processo químico inverso decompõe os compostos nos seus elementos. Por exemplo, a água (um composto) pode ser decomposta em hidrogênio e oxigênio (ambos os elementos) por um processo de caldelectrólise. Na eletrólise, a eletricidade fornece a energia necessária para separar um composto em seus elementos constituintes (Figura 1.2.5). Uma técnica similar é utilizada em larga escala para obter alumínio puro, um elemento, de seus minérios, que são misturas de compostos. Como uma grande quantidade de energia é necessária para a eletrólise, o custo da eletricidade é de longe o maior gasto incorrido na fabricação do alumínio puro. Assim, a reciclagem do alumínio é economicamente eficiente e ecologicamente correta. A organização geral da matéria e os métodos usados para separar misturas estão resumidos na Figura 1.2.6.
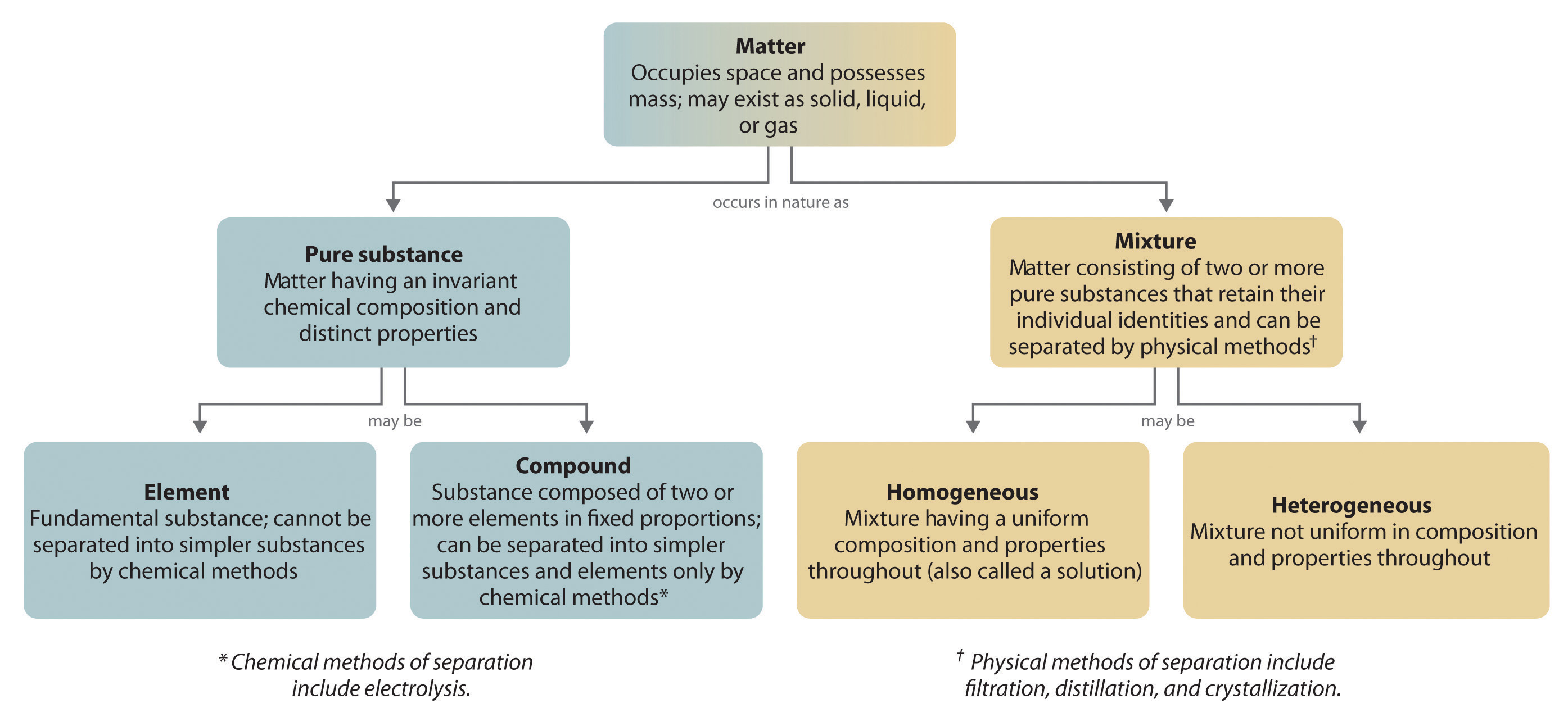
Figure 1.2.6: Relações entre os Tipos de Matéria e os Métodos Utilizados para Separar Misturas
Exemplo 1.2.1
Identificar cada substância como um composto, um elemento, uma mistura heterogênea, ou uma mistura homogênea (solução).
- chá filtrado
- sumo de laranja espremido de fresco
- um disco compacto
- óxido de alumínio, um pó branco que contém um 2:3 proporção de átomos de alumínio e oxigénio
- selenium
Dado: uma substância química
Passado para: a sua classificação
Estratégia:
>
- Decidir se uma substância é quimicamente pura. Se for pura, a substância é ou um elemento ou um composto. Se uma substância pode ser separada em seus elementos, é um composto.
- Se uma substância não é quimicamente pura, é uma mistura heterogênea ou uma mistura homogênea. Se a sua composição é uniforme em toda a sua composição, é uma mistura homogénea.
Solução:
- Um chá é uma solução de compostos em água, por isso não é quimicamente puro. Normalmente é separado das folhas de chá por filtração. B Como a composição da solução é uniforme em toda a sua composição, é uma mistura homogênea.
- A Suco de laranja contém partículas sólidas (polpa) bem como líquido; não é quimicamente puro. B Por sua composição não ser uniforme em toda sua composição, o suco de laranja é uma mistura heterogênea.
- A Um disco compacto é um material sólido que contém mais de um elemento, com regiões de diferentes composições visíveis ao longo de sua borda. Portanto, um disco compacto não é quimicamente puro. B As regiões de composição diferente indicam que um disco compacto é uma mistura heterogênea.
- A Óxido de alumínio é um composto único, quimicamente puro.
- A Selénio é um dos elementos conhecidos.
Exercício 1.2.1
Identificar cada substância como um composto, um elemento, uma mistura heterogênea, ou uma mistura homogênea (solução).
- vinho branco
- mercúrio
- molho de salada ao estilo deranch
- açúcar de mesa (sacarose)
Resposta:
- solução
- elemento
- Mistura heterogénea
- composto
Sumário
Matéria pode ser classificada de acordo com as propriedades físicas e químicas. A matéria é qualquer coisa que ocupa espaço e tem massa. Os três estados da matéria são: sólido, líquido e gás. Uma mudança física envolve a conversão de uma substância de um estado da matéria para outro, sem alterar a sua composição química. A maioria da matéria consiste em misturas de substâncias puras, que podem ser homogêneas (uniformes na composição) ou heterogêneas (regiões diferentes possuem composições e propriedades diferentes). As substâncias puras podem ser compostos químicos ou elementos. Os compostos podem ser decompostos em elementos por reacções químicas, mas os elementos não podem ser separados em substâncias mais simples por meios químicos. As propriedades das substâncias podem ser classificadas como físicas ou químicas. Os cientistas podem observar as propriedades físicas sem alterar a composição da substância, enquanto as propriedades químicas descrevem a tendência de uma substância a sofrer alterações químicas (reacções químicas) que alteram a sua composição química. As propriedades físicas podem ser intensivas ou extensas. As propriedades intensivas são as mesmas para todas as amostras; não dependem do tamanho da amostra; e incluem, por exemplo, cor, estado físico e pontos de fusão e ebulição. As propriedades extensivas dependem da quantidade de material e incluem massa e volume. A razão de duas propriedades extensivas, massa e volume, é uma propriedade intensiva importante chamada densidade.
Contribuidores
Modificado por Joshua Halpern (Universidade Howard)