- Introduction
- Métodos
- Inclusão e Exclusão de Pacientes
- Aprovações do Protocolo Padrão e Consentimentos do Paciente
- Programa de Exame
- Estatística
- Resultados
- Frequência de IDNA em pacientes com RLS
- Características clínicas dos pacientes com IDNA em comparação com o NID
- Características Clínicas dos Pacientes com IDNA Comparado ao grupo IDA
- Características Hematológicas em Sujeitos de Controle
- Discussão
- Características clínicas do IDNA no SLR
- Is IDNA an Early Stage Prior to IDA in RLS?
- Acesso e diagnóstico do IDNA no RLS
- Conclusão
- Data Availability Statement
- Ethics Statement
- Contribuições do Autor
- Funding
- Conflito de interesses
- Acreditos
- Material Suplementar
- A abreviações
Introduction
Síndrome das Pernas Inquietas (SLR) é um distúrbio neurológico comum (1), e a deficiência de ferro desempenha um papel fundamental na sua patogénese (2, 3). A deficiência de ferro é comum no SLR e a anemia por deficiência de ferro (IDA) é uma causa conhecida de SLR secundário (4, 5), que está associada a um risco seis vezes maior de SLR na população em geral (6). A deficiência de ferro sem anemia (IDNA, também conhecida como deficiência não anêmica de ferro) é geralmente insidiosa, e recentemente chamou a atenção por sua prevalência mundial e desafio para diagnóstico e manejo (7). Apesar de uma clara relação entre a significância clínica do RLS na população de IDA (6), a prevalência e as características do IDNA no RLS não tem sido investigada sistematicamente. Se o IDNA representa um subgrupo de RLS e se o IDNA é um estágio inicial antes da IDA no RLS é desconhecido. Neste estudo, o objetivo é investigar as características clínicas do SLR com IDNA em comparação com aqueles sem deficiência de ferro (DNI, também sem deficiência de ferro) e com pacientes com IDA em uma coorte consecutiva de pacientes chineses com SLR.
Métodos
Inclusão e Exclusão de Pacientes
Recrutamos continuamente pacientes de nossa Clínica Especialista RLS e Clínica de Distúrbios de Movimento no Departamento de Neurologia, Hospital Geral de Shanghai, Escola de Medicina da Universidade Jiao Tong de Shanghai entre janeiro de 2017 e outubro de 2018. O RLS foi diagnosticado de acordo com os critérios de diagnóstico do Grupo Internacional de Estudo da Síndrome das Pernas Inquietas (RLSSG) de 2014 (1). Pacientes com outros distúrbios neurológicos, má cooperação, ou deficiência cognitiva foram excluídos do estudo. No mesmo período, foram recrutados no Centro de Exames de Saúde do nosso hospital controles saudáveis sem anemia, de acordo com a idade e o sexo. Os controles foram livres de doença neurológica, incluindo o LER por entrevista presencial.
Aprovações do Protocolo Padrão e Consentimentos do Paciente
O estudo foi aprovado pelo Conselho de Revisão Institucional do Hospital Geral de Xangai e todos os pacientes e controles saudáveis incluídos no estudo deram consentimento por escrito.
Programa de Exame
Pacientes com LER foram avaliados como descrevemos anteriormente (8). Em resumo, entrevistamos pacientes frente a frente em nosso ambulatório. Pacientes considerados positivos para SLR foram diagnosticados por dois neurologistas especializados em SLR. Registramos informações demográficas, histórico, sintomas, medicamentos, exames neurológicos e médicos gerais, e MMSE para todos os pacientes recrutados. Um questionário semi-estruturado foi ainda avaliado, que incluiu idade de início de RLS, história familiar de RLS (familiaridade definida como “parentes de primeiro grau”), tipo e topografia das sensações, e se os sintomas de RLS estavam correlacionados com variação sazonal. A gravidade do RLS durante 1 semana antes da entrevista foi avaliada usando a escala internacional de classificação RLS (IRLSRS) (9). Exames como ultra-som vascular, velocidades de condução nervosa, eletromiografia, etc. foram realizados se clinicamente indicados para excluir possíveis mímicas de SLR como polineuropatias periféricas, estase venosa, claudicação vascular, artrite reumatóide, e assim por diante. Também foram excluídos os sujeitos com histórico de neurolépticos ou outros medicamentos que os autores consideraram possivelmente relacionados ao SLR nos três meses anteriores. Excluímos aqueles com comorbidades notáveis que estavam associados ao SLR secundário como insuficiência renal crônica, gravidez, doença de Parkinson, neuropatia periférica, acidente vascular cerebral e ataxia. Foram avaliados os exames de hemoglobina e o estado do ferro periférico, incluindo ferritina sérica, ferro, transferrina e capacidade total de ligação do ferro (TIBC). A saturação da transferrina (TSAT) foi calculada como ferro/TIE × 100. O nível normal de hemoglobina foi definido como mulheres ≥ 113 g/L e homens ≥ 131 g/L, de acordo com o valor normal em nosso hospital. IDNA é definido como ferritina sérica <75 μg/L (ou ferritina ≥ 75 μg/L mas TSAT <20%) com nível normal de hemoglobina (10, 11). IDA é diagnosticada quando a hemoglobina <113 g/L (mulheres) ou <131 g/L (homens), assim como a ferritina sérica <75 μg/L (ou ferritina sérica ≥ 75 μg/L mas TSAT <20%).
Estatística
Dados foram analisados usando SPSS 21.0 para Windows (IBM Co., EUA). Todos os dados são apresentados como médias ± desvios padrão. Como a maioria das variáveis não foi normalmente distribuída, o teste Kruskal-Wallis foi utilizado para comparações de variáveis individuais entre três grupos, e post-hoc Mann-Whitney quando P < 0,05. As diferenças nas proporções foram analisadas pelo teste do qui-quadrado de Pearson ou pelo teste exato de Fisher quando apropriado. P < 0,05 foram considerados significativos. Considerando os efeitos potenciais da terapia medicamentosa sobre os sintomas do SLR e outras características, calculamos todos os dados duas vezes no total de pacientes com SLR e em pacientes sem medicação, respectivamente.
Resultados
Enrolamos continuamente um total de 196 pacientes com SLR primário sem anemia (SLR IDNA e SLR NID) neste estudo, incluindo 66 pacientes do sexo masculino (33,7%) e 130 pacientes do sexo feminino (66,3%). A média de idade foi de 53,0 ± 13,5 anos. 65,8% (129/196) dos pacientes com RLS não estavam tomando medicamentos para RLS (109 medicamentos-naïve, e 20 sem medicamentos por mais de 2 semanas na entrevista). Também incluímos 26 pacientes de RLS com IDA (22 inócuos). Excluímos cinco pacientes anêmicos com RLS (Hb <113 g/L para mulheres e Hb <131 g/L para homens) que não tinham evidência de deficiência de ferro (ferritina sérica ≥ 75 μg/L assim como a TIBC ≥ 20%, ferritina sérica média como 236,1 ± 119,3 μg/L). Nenhum dos pacientes com IDA tinha sinais de infecção, e as causas de IDA RLS foram listadas (Tabela 1). Além disso, coletamos 63 indivíduos saudáveis do grupo controle, incluindo 22 indivíduos do sexo masculino (34,9%) e 41 do feminino (65,1%), e a idade média do grupo controle foi de 51,0 ± 12,0 anos (a média de idade de 51,0 ± 10,4 e 51,0 ± 12,8 para homens e mulheres, respectivamente). Não houve diferenças significativas em ambos os sexos (RLS vs. controle: 66,3 vs. 65,1% para a mulher, P > 0,05) e idade (RLS vs. controle: 53,0 ± 13,5 vs. 51,0 ± 12,0, P > 0,05) entre pacientes RLS e controles. Informações demográficas detalhadas dos pacientes com RLS em cada grupo são mostradas (Tabela 2).
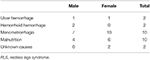
Tábua 1. Possíveis causas de deficiência de ferro em pacientes anêmicos com RLS.
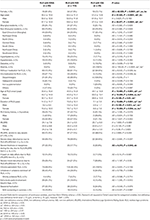
Tábua 2. Informações demográficas e características clínicas de pacientes com IDNA, NID e IDA.
Frequência de IDNA em pacientes com RLS
Dos 196 pacientes com RLS (130 mulheres, 66 homens) sem anemia ou outras comorbidades, 83 (42,3%) apresentavam deficiência de ferro. A prevalência de IDNA em mulheres (58,5%, 76/130) é muito maior que em homens (10,6%, 7/66) nesta coorte de pacientes sem anemia (Tabela 2), com risco relativo de 5,51 (intervalo de confiança de 95% 2,70-11,27, p < 0,0001).
Características clínicas dos pacientes com IDNA em comparação com o NID
Em pacientes RLS do sexo feminino sem anemia, o grupo IDNA tinha uma idade menor tanto na entrevista quanto no início do RLS quando comparado com o grupo NID (P< 0,01; Tabela 2). Embora não tenha havido diferença na gravidade do RLS pelo IRLSRS, encontramos mais pacientes com cansaço ou sonolência grave/muito grave durante o dia no grupo IDNA quando comparado ao grupo NID (32,5 vs. 17,7%, P < 0,05; Tabela 2). Não houve diferença em relação à história familiar, gravidade, lateralidade, localização e flutuação sazonal do SLR entre o grupo IDNA e o grupo DNI, nem em homens nem em mulheres. O grupo IDNA RLS apresentou menor ferritina sérica (masculino e feminino, P < 0,0001) assim como maiores valores de transferrina e TIBC (feminino, P < 0,0001) em relação ao grupo RLS NID (Figura 1, Tabela 3).
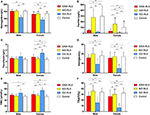
Figura 1. Os parâmetros hematológicos e ferro por grupo e sexo (A) Hemoglobina. (B) Ferritina. (C) Transferrina. (D) Ferro. (E) TIBC. (F) TSAT. **P < 0,01, *P < 0,05, teste Kruskal-Wallis e teste post-hoc Mann-Whitney. Dados comparados entre IDNA RLS (n = 83), NID RLS (n = 113), IDA RLS (n = 26), e controles (n = 63). ##P < 0.01, #P < 0.05, teste Mann-Whitney U-test. Dados comparados entre macho e fêmea em cada grupo de IDNA RLS, NID RLS, IDA RLS, e controles. A deficiência de ferro foi definida como nível de ferritina <75 μg/L, ou ferritina 75 μg/L, porém TSAT <20%. IDA, anemia por deficiência de ferro; IDNA, deficiência de ferro sem anemia; NID, sem deficiência de ferro; RLS, síndrome das pernas inquietas; TIBC, capacidade total de ligação do ferro; TSAT, saturação da transferrina.
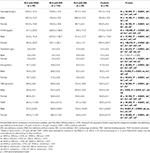
Tabela 3. Dados hematológicos de pacientes RLS com IDNA, NID, IDA e controles.
Após excluir pacientes RLS submetidos a medicações para RLS, o grupo IDNA RLS ainda apresentou taxas mais altas de cansaço/ sonolência diurna severa/muito severa em comparação ao grupo NID RLS, embora não um nível significativo (35 vs. 18,8%, P = 0,078). Outras características entre IDNA RLS e NID RLS foram semelhantes (Tabela Suplementar 1).
Características Clínicas dos Pacientes com IDNA Comparado ao grupo IDA
O grupo IDA apresentou parâmetros metabólicos de ferro mais severamente perturbados do que o grupo IDNA, incluindo ferritina inferior (masculino, P < 0.05; feminino, P < 0,0001), maior transferrina (feminino, P < 0,0001), menor ferro (masculino, P < 0,05; feminino, P < 0,0001), maior TIBC (feminino, P < 0,0001), e menor TSAT (masculino, P < 0,05; feminino, P < 0,0001) valores em soro (Figura 1, Tabela 3). IDNA RLS teve maior duração da doença (P < 0,01 em homens, P < 0,05 em mulheres) e menor idade no início (somente significante em homens com P < 0,05) do que IDA RLS. Não houve diferenças quanto à história familiar positiva, gravidade (IRLSRS), lateralidade, localização e flutuação sazonal de RLS entre IDNA RLS e IDA RLS, tanto em homens quanto em mulheres pacientes com RLS (Tabela 2). Os resultados foram semelhantes após a exclusão de pacientes com RLS com medicamentos para RLS (Tabela Suplementar 1).
Características Hematológicas em Sujeitos de Controle
Critérios de diagnóstico de deficiência de ferro são diferentes entre a população geral e os pacientes com RLS (como discussão abaixo). De acordo com o valor de corte para deficiência de ferro na população geral do nosso hospital (20 μg/L), não encontramos nenhum dos indivíduos do grupo controle do sexo masculino com deficiência de ferro, enquanto quatro indivíduos do grupo controle feminino apresentaram deficiência de ferro (dois indivíduos com ferritina sérica <20 μg/L, e dois indivíduos com ferritina ≥ 20 μg/L mas TSAT <20%). Não houve diferença significativa de prevalência de deficiência de ferro nos controles entre homens (0%, 0/22) e mulheres (9,8%, 4/41; P = 0,288). Os testes hematológicos dos parâmetros de hemoglobina e ferro no grupo controle foram mais semelhantes com o grupo RLS do NID em comparação ao grupo IDNA ou IDA (Figura 1, Tabela 3).
Discussão
A fisiopatologia do RLS primário e secundário é incompletamente compreendida. A deficiência de ferro no cérebro tem um papel fundamental na patogênese do SLR, e condições caracterizadas por deficiência sistêmica de ferro, como anemia e gravidez, estão associadas a uma maior prevalência de sintomas de SLR (2, 3, 5, 6). O IDA é uma comorbidade reconhecida associada à SLR secundária (4-6, 12). O IDNA é mais insidioso e suas características são menos conhecidas em pacientes com SLR.
Características clínicas do IDNA no SLR
Em geral, as mulheres são mais suscetíveis ao SLR (1, 13, 14). As mulheres em idade fértil também são mais deficientes em ferro do que os homens na população geral (15). Neste estudo sobre pacientes com RLS sem anemia, também encontramos uma discriminação significativa, dependente do gênero. Pacientes do sexo feminino com SLR têm um risco muito maior de IDNA do que pacientes do sexo masculino com SLR (risco relativo de 5,51, p < 0,0001). Menos pacientes RLS masculinos sofreram de deficiência de ferro, com ou sem anemia. Nos controles, embora sem significância estatística, encontramos 9,8% dos indivíduos do sexo feminino que sofriam de deficiência de ferro, enquanto nenhum dos indivíduos do sexo masculino sofria. A deficiência de ferro é incomum no sexo masculino, portanto, se os pacientes com deficiência de ferro forem do sexo masculino, devem ser feitas perguntas adicionais para avaliar causas secundárias, como sangramento crônico e desnutrição devido a distúrbios gastrointestinais.
Quando comparado com o grupo RLS NID “normal”, o grupo RLS IDNA mostrou uma idade de início de RLS mais precoce e uma idade mais jovem na entrevista em mulheres, mas não em homens (Tabela 2). Em um estudo anterior, encontramos RLS de início precoce demonstrando história familiar de RLS mais positiva e parâmetros periféricos de ferro mais severamente perturbados (ferritina sérica mais baixa, e valores mais altos de transferrina sérica e TIBC) quando comparado ao RLS de início tardio (8). Recentemente, encontramos IDNA no RLS prediz alguns fatores genéticos quando comparado ao NID no RLS (dados não publicados). Um subtipo potencial em associação com antecedentes genéticos, deficiência de ferro e RLS de início precoce merece mais investigação. Fadiga, fraqueza, dificuldade de concentração, diminuição da memória, bem como mau desempenho no trabalho são sintomas inespecíficos que muitas vezes estão associados à deficiência de ferro (7, 16). Allen et al. (6) relataram anteriormente que pacientes com IDA apresentaram mais cansaço, pior qualidade de sono e menor energia diurna em comparação com pacientes com IDA sem RLS. Descobrimos que pacientes com RLS com IDNA também eram mais propensos a sofrer de manifestações de cansaço ou sonolência graves/muito graves durante o dia devido à RLS em comparação com pacientes com RLS com DNI (ponto de corte em 75 μg/L, 32,5 vs. 17,7%, P < 0,05, Tabela 2). Quando analisados novamente apenas em pacientes com RLS sem medicação, os pacientes com RLS IDNA ainda mostraram uma tendência de maior suscetibilidade ao cansaço ou sonolência diurna severa/muito severa, embora não alcançando significância estatística (35 vs. 18,8%, P = 0,078, Tabela Suplementar 1). Nenhuma diferença de cansaço ou sonolência diurna grave/muito grave foi encontrada entre o IDNA RLS e o IDA RLS neste estudo (Tabela 2). O esgotamento da reserva de ferro, ao longo de um contínuo de IDA a IDNA, está associado à diminuição da atividade das enzimas dependentes do ferro, redução da capacidade oxidativa celular, assim como diminuição da eficiência energética (17-19). Quando usamos uma definição mais rigorosa para IDNA (valor de corte de ferritina sérica estabelecido em 50 μg/L), ainda encontramos mais pacientes IDNA RLS com cansaço ou sonolência severa/muito severa durante o dia, em comparação com pacientes NID RLS (32,3 vs. 19,8%), porém isso não foi significativo (P > 0,05; Tabela Suplementar 2). A movimentação periódica das pernas no sono (PLMS) está intimamente relacionada ao RLS, e a localização dentro do gene BTBD9 está correlacionada ao risco tanto de PLMS quanto de RLS (20, 21). Notavelmente, apenas avaliamos a qualidade do sono usando o subitem 4 do IRLSRS, e não realizamos uma avaliação detalhada do estado do sono usando a medida da polissonografia (PSG). Consequentemente, os dados de PLMS e outros parâmetros relacionados com o sono não estavam disponíveis, o que pode contribuir significativamente para o cansaço ou sonolência durante o dia. Portanto, a associação entre o cansaço/ sonolência diurna e o IDNA necessita de mais investigação. Não encontramos diferença significativa na gravidade do RLS entre o IDNA e o grupo NID. A deficiência periférica de ferro aumentará o risco de prevalência de SLR em estudos clínicos anteriores (6). A redução das concentrações séricas de ferro diminui globalmente os níveis de ferro no cérebro, e o tratamento com ferro beneficia os pacientes com níveis baixos de ferro periférico (10). Entretanto, muitos pacientes com SLR sem deficiência sistêmica de ferro ainda apresentam um déficit específico do cérebro em ferro (22). Estudos em roedores relataram que o estado sérico do ferro não estava correlacionado com os níveis regionais de ferro no cérebro, portanto pode estar limitado às características do SLR (23, 24).
Is IDNA an Early Stage Prior to IDA in RLS?
A deficiência de ferro pode ser classificada em dois níveis, IDNA e IDA, de acordo com o valor da medida da hemoglobina. Neste estudo, os pacientes com IDA apresentaram os menores níveis de hemoglobina, ferritina e ferro, assim como os maiores valores de transferrina e TIBC, em comparação ao IDNA RLS e NID RLS (Figura 1, Tabela 3). Embora não tenha havido diferenças significativas nos níveis de hemoglobina entre IDNA RLS e NID RLS (tanto em pacientes do sexo masculino quanto feminino), a hemoglobina sérica em pacientes IDNA RLS foi menor em comparação aos controles (apenas no sexo feminino, P < 0,05, Figura 1, Tabela 3). Além disso, os valores dos parâmetros de ferro no grupo IDNA RLS estavam entre os do NID RLS ou do grupo controle e o grupo IDA RLS (Figura 1, Tabela 3). Esses resultados são consistentes com o ponto de vista de que o IDNA é uma deficiência de ferro mais leve antes do desenvolvimento de anemia. É importante ressaltar que os parâmetros séricos de ferro são considerados refletindo o estado periférico do ferro principalmente nos eritrócitos (25), enquanto o armazenamento de ferro em outros órgãos (como fígado, cérebro, etc.) precisa ser validado em indivíduos IDNA.
Não obstante, as causas e características do IDNA RLS e IDA RLS não são totalmente similares. Neste estudo, a maioria dos pacientes com SLR com IDA apresentou comorbidades notáveis associadas à desnutrição ou perda excessiva crônica de sangue, incluindo hemorragia do trato alimentar, hemorragia e menorragia (Tabela 1), o que está de acordo com o estudo anterior (12). Vale ressaltar que a menorragia é uma causa comum de IDA em mulheres em idade reprodutiva, que pode ser posterior a fibroides uterinos, adenomose e outros distúrbios ginecológicos. A desnutrição pode ser secundária a distúrbios gastrointestinais, à dieta vegetariana e a conceitos errados sobre a imagem do próprio corpo em mulheres jovens. Assim, a carência de ferro na maioria dos pacientes com IDA RLS neste estudo é “carência absoluta de ferro”. Em contraste, os pacientes de RLS com IDNA geralmente não apresentam comorbidades notáveis. As causas de IDNA RLS são insidiosas e IDNA em RLS geralmente pertence ao escopo do RLS primário (4) associado à “deficiência de ferro funcional”. Entretanto, não podemos excluir nenhuma causa secundária insidiosa em pacientes com IDNA RLS, o que pode levar a suprimento inadequado de ferro no corpo.
Em comparação com o RLS com IDNA, pacientes com IDA tinham uma idade de início de RLS mais velha, bem como menor duração de RLS tanto em homens quanto em mulheres (mais significativa no sexo masculino; Tabela 2), o que estava de acordo com o ponto de vista de que o RLS secundário geralmente tem uma idade de início de RLS mais velha (26). De acordo com nossa experiência, esses pacientes com SLR IDA com causas notáveis (como perda aguda de sangue) geralmente demonstram menor duração da doença e recuperação ou alívio mais rápido quando distúrbios comorbídios tratáveis são corrigidos e o estado do ferro é restaurado. Eles geralmente não requerem terapia de longo prazo de SLR, que são um pouco diferentes dos pacientes com SLR primário. Futuros estudos longitudinais são necessários para confirmar os efeitos do tratamento do suplemento de ferro em pacientes com IDA. Outros estudos sobre SLR comorbida de gravidez (27) e uremia (28) relataram melhora após o parto e transplante renal, sugerindo mudanças nos fatores metabólicos associados podem desencadear SLR em sujeitos suscetíveis (5).
Por isso, há heterogeneidade tanto na SLR da IDA quanto na SLR do IDNA. Embora o IDNA seja geralmente considerado um estágio inicial antes da anemia (7), o IDNA RLS possivelmente não é simplesmente um estágio pródromo antes do IDA RLS.
Acesso e diagnóstico do IDNA no RLS
A biópsia de medula óssea é considerada o melhor indicador do estado do ferro, mas raramente é realizada devido aos riscos potenciais de infecção ou sangramento no local da biópsia (29). Os indicadores laboratoriais mais utilizados para o estado do ferro são a ferritina, que reflete as reservas de ferro dos tecidos ou a adequação do ferro prontamente disponível para a eritropoiese (30). Embora a ferritina sérica seja um marcador sensível para avaliar a reserva total de ferro no corpo, outras condições, como estado inflamatório, idade e função renal, podem ser confundidas, aumentando os níveis de ferritina sérica (31). A ferritina e a transferrina também são reagentes em fase aguda, e o nível de ferritina pode estar aumentado e os níveis de transferrina diminuídos sob uma condição inflamatória (32). Portanto, mesmo a ferritina sérica ≥ 75 μg/L e TSAT <20% ainda pode ter deficiência real de ferro (11, 33).
Um ponto de corte da concentração sérica de ferritina de <30 μg/L é mais sensível e específico para identificar deficiência potencial de ferro na população geral (17, 18), e o IDNA é classificado como tendo níveis normais de hemoglobina com diminuição dos níveis séricos de ferritina (<20 μg/L) (34, 35). Os laboratórios clínicos geralmente estabelecem o limite inferior da faixa de referência para ferritina sérica em 10-20 μg/L na população comum (36) (o limite inferior é estabelecido em 20 μg/L em nosso hospital). Níveis limiares significativamente mais altos para ferritina sérica são geralmente usados para definir deficiência de ferro em doenças crônicas como insuficiência cardíaca e doença renal crônica (7, 17). Os critérios de avaliação para definir deficiência de ferro no SLR também são diferentes dos dos controles saudáveis, embora o valor exato de corte para que a ferritina signifique IDNA no SLR ainda não tenha chegado a um consenso. Estudos recentes sugerem que pacientes com SLR devem ser considerados com deficiência de ferro quando sua concentração de ferritina estiver abaixo de 75 μg/L (10, 11, 27). Entretanto, estudos anteriores determinaram principalmente a concentração de ferritina abaixo de 50 μg/L como “baixa concentração de ferro” no SLR (37, 38). Como não há dados disponíveis sobre descrições de diferentes pontos de corte, comparamos as características de IDNA RLS e NID RLS usando tanto 75 como 50 μg/L como os valores de corte de ferritina para deficiência de ferro. Descobrimos que ao usar 50 μg/L como a linha inferior da placa de ferritina, 33,2% (65/196) dos pacientes com RLS atendem aos critérios do IDNA. Os resultados foram bastante semelhantes para os dois limiares utilizados, exceto que o aumento do cansaço ou sonolência grave/muito grave durante o dia no IDNA RLS comparado ao NID RLS não foi significativo quando o valor de corte de ferritina foi estabelecido em 50 μg/L (Tabela 2, Tabela Complementar 2).
Nosso estudo teve algumas limitações: Primeiro, este foi um estudo transversal e a falta de dados longitudinais dificultou a identificação da evolução dos sintomas e efeitos do tratamento da SLR. Além disso, pode haver um viés de recall. Em segundo lugar, este foi um estudo de centro único, pois cerca de um quarto dos pacientes eram residentes locais de Xangai e a maioria dos pacientes vinha da China Oriental. Considerando um vasto território na China e possíveis vários fatores ambientais, pode haver um viés de seleção. Em terceiro lugar, não realizamos a medição do PSG para avaliar o estado detalhado do sono em pacientes com RLS e controles. Em quarto lugar, cerca de um terço dos pacientes com SLR neste estudo estavam em terapia dopaminérgica e/ou enacarbilizante de gabapentina (apenas um paciente estava recebendo terapia suplementar com ferro), o que pode influenciar as características clínicas. Entretanto, calculamos novamente todos os dados em pacientes com RLS sem medicação e tiramos a mesma conclusão. Dito isto, o nosso estudo tem algumas vantagens. Estudamos em detalhe o espectro clínico do RLS e excluímos outras comorbidades ou mímicas do RLS. Entrevistamos cada paciente cara a cara, e excluímos cuidadosamente aqueles pacientes atípicos de RLS durante o acompanhamento. Houve estudos limitados sobre as características do IDNA no RLS, exploramos as características clínicas detalhadas do IDNA em pacientes consecutivos com RLS chinês.
Conclusão
IDNA é freqüente em pacientes com RLS especialmente em mulheres e tem algumas características clínicas especiais. O IDNA tinha idade mais jovem tanto na entrevista quanto no início do RLS quando comparado ao NID em pacientes com RLS do sexo feminino. O IDNA não é muito comum em pacientes com RLS masculinos e homens com deficiência de ferro devem ser avaliados para distúrbios comorbidos. As características dos pacientes com IDNA no RLS são diferentes das do RLS com IDA. O RLS com IDNA representa um problema de saúde pública importante e negligenciado que merece mais atenção clínica e deve ser abordado na estratégia de tratamento. O rastreamento regular dos parâmetros periféricos de ferro, mesmo em pacientes com hemograma normal, é recomendado para terapia apropriada em tempo hábil.
Data Availability Statement
Os conjuntos de dados gerados para este estudo estão disponíveis mediante solicitação ao autor correspondente.
Ethics Statement
Os estudos envolvendo participantes humanos foram revisados e aprovados pelo Comitê de Revisão Institucional do Hospital Geral de Xangai. Os pacientes/participantes deram seu consentimento informado por escrito para participar deste estudo.
Contribuições do Autor
X-YZ concepção/design/execução do projeto/esboço do manuscrito. T-TW: execução do projeto/coleção e interpretação dos dados/esboço do manuscrito. H-MW e JS: medição em laboratório. XL, L-YN, T-JC e M-YQ: execução do projeto/coleção e interpretação dos dados. TL e WO: revisão crítica do manuscrito para conteúdo intelectual importante. Y-CW: concepção/desenho/supervisão do projeto, revisão crítica do manuscrito para conteúdos intelectuais importantes. Todos os autores: preparação do manuscrito.
Funding
Este trabalho foi patrocinado pela Comissão Municipal de Planejamento da Ciência e Pesquisa de Xangai (201740017), o Plano de Inovação em Pesquisa Clínica do Hospital Geral de Xangai (CTCCR-2018C02), o Programa Interdisciplinar da Universidade Jiao Tong de Xangai (YG2015QN21), e a National Natural Science Foundation of China (No. 81671251).
Conflito de interesses
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Acreditos
Agradecemos a todos os pacientes e sujeitos saudáveis de controle que participaram deste estudo. Agradecemos à equipe do Centro de Exames Físicos do Hospital Geral de Xangai. Agradecemos também ao Departamento de Bioinformática e Bioestatística, Faculdade de Ciências da Vida e Biotecnologia, Universidade Jiao Tong de Shangai, Yue Zhang pela consulta estatística.
Material Suplementar
O Material Suplementar para este artigo pode ser encontrado online em: https://www.frontiersin.org/articles/10.3389/fneur.2020.00298/full#supplementary-material
A abreviações
CI, intervalo de confiança; IRLSSG, International Restless Legs Study Group; MMSE, Mini-Mental State Examination; NID, sem deficiência de ferro; RLS, síndrome das pernas inquietas; IDA, anemia por deficiência de ferro; IDNA, deficiência de ferro sem anemia; IRLSRS, International Restless Legs Syndrome Rating Scale; TIBC, capacidade total de ligação do ferro; TSAT, saturação da transferrina.
1. Allen RP, Picchietti DL, Garcia-Borreguero D, Ondo WG, Walters AS, Winkelman JW, et al. Restless legs syndrome/Willis-Ekbom disease diagnostic criteria: updated International Restless Legs Syndrome Study Group (RLSSG) consensus criteria-history, rationale, description, and significance. Med. do Sono. (2014) 15:860-73. doi: 10.1016/j.sleep.2014.03.025
CrossRef Full Text | Google Scholar
2. Connor JR, Boyer PJ, Menzies SL, Dellinger B, Allen RP, Ondo WG, et al. O exame neuropatológico sugere dificuldade de aquisição de ferro cerebral na síndrome das pernas inquietas. Neurologia. (2003) 61:304-9. doi: 10.1212/01.WNL.0000078887.16593.12
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Allen RP, Earley CJ. O papel do ferro na síndrome das pernas inquietas. A desordem do movimento. (2007) 18(22 Suppl):S440-8. doi: 10.1002/mds.21607
CrossRef Full Text | Google Scholar
4. Trenkwalder C, Allen R, Hogl B, Clemens S, Patton S, Schormair B, et al. Comorbidades, tratamento e fisiopatologia na síndrome das pernas inquietas. Lancet Neurol. (2018) 17:994-1005. doi: 10.1016/S1474-4422(18)30311-9
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Trenkwalder C, Allen R, Hogl B, Paulus W, Winkelmann J. Síndrome das pernas inquietas associada às principais doenças: uma revisão sistemática e um novo conceito. Neurologia. (2016) 86:1336-43. doi: 10.1212/WNL.0000000000002542
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Allen RP, Auerbach S, Bahrain H, Auerbach M, Earley CJ. A prevalência e o impacto da síndrome das pernas inquietas em pacientes com anemia por deficiência de ferro. Am J Hematol. (2013) 88:261-4. doi: 10.1002/ajh.23397
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Soppi ET. Deficiência de ferro sem anemia – um desafio clínico. Clin Case Rep. (2018) 6:1082-6. doi: 10.1002/ccr3.1529
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Zhu XY, Wu TT, Wang HM, Ni LY, Li X, Liu Y, et al. Características clínicas e subtipos de síndrome das pernas inquietas na população chinesa: um estudo de 359 pacientes. Med. do Sono. (2019) 59:15-23. doi: 10.1016/j.sleep.2019.01.053
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP, et al. Estudo Internacional da Síndrome das Pernas Inquietas, Validação da escala de classificação do Grupo de Estudo Internacional da Síndrome das Pernas Inquietas para a síndrome das pernas inquietas. Med. do Sono. (2003) 4:121-32. doi: 10.1016/S1389-9457(02)00258-7
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. International Restless Legs Syndrome Study, Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report. Med. do Sono. (2018) 41:27-44. doi: 10.1016/j.sleep.2017.11.1126
CrossRef Full Text | Google Scholar
11. Trenkwalder C, Winkelmann J, Oertel W, Virgin G, Roubert B, Mezzacasa A, et al. Carboximaltose férrica em pacientes com síndrome das pernas inquietas e deficiência não anêmica de ferro: um estudo randomizado. Mov Disord. (2017) 32:1478-82. doi: 10.1002/mds.27040
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Mehmood T, Auerbach M, Earley CJ, Allen RP. Resposta ao ferro intravenoso em pacientes com anemia por deficiência de ferro (IDA) e síndrome das pernas inquietas (doença de Willis-Ekbom). Med. do Sono. (2014) 15:1473-6. doi: 10.1016/j.sleep.2014.08.012
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Thomas K, Watson CB. Síndrome das pernas inquietas nas mulheres: uma revisão. J Womens Health. (2008) 17:859-68. doi: 10.1089/jwh.2007.0515
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Ohayon MM, O’Hara R, Vitiello MV. Epidemiologia da síndrome das pernas inquietas: uma síntese da literatura. Sleep Med Rev. (2012) 16:283-95. doi: 10.1016/j.smrv.2011.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Umbreit J. Deficiência de ferro: uma revisão concisa. Am J. Hematol. (2005) 78:225-31. doi: 10.1002/ajh.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Sawada T, Konomi A, Yokoi K. A deficiência de ferro sem anemia está associada com raiva e fadiga em mulheres jovens japonesas. Biol Trace Elem Res. (2014) 159:22-31. doi: 10.1007/s12011-014-9963-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Camaschella C. Anemia por deficiência de ferro. N Engl J Med. (2015) 372:1832-43. doi: 10.1056/NEJMra1401038
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Anemia por deficiência de ferro. Lanceta. (2016) 387:907-16. doi: 10.1016/S0140-6736(15)60865-0
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Haas JD, Brownlie T. A deficiência de ferro reduziu a capacidade de trabalho: uma revisão crítica da pesquisa para determinar uma relação causal. J Nutr. (2001) 131:676S-88S; discussão 688S-90S. doi: 10.1093/jn/131.2.676S
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Stefansson H, Rye DB, Hicks A, Petursson H, Ingason A, Thorgeirsson TE, et al. Um fator de risco genético para movimentos periódicos dos membros durante o sono. N Engl J Med. (2007) 357:639-47. doi: 10.1056/NEJMoa072743
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Li G, Tang H, Wang C, Qi X, Chen J, Chen S, et al. Associação de BTBD9 e MAP2K5/SKOR1 com síndrome das pernas inquietas na população chinesa. Dormir. (2017) 40:zsx028. doi: 10.1093/sleep/zsx028
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Earley CJ, Connor J, Garcia-Borreguero D, Jenner P, Winkelman J, Zee PC, et al. Alteração da homeostase do ferro no cérebro e função dopaminérgica na Síndrome das Pernas Inquietas (Doença de Willis-Ekbom). Med. do Sono. (2014) 15:1288-301. doi: 10.1016/j.sleep.2014.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Erikson KM, Pinero DJ, Connor JR, Beard JL. Concentrações regionais de ferro no cérebro, ferritina e transferrina durante a carência de ferro e repleção de ferro em ratos em desenvolvimento. J Nutr. (1997) 127:2030-8. doi: 10.1093/jn/127.10.2030
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Yin L, Unger EL, Jellen LC, Earley CJ, Allen RP, Tomaszewicz A, et al. Análise genética de sistemas de resposta multivariada à deficiência de ferro em camundongos. Am J Physiol Regul Regulador Fisiol Integral Comp Physiol. (2012) 302:R1282-96. doi: 10.1152/ajpregu.00634.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hallberg L, Hulthen L. Perspectivas sobre a absorção do ferro. Células Sanguíneas Mol Dis. (2002) 29:562-73. doi: 10.1006/bcmd.2002.0603
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Shukla G, Gupta A, Pandey RM, Kalaivani M, Goyal V, Srivastava A, et al. Que características diferenciam a síndrome das pernas inquietas unilaterais das bilaterais? Um estudo observacional comparativo de 195 pacientes. Sleep Med. (2014) 15:714-9. doi: 10.1016/j.sleep.2014.01.025
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Picchietti DL, Hensley JG, Bainbridge JL, Lee KA, Manconi M, McGregor JA, et al. International Restless Legs Syndrome Study, Consensus clinical practice guidelines for the diagnosis and treatment of restless legs syndrome/Willis-Ekbom disease during pregnancy and lactation. Sleep Med Rev. (2015) 22:64-77. doi: 10.1016/j.smrv.2014.10.009
CrossRef Full Text | Google Scholar
28. Winkelmann J, Stautner A, Samtleben W, Trenkwalder C. Curso de longa duração da síndrome das pernas inquietas em pacientes em diálise após transplante renal. Desordem do movimento. (2002) 17:1072-6. doi: 10.1002/mds.10231
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Banho BJ. Bone marrow biopsy morbidity: revisão de 2003. J Clin Pathol. (2005) 58:406-8. doi: 10.1136/jcp.2004.022178
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Baynes RD. Avaliação do estado do ferro. Clin Biochem. (1996) 29:209-15. doi: 10.1016/0009-9120(96)00010-K
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Desejo JB. Avaliar o estado do ferro: além da ferritina sérica e da saturação da transferrina. Clin J Am Soc Nephrol. (2006) 1(1 Suppl):S4-8. doi: 10.2215/CJN.01490506
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Tietz NW, Rinker AD, Morrison SR. Quando é que um ferro de soro é realmente um ferro de soro? O estado das medições do ferro de soro. Clin Chem. (1994) 40:546-1. doi: 10.1093/clinchem/40.4.546
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Mackie S, Winkelman JW. Ferritina normal em um paciente com deficiência de ferro e RLS. J Clin Sleep Med. (2013) 9:511-3. doi: 10.5664/jcsm.2680
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Comparação de duas doses de ferro elementar no tratamento da deficiência de ferro latente: eficácia, efeitos colaterais e capacidades de cegueira. Nutrientes. (2014) 6:1394-405. doi: 10.3390/nu6041394
PubMed Abstract | CrossRef Full Text | Google Scholar
35. D’Adamo CR, Novick JS, Feinberg TM, Dawson VJ, Miller LE. Um suplemento dietético derivado de alimentos contendo uma dose baixa de ferro melhorou os marcadores do estado do ferro entre mulheres não anêmicas com deficiência de ferro. J Am Coll Nutr. (2018) 37:342-9. doi: 10.1080/07315724.2018.1427158
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Goodnough LT, Nemeth E, Ganz T. Detecção, avaliação e gestão da eritropoiese com restrição de ferro. Sangue. (2010) 116:4754-61. doi: 10.1182/sangue-2010-05-286260
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Lee CS, Lee SD, Kang SH, Park HY, Yoon IY. Comparação das eficácias do ferro oral e pramipexole para o tratamento de pacientes com síndrome das pernas inquietas com baixa ferritina sérica. Eur J Neurol. (2014) 21:260-6. doi: 10.1111/ene.12286
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Tilma J, Tilma K, Norregaard O, Ostergaard JR. Síndrome das pernas inquietas na primeira infância: sintomas e efeito do tratamento com ferro oral. Acta Pediatra. (2013) 102:e221-6. doi: 10.1111/apa.12173
PubMed Abstract | CrossRef Full Text | Google Scholar