- Introdução
- Materiais e Métodos
- Exame Clínico de Pacientes
- Padrão Ethic Protocol Approvals, Registration, and Patient Consent
- Intervenção neurocirúrgica
- Análise estatística
- Resultados
- Características e Sintomas Pacientes
- Sintomas, Sinais Clínicos e Conclusões 1 Semana após a Cirurgia
- Symptoms, Clinical Signs, and Findings 3 Months after Surgery
- Discussão
- Declaração Ética
- Author Contributions
- Conflict of Interest Statement
- Financiamento
- Material Suplementar
Introdução
Malformação de Chiari compreende um grupo de entidades patológicas caracterizadas pela presença de deformidades anatómicas do cerebelo e do tronco cerebral. Os sintomas típicos incluem dores de cabeça occipitais, que são exacerbadas pela tosse; distúrbios motores e/ou sensoriais, especialmente do membro superior; e desapego (1, 2).
O tratamento atual inclui descompressão da região suboccipital para ampliar o diâmetro do forame magno e ressecção do arco posterior de C1. Mas tem havido muita discussão crítica sobre se se deve abrir o aracnoide e remover também as amígdalas cerebelares (3). Os riscos pós-operatórios deste procedimento parecem ser maiores, incluindo pseudomeningocele e formação de higroma, meningite e dores de cabeça (2). Por outro lado, a descompressão suficiente do tronco cerebral é mais provável quando a aracnoide e as amígdalas são manipuladas (1, 4) (detalhes na Folha de Dados S1 em Material Suplementar). Os dados sobre o resultado clínico após o tratamento cirúrgico variam devido a diferentes métodos cirúrgicos, coortes de pacientes e sintomas. A melhora clínica e a melhora na vida diária foram descritas em diferentes estudos em 50-75% dos pacientes (2, 3). As disfunções motoras oculares melhoraram em 75-100% dos pacientes (5-7).
Experiências com lesões cerebelares, ou seja, devido a infartos isquêmicos, ensinam-nos que as lesões das amígdalas podem levar a déficits motores oculares significativos causando vertigens incapacitantes (8). Entretanto, o efeito da amigdalectomia unilateral na função motora ocular e cerebelar ainda não foi examinado sistematicamente. O objetivo principal do nosso estudo foi avaliar se o procedimento cirúrgico de descompressão suboccipital, incluindo a redução de uma tonsila cerebelar, leva a déficits motores oculares, vestibulares ou cerebelares em pacientes com malformação de Chiari tipo I.
Materiais e Métodos
Exame Clínico de Pacientes
Quatorze pacientes consecutivos com evidência radiológica de malformação de Chiari tipo 1 foram examinados para este estudo nos Departamentos de Neurologia e Neurocirurgia do Hospital Universitário de Munique. Três pacientes apresentavam sinais clínicos leves e foram tratados de forma conservadora. Onze foram submetidos a intervenção cirúrgica com ressecção ou redução de uma amígdala cerebelar e foram incluídos no estudo. Um paciente foi perdido para acompanhamento.
Patientes foram examinados antes e em dois momentos após a intervenção cirúrgica: um diretamente após e um em acompanhamento aproximadamente 3 meses após a cirurgia. Os pacientes receberam um questionário padronizado para queixas típicas. Os pacientes foram questionados sobre dor de cabeça ou pescoço (tipo e fatores provocadores), instabilidade da marcha, vertigem ou tontura (tipo e fatores provocadores), problemas visuais, problemas audiológicos, sinais motores, déficits sensoriais e déficits do nervo craniano inferior.
O exame consistiu de um exame neurológico, neuro-ofotalmológico e neuro-otológico padronizado. Este exame incluiu o teste cabeça-espinhaço, avaliação para nistagmo espontâneo com googles de Frenzel na posição primária e durante o desvio do olhar, perseguição suave, sacadas, nistagmo optocinético, supressão da fixação visual do reflexo vestíbulo-ocular (VOR), nistagmo de agitação da cabeça e determinação da vertical visual subjetiva (SVV). Desvios acima de 2,5° foram definidos como patológicos (9). A função cerebelar foi avaliada por escalas de classificação de ataxia, nomeadamente, a Escala de Avaliação e Classificação da Ataxia (SARA) (10) e o Índice Funcional de Ataxia Espinocerebelar (SCAFI) (11). Durante o seguimento de 3 meses, a função vestibular foi examinada neurofisiologicamente com teste calórico bithermal utilizando o EyeSeeCam System® (diferença lateral patológica de acordo com a fórmula de Jongkee superior a 25%) e os potenciais miogênicos evocados vestibulares cervicais e ósseos (c/oVEMP) com o uso do Interacoustics Eclipse System® (12). A razão de assimetria , deve ser inferior a 35% (13). As medidas posturográficas foram realizadas na posição vertical usando o protocolo padrão com 10 condições diferentes com dificuldade crescente (14). A melhora subjetiva foi medida com uma entrevista. Os pacientes foram questionados em relação a todas as queixas em conjunto se tiveram uma melhoria dos seus sintomas 3 meses após a intervenção. O comprometimento subjetivo com relação à vertigem e tontura foi medido com o Dizziness Handicap Inventory (DHI) (15, 16). O DHI é um inventário de auto-avaliação com pontuação mínima de 0 e máxima de 100 (máximo impacto da tontura na vida diária). A pontuação de mudança clinicamente relevante entre pré- e pós-tratamento no trabalho original é de 18 (16). Todos os pacientes fizeram a RM pós-operatória de rotina após 3 meses. No caso da syrinx existente, o tamanho (comprimento e diâmetro em milímetros) foi medido e comparado com os exames de RM pré-operatórios.
Padrão Ethic Protocol Approvals, Registration, and Patient Consent
Este estudo foi realizado de acordo com as recomendações do Institutional Review Board do comitê de ética da Universidade Ludwig-Maximilian de Munique com consentimento informado por escrito de todos os sujeitos. Todos os sujeitos deram o consentimento informado por escrito de acordo com a Declaração de Helsinque. O protocolo foi aprovado pelo Comitê de Ética da Universidade Ludwig-Maximilian de Munique. A indicação para intervenção cirúrgica foi fornecida independentemente da participação neste estudo.
Intervenção neurocirúrgica
Patientes submetidos à monitorização eletrofisiológica intra-operatória para nervos cranianos inferiores, potenciais evocados motores e potenciais evocados somato-sensores, a fim de evitar um efeito adicional no tronco cerebral como resultado da inclinação exagerada da cabeça. Na posição prona, a cabeça do paciente foi fixada em uma braçadeira Mayfield. A intervenção cirúrgica consistiu em uma dissecção medial suboccipital do músculo do pescoço expondo o arco de C1 e o occipital ao redor do forame magno. Primeiro, o forame magno foi aumentado por craniectomia osteoclástica de aproximadamente 3 cm × 4 cm, largura adaptada ao tamanho do forame magno. Em seguida, foi realizada uma laminectomia do arco de C1 com a mesma largura do canal vertebral. A ultra-sonografia intra-operatória permitiu a visualização das pontas das amígdalas a fim de descomprimir o máximo possível para baixo. Algumas vezes foi necessária uma laminotomia da borda superior do arco C2. A laminectomia C2 nunca foi realizada a fim de evitar instabilidade cervical. Então, a dura-máter foi aberta em “Y” e cosida ao periósteo do occipital. Após cuidadosa dissecção da aracnóide, foram identificadas as amígdalas cerebelares maiores e mais longas, bem como o tronco cerebral inferior e a medula espinhal. A amígdala identificada foi primeiro encolhida pela coagulação da superfície externa e medial sem afetar os vasos intracranianos. A pia da amígdala coagulada foi incisada e o tecido amigdalar removido por sucção suave e coagulação bipolar. Finalmente, a amígdala reduzida foi colocada ao nível do forame magno. O volume médio de tecido da amígdala ressecado variou de 0,6 a 2,7 cm3 (média 1,4 cm3, DP 0,6 cm3). Finalmente, a região do obex foi inspecionada para permitir a saída livre do canal central dentro da medula espinhal, sempre que possível com segurança. Para ampliar ainda mais o espaço craniocervical, um substituto dural (Lyoplant®, B. Braun) foi implantado e suturado de forma estanque. Finalmente, a ferida foi meticulosamente fechada em várias camadas, por exemplo, músculos, fáscia, subcutis e cutis para prevenir vazamento do LCR.
Análise estatística
Análise estatística foi realizada usando SPSS Statistics 20 (IBM, Armonk, NY, EUA). Como os dados não foram normalmente distribuídos, testes não-paramétricos pareados foram realizados usando o teste Wilcoxon matched pairs test para comparar duas amostras relacionadas e o teste Mann-Whitney U-test para comparações entre grupos. As diferenças foram consideradas significativas se p < 0,05. O desenho deste estudo foi exploratório.
Resultados
Características e Sintomas Pacientes
Entes pacientes com malformação Chiari tipo 1 confirmada por RM (6 mulheres, média de idade 37 anos, faixa 18-57) foram incluídos neste estudo. Os valores a seguir são valores médios ± desvio padrão. Os participantes foram examinados no pré-operatório (27 ± 48 dias antes da cirurgia; intervalo de 1 dia a 5 meses, n = 10) e em dois pontos de tempo após a intervenção cirúrgica. Para mais detalhes sobre os dados clínicos, vide Tabela 1. Na nossa coorte, a duração média dos sintomas foi de 4 ± 3 anos (intervalo de 3 meses-11 anos). O tempo entre o início dos sintomas e o diagnóstico correto foi de 3 ± 3 anos (intervalo de 3 meses-10 anos). Na RM, a seringomielia estava presente em 70% dos pacientes. A descida tonsilar variou de 0,7 a 2,2 cm (média de 1,4 cm, DP 0,6 cm). O comprimento da seringomielia variou entre um e mais de 10 segmentos vertebrais, o tamanho entre 1,5 e 0,3 mm em diâmetro máximo. A Figura 1 mostra o paciente número quatro com uma importante syringomyelia devido à malformação Chiari tipo I pré e pós-operatória.
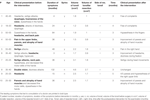
Tabela 1. Apresentação clínica e curso após intervenção cirúrgica.
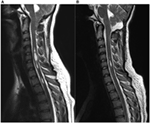
Figura 1. Siringomielia devido à malformação Chiari tipo I pré (A) e 3 meses pós (B) descompressão cirúrgica. (A) Esta mulher de 19 anos de idade queixou-se de dor de cabeça occipital, hipestesia dos membros superiores, assim como ataques de vertigem. Imagens de RM pré-operatórias sagitais ponderadas em T2 demonstram descida de tonsilas até a margem inferior do arco de C2 e uma significativa seringomielia multi-compartimental na medula cervical. (B) As imagens de RM pós-operatórias evidenciam claramente uma redução acentuada da syrinx pré-existente, bem como uma redução do comprimento da amígdala no forame magno. A paciente relatou notável melhora dos sintomas após descompressão cirúrgica.
Os principais sintomas foram ataques recorrentes de vertigem ou tonturas (60%), dor de cabeça e de pescoço, que pioraram durante a tosse e movimentos específicos da cabeça (50%) e dis-hipestesia nos membros superiores (50%).
Em termos de características clínico-neurológicas, os principais achados foram ataxia nos membros superiores (dismetria de fase de dedos, tremor de intenção, disdiadocinese) (6/10 pacientes) e dis- e hipestesia (5/10 pacientes). Para mais detalhes do exame clínico, ver Tabela 2 (A).
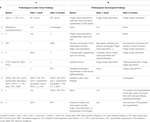
Tabela 2. Achados motores oculares (A) e neurológicos (B) antes e após a intervenção cirúrgica.
No exame neuro-oftimológico, cinco pacientes apresentaram achados motores oculares anormais, incluindo nistagmo (n = 3), nistagmo-evoked-nystagmus, supressão da fixação perturbada do VOR, teste patológico de impulso da cabeça (cada n = 2), desvio do SVV, inclinação da cabeça, sacadas hipermétricas, nistagmo de ricochete, perseguição suave sacádica, e nistagmo de rebaixamento (DBN) (cada n = 1). Para mais informações, veja a Tabela 2 (B).
Patientes com déficits cerebelares leves nos escores examinados. O escore SARA total médio foi de 0,6 ± 0,9 (o escore varia de 0 = sem ataxia a 40 = ataxia severa). A média de 8MW foi de 5,1 ± 0,5 s. O teste de 9-Hole peg (9HPT) da mão dominante foi de 20,1 ± 2,2 s e da mão não dominante de 21,3 ± 2,6 s. A média da PATA foi de 27,9 ± 3,9. Para mais informações veja a Tabela 3.

Tabela 3. Função Cerebelar avaliada pela Escala de Avaliação e Classificação da Ataxia (SARA) e pelo Índice Funcional da Ataxia Espinocerebelar (SCAFI) antes e após a intervenção cirúrgica.
>
>
>
Nove dos 10 pacientes foram submetidos a testes calóricos antes da intervenção cirúrgica, oito o/cVEMP. Seis pacientes apresentaram função vestibular anormal nestes testes: três pacientes (no. 2, 3 e 7) apresentaram diferença lateral patológica no teste calórico, sugerindo um déficit na função do canal horizontal; três outros pacientes apresentaram teste o/cVEMP patológico, indicando um déficit na função otólita (no. 1, 9 e 10).
A média total de DHI foi de 17 (variação de 0-70), sugerindo uma deficiência leve. Para maiores informações, ver Tabela 4.

Tabela 4. Teste vestibular de canal horizontal (teste calórico), sacular e função utricular, bem como comprometimento subjetivo, medido pelo Dizziness Handicap Inventory (DHI), antes e 3 meses após a intervenção cirúrgica.
>
Patientes tiveram tendência a um pior desempenho na posturografia em comparação aos controles saudáveis publicados em outros estudos em nosso centro (17). De pé em solo firme, nove em cada 10 pacientes apresentaram um padrão de oscilação semelhante à vertigem fóbica postural em rede artificial (14). Para maiores informações, veja a Tabela 5.

Tabela 5. Extrato dos dados de posturografia com balanço total e direcional, raiz quadrada média (RMS), bem como transformação rápida de Fourier (FFT) antes e depois da intervenção cirúrgica em quatro exames selecionados.
Sintomas, Sinais Clínicos e Conclusões 1 Semana após a Cirurgia
Exame neuro-optalmológico revelou um desvio da VSV para a direita após a ressecção da amígdala esquerda (paciente nº 5 5,2° e paciente nº 10 4,5°) e novos déficits de busca suave (nº 1). Para maiores informações, ver Tabela 2.
Symptoms, Clinical Signs, and Findings 3 Months after Surgery
Sufficient suboccipital descompression led to improvement of symptoms (measured with an interview regarding all symptoms before intervention) in 9/10 of patients in follow-up without influence of the side of the resected tonsil. Dois pacientes ficaram livres de queixas após a intervenção neurocirúrgica (nº 1, 2). Os sintomas melhoraram em sete pacientes (no. 3-8, no. 10). Um paciente teve complicações maiores devido a vazamento do LCR e meningite subsequente. Ele precisou de revisão cirúrgica para vazamento dural, e os sintomas melhoraram lentamente durante várias semanas (no. 9). No seguimento, ele teve uma hemiparesia residual leve no lado direito. Não houve outras complicações em nenhum dos outros pacientes. O tamanho e o comprimento da seringomielia pré-existente diminuiu em todos os pacientes. Para mais informações, ver Tabelas 1 e 2 (B).
Neuro-ofotalmologicamente, nistagmo agitado da cabeça, VOR, reação de inclinação ocular e DBN melhoraram em todos os pacientes afetados. Uma melhora parcial pôde ser observada no nistagmo com visão agitada e supressão da supressão da fixação do VOR.
Novos distúrbios motores oculares após a cirurgia foram déficits de perseguição suave (no. 1, 7, 9, 10), DBN (no. 4), e nistagmo desviado do olhar e nistagmo de ricochete (no. 9). Todos estes pacientes eram assintomáticos. O paciente número 9 com complicações pós-operatórias maiores teve novas disfunções vestibulocerebelares, incluindo nistagmo desviado do olhar, nistagmo de rebote, déficit de busca vertical suave e déficit vestibular no teste calórico e relatou mais comprometimento no DHI. Para maiores informações, ver Tabela 2 (A) e Tabela 4.
Os dois pacientes com DVEF patológico melhoraram, assim como um em cada três pacientes com teste calórico anormal. A DHI média melhorou de 17 para 6 após a intervenção cirúrgica (p = 0,273), especialmente com base em dois pacientes (no. 2, 6), que tiveram uma melhora significativa do comprometimento devido à vertigem e tonturas. Para maiores resultados, ver Tabela 4.
Em medidas posturográficas após a cirurgia, a oscilação total (e os valores de RMS) não se alteraram significativamente. Não houve uma oscilação cerebelar típica de 3 Hz. Para mais informações, ver Tabela 5.
Discussão
Os principais resultados deste estudo prospectivo são os seguintes.
Primeiro exame neuro-optalmológico pré-operatório revelou achados anormais em 50% dos pacientes, incluindo nistagmo de agitação da cabeça, nistagmo desviado do olhar, supressão da fixação perturbada do VOR, desvio do VSV, inclinação da cabeça, sacadas hipermétricas, ressalto do nistagmo, perseguição sacádica suave e DBN. 70% dos pacientes tinham função vestibular anormal: dois pacientes tinham um teste patológico de impulso da cabeça indicando um déficit de alta freqüência do VOR, três pacientes tinham um teste calórico patológico testando a função de baixa freqüência do VOR e três tinham função otólita anormal testada com potenciais miogênicos evocados vestibulares.
Patientes tinham apenas sinais cerebelares leves a moderados (especialmente dismetria de perseguição dos dedos). Os sintomas clínicos dos nossos pacientes de Chiari foram semelhantes aos de outros estudos (1, 2, 18), exceto por sintomas vestibulares mais elevados que suportam resultados anteriores, cuja detecção é maior nos departamentos especializados em neuro-otologia (6). Em um estudo com 77 pacientes de Chiari em um departamento especializado durante vários anos, 55% dos pacientes apresentaram anormalidades pré-operatórias nos exames do sistema motor ocular, incluindo nistagmo espontâneo horizontal (27%), perseguição sacádica lisa (29%), nistagmo induzido posicional (21%), dismetria sacádica (10%) e DBN (7%) (18). O grande número de pacientes com nistagmo horizontal espontâneo não pôde ser reproduzido pelos nossos dados, apesar de três pacientes (39%) terem um nistagmo horizontal que agitava a cabeça, sugerindo que o armazenamento de velocidade foi afetado.
Segundo, a intervenção cirúrgica incluindo amigdalectomia levou a uma melhora subjetiva e objetiva dos sintomas em 9/10 dos pacientes. As habilidades motoras finas e a marcha medida com SCAFI melhoraram significativamente. A função vestibular (canal horizontal, sacular e utricular) melhorou em cinco dos sete pacientes com comprometimento da função antes da cirurgia, especialmente em termos de função VOR de alta freqüência e função otolital sacular. Os distúrbios motores oculares melhoraram em todos os pacientes afetados em termos de nistagmo de abalo da cabeça, VOR, reação de inclinação ocular e DBN. Em alguns pacientes, melhoras adicionais puderam ser observadas em termos de nistagmo com desvio do olhar e supressão da fixação do VOR.
A melhora subjetiva em nossas séries excede a das séries de casos e revisões que geralmente mostram uma melhora de cerca de 75% (3). Entretanto, a ressecção amigdalar foi descrita em apenas 27% dos pacientes com descompressão suboccipital de acordo com uma revisão de uma série cirúrgica entre 1965 e 2013 (3). Em outra série de 177 pacientes, submetidos à cirurgia de fossa posterior, os 137 pacientes submetidos à ressecção amigdalar com cisternas subaracnoidais subseqüentemente maiores mostraram uma redução mais pronunciada no tamanho da seringomielia e subseqüentemente uma melhora maior em seus sintomas (1). Em outro estudo observacional em 77 pacientes, a ressecção das amígdalas teve bons resultados em 100% comparada com 64,8% naqueles com apenas descompressão do forame magnum (4). Em uma grande série de 371 pacientes com descompressão de fossa posterior sem ressecção de tonsilas, uma melhora dos sintomas pré-operatórios foi descrita em apenas 73,6% dos pacientes (19).
Terceiro exame neuro-oftalmológico após descompressão suboccipital, incluindo redução de tonsilas, revelou novos, mas em sua maioria assintomáticos, déficits motores oculares em cinco pacientes, incluindo déficits de perseguição suave, nistagmo desviado horizontalmente pelo olhar, nistagmo rebound e DBN. O desvio contralateral (para o lado da redução de tonsilas) do VSV foi temporário em 20% dos pacientes e foi compensado no seguimento. Estudos retrospectivos prévios sobre manifestações vestíbulo-oculares na malformação de Chiari ou na seringomielia mostraram uma resolução notável de distúrbios motores oculares de 75-100% após descompressão sem amigdalectomia (5-7). O procedimento cirúrgico desta série consistiu na descompressão do forame magno e laminectomia C1, incluindo duroplastia sem ressecção amigdalar. Por outro lado, o exame motor ocular, que não foi realizado por neurooptalmologistas especializados, não foi tão detalhado e padronizado como em nossa série.
Até o momento não houve publicações sobre os efeitos colaterais da descompressão suboccipital com redução unilateral da tonsila cerebelar, o que é considerado em estudos neuroanatômicos como parte importante do vestibulocerebelo. Em experimentos com animais, lesões cirúrgicas do flóculo e do parafloculo levaram a uma perseguição suave prejudicada, nistagmo desviado horizontalmente, nistagmo rebound e DBN (20).
Por que os déficits após uma amigdalectomia unilateral são tão moderados quando comparados aos achados clínicos, mesmo após pequenos infartos de amigdalas? Uma explicação provável poderia ser que a função já foi prejudicada devido à compressão e esse déficit já foi compensado de forma centralizada. Além disso, o tamanho da lesão perioperatória amigdalar foi menor.
Estamos cientes das limitações do nosso estudo. Em primeiro lugar, o desenho é prospectivo, mas não controlado. As decisões neurocirúrgicas intra-operatórias, ou seja, no lado das amígdalas reduzidas, não foram randomizadas. O número de pacientes é bastante pequeno (n = 10) comparado aos estudos retrospectivos (6, 18). Nossos resultados foram baseados no exame por ortoptistas especializados. A maioria das novas disfunções motoras oculares foram leves e só detectáveis no exame motor ocular detalhado e, portanto, podem não ser detectadas em outros estudos. Outra limitação é o intervalo de tempo em que se realizaram os exames de seguimento pós-operatório. Como o cerebelo é conhecido por ter uma notável capacidade compensatória, isto pode ter influenciado os nossos resultados. Durante o primeiro exame pós-operatório, dois pacientes estavam tomando tilidina como analgésico, o que é conhecido por afetar a busca suave (23). Portanto, as interações médicas não podem ser descartadas neste momento. Este estudo foi exploratório, sem correção para testes múltiplos, o que poderia ter influenciado a importância do teste SCAFI.
Descompressão suboccipital, incluindo redução de uma amígdala cerebelar pode levar a déficits motores oculares semelhantes aos dos infartos isquêmicos; entretanto, quase todos os nossos pacientes estavam assintomáticos. Com uma melhora subjetiva e clínica em 9/10 dos nossos pacientes, podemos promover a ressecção de uma tonsila cerebelar se o tamanho da tonsila ou o grau de deslocamento para baixo o tornar necessário. Neuroanatomicamente, nossos resultados confirmam o papel da amígdala na busca suave e da rede de retenção do olhar (8, 24). Entretanto, nosso estudo inclui um procedimento neurocirúrgico complexo com descompressão da região suboccipital, incluindo a redução da amígdala, o que exclui a localização anatômica precisa. Os déficits vestibulares indicam um desequilíbrio tonal para o canal semicircular e sistema otólito, que é tipicamente localizado no flóculo ou tronco encefálico (25). Em resumo, este é o primeiro estudo clínico prospectivo sobre o efeito da ressecção unilateral da tonsila cerebelar sobre a função motora ocular, vestibular e cerebelar. A descompressão cirúrgica, incluindo a redução/resecção unilateral da tonsila cerebelar, leva a um bom resultado clínico em termos de queixas dos pacientes, habilidades motoras finas e marcha sem qualquer efeito do lado da tonsila ressecada.
Não obstante, um exame pós-operatório detalhado pode mostrar distúrbios motores oculares semelhantes aos resultantes de infartos isquêmicos (déficits de busca suave, nistagmo desviado horizontalmente, nistagmo rebound e DBN, bem como desvio da VSV), confirmando o papel anatômico da amígdala na busca suave e da rede de retenção do olhar; entretanto, os sintomas são leves e assintomáticos em nossa coorte de pacientes com Quiari.
Declaração Ética
Este estudo foi realizado de acordo com as recomendações do Comitê de Ética da Universidade Ludwig-Maximilian de Munique, com consentimento livre e esclarecido por escrito de todos os sujeitos. Todos os sujeitos deram o consentimento informado por escrito de acordo com a Declaração de Helsinque. O protocolo foi aprovado pelo Comitê de Ética da Universidade Ludwig-Maximilian de Munique. A indicação para intervenção cirúrgica foi fornecida independentemente da participação neste estudo.
Author Contributions
NG: projeto de pesquisa (concepção, organização, execução, interpretação dos dados), análise estatística (desenho, execução), preparação do manuscrito (redação da primeira minuta, revisão). KF: projeto de pesquisa (concepção, organização, execução), preparação do manuscrito (revisão e crítica). FI e MK: projeto de pesquisa (execução), preparação do manuscrito (revisão). SK: projeto de pesquisa (interpretação dos dados), preparação de manuscrito (revisão). JT: projeto de pesquisa (idéia para estudo, concepção, interpretação dos dados), preparação do manuscrito (revisão e crítica). MS: projeto de pesquisa (idéia para estudo, concepção, interpretação dos dados), preparação do manuscrito (revisão e crítica), incluindo escrita médica para o conteúdo. AP: projeto de pesquisa (concepção, organização, execução, interpretação dos dados), preparação do manuscrito (revisão e crítica) incluindo escrita médica para o conteúdo.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Financiamento
Este estudo foi apoiado pelo Ministério Alemão de Educação e Pesquisa (BMBF), doação 01EO1401 ao Centro Alemão para Distúrbios de Vertigem e Equilíbrio (DSGZ).
Material Suplementar
1. Batzdorf U, McArthur DL, Bentson JR. Tratamento cirúrgico da malformação de Chiari com e sem syringomyelia: experiência com 177 pacientes adultos. J Neurosurg (2013) 118(2):232-42. doi:10.3171/2012.10.JNS12305
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Arnautovic A, Splavski B, Boop FA, Arnautovic KI. Malformação pediátrica e de Chiari adulto tipo I série cirúrgica 1965-2013: uma revisão da demografia, tratamento operatório e resultados. J Neurosurg Pediatr (2015) 15(2):161-77. doi:10.3171/2014.10.PEDS14295
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Guyotat J, Bret P, Jouanneau E, Ricci AC, Lapras C. Syringomyelia associada à malformação de Chiari tipo I. Estudo retrospectivo de 21 anos em 75 casos tratados por descompressão de forame magnum com ênfase especial no valor da ressecção das amígdalas. Acta Neurochir (Wien) (1998) 140(8):745-54. doi:10.1007/s007010050175
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Liebenberg WA, Georges H, Demetriades AK, Hardwidge C. A descompressão da fossa posterior melhora as manifestações oculomotoras e vestíbulo-oculares na malformação de Chiari 1? Acta Neurochir (Wien) (2005) 147(12):1239-40; discussão 40. doi:10.1007/s00701-005-0612-5
CrossRef Full Text | Google Scholar
9. Dieterich M, Brandt T. A torção ocular e a inclinação da vertical visual subjetiva são sinais sensíveis do tronco encefálico. Ann Neurol (1993) 33(3):292-9. doi:10.1002/ana.410330311
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Bremova T, Bayer O, Agrawal Y, Kremmyda O, Brandt T, Teufel J, et al. VEMPs oculares indicam o reposicionamento da otoconia no utrículo após manobras liberatórias bem sucedidas em vertigens de posicionamento paroxístico benigno. Acta Otolaryngol (2013) 133(12):1297-303. doi:10.3109/00016489.2013.829922
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jacobson GP, Newman CW. O desenvolvimento do Inventário Dizziness Handicap. Arch Otolaryngol Head Neck Surg (1990) 116(4):424-7. doi:10.1001/archotol.1990.01870040046011
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Zwergal A, la Fougere C, Lorenzl S, Rominger A, Xiong G, Deutschenbaur L, et al. O desequilíbrio postural e as quedas na PSP correlacionam-se com a patologia funcional do tálamo. Neurologia (2011) 77(2):101-9. doi:10.1212/WNL.0b013e318223c79d
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Klekamp J. Tratamento cirúrgico da malformação de Chiari I – análise dos achados intra-operatórios, complicações e desfecho para 371 foramen magnum descompressões. Neurocirurgia (2012) 71(2):365-80; discussão 80. doi:10.1227/NEU.0b013e31825c3426
CrossRef Full Text | Google Scholar
20. Zee DS, Yamazaki A, Butler PH, Gucer G. Efeitos da ablação do floculo e parafloculo dos movimentos oculares em primata. J Neurofisiol (1981) 46(4):878-99.
Google Scholar
22. Leigh RJ, Zee DS. A Neurologia dos Movimentos Oculares. Nova York: Oxford University Press (2006).
Google Scholar
23. Thömke F. Augenbewegungsstörungen – Ein klinischer Leitfaden für Neurologen. 2ª ed. Stuttgart: Thieme (2008).
Google Scholar
24. Nagao S. Diferentes papéis de floculo e parafloculo ventral para controle oculomotor no primata. Neuroreport (1992) 3(1):13-6. doi:10.1097/00001756-199201000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar