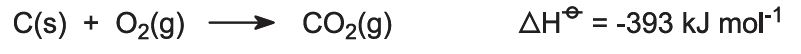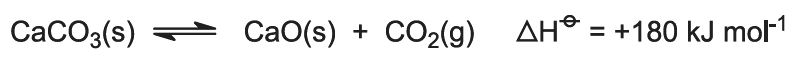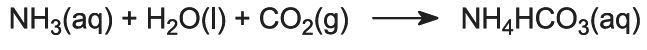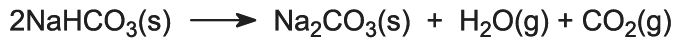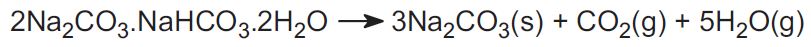- Användningar av natriumkarbonat
- Årlig produktion av natriumkarbonat
- Tillverkning av natriumkarbonat
- (a) Från natriumklorid och kalciumkarbonat
- (1) Ammoniakering av saltlösning
- (2) Bildning av kalciumoxid och koldioxid
- (3) Solvay-tornet
- (4) Avskiljning av fast natriumvätekarbonat
- (5) Bildning av natriumkarbonat
- (6) Bildning av kalciumhydroxid
- (7) Regenerering av ammoniak
- (b) Från trona- och nahcolitmalm
Användningar av natriumkarbonat
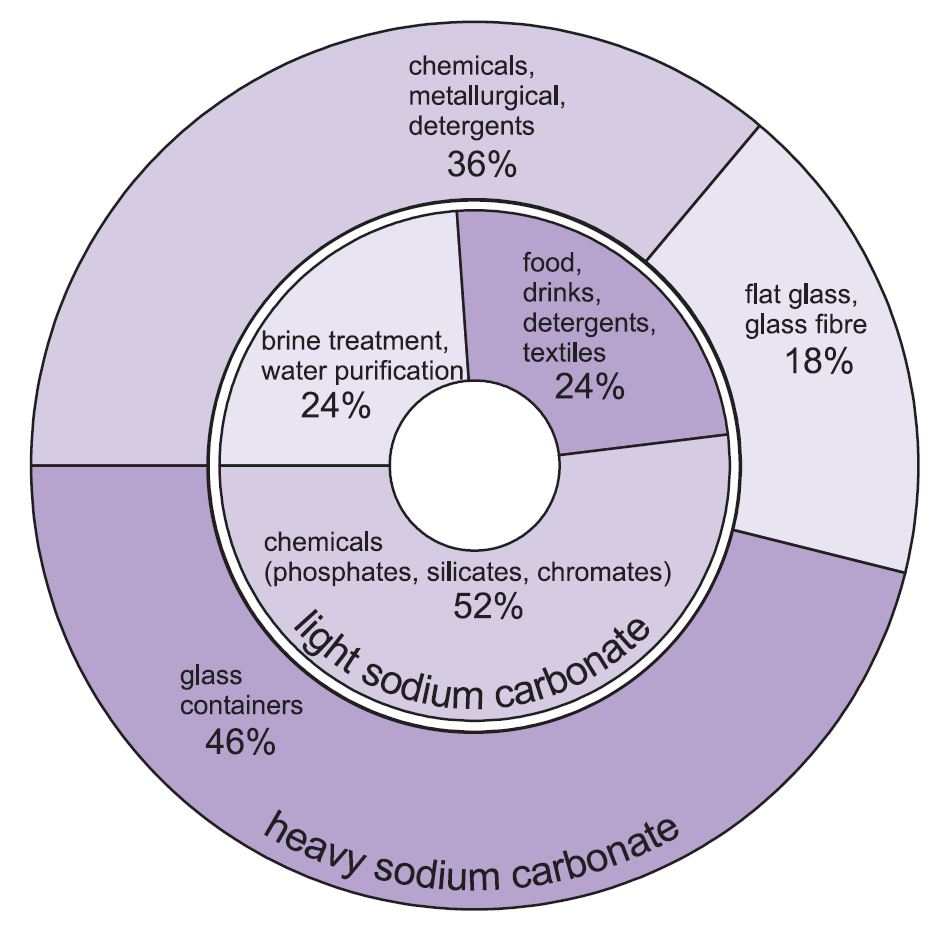
Två former av natriumkarbonat (soda) används – tungt och lätt. Den lätta formen framställs först och en del omvandlas sedan till den tunga formen. Lätt natriumkarbonat innehåller mindre än 0,5 % natriumklorid. Tungt natriumkarbonat erhålls genom att hydrera lätt natriumkarbonat till monohydrat (Na2CO3.H2O) och sedan dehydratisera det för att ge en produkt med ökad kristallstorlek och densitet.
De två kvaliteterna har olika användningsområden.
De viktigaste användningsområdena för tungt natriumkarbonat är som fast ämne, särskilt vid tillverkning av glas, där det används som flussmedel vid smältning av kiseldioxid (sand).
Användningarna för lätt natriumkarbonat är traditionellt där kemikalien behövs i lösning.
Figur 1 Användning av både tungt och lätt natriumkarbonat.
Totalt används cirka 50 % av den totala produktionen av natriumkarbonat för att tillverka glas, 18 % för att tillverka andra kemikalier och 10 % i tvål och tvättmedel.
Årlig produktion av natriumkarbonat
Kina är världens största producent av natriumkarbonat och står för 46 % av världsproduktionen och USA för 23 %. (IHS Markit, 2015)
| Världen | 52 miljoner ton1,2 |
| Kina | 25 miljoner ton3 |
| USA. | 12 miljoner ton1 |
| Europa | 11 miljoner ton |
| Ryssland | 0.71 miljoner ton4 |
Data från:
1. 2018 Elements of the Business of Chemistry, American Chemistry Council.
2. Av dessa bryts 14,7 ton. Den stora majoriteten bryts i USA (11,7 miljoner ton) och Turkiet (2 miljoner ton). Resten tillverkas av natriumklorid och kalciumkarbonat.
3. IHS Markit, 2015
4. Federal State Statistics Service: Russian Federation 2011
Tillverkning av natriumkarbonat
Det finns två huvudsakliga källor till natriumkarbonat:
a) från salt och kalciumkarbonat (via ammoniaknatriumnatrium (Solvay)
b) från natriumkarbonat- och vätekarbonatmalmer (trona och nahcolit)
(a) Från natriumklorid och kalciumkarbonat
Den övergripande reaktionen kan betraktas som en reaktion mellan kalciumkarbonat och natriumklorid:
Kalciumkarbonat är dock för olösligt för att reagera med en saltlösning. Istället erhålls produkten genom en serie av sju steg.
Processen är känd som ammoniak-soda-processen eller Solvay-processen, uppkallad efter den belgiske industrikemisten som patenterade den 186I.
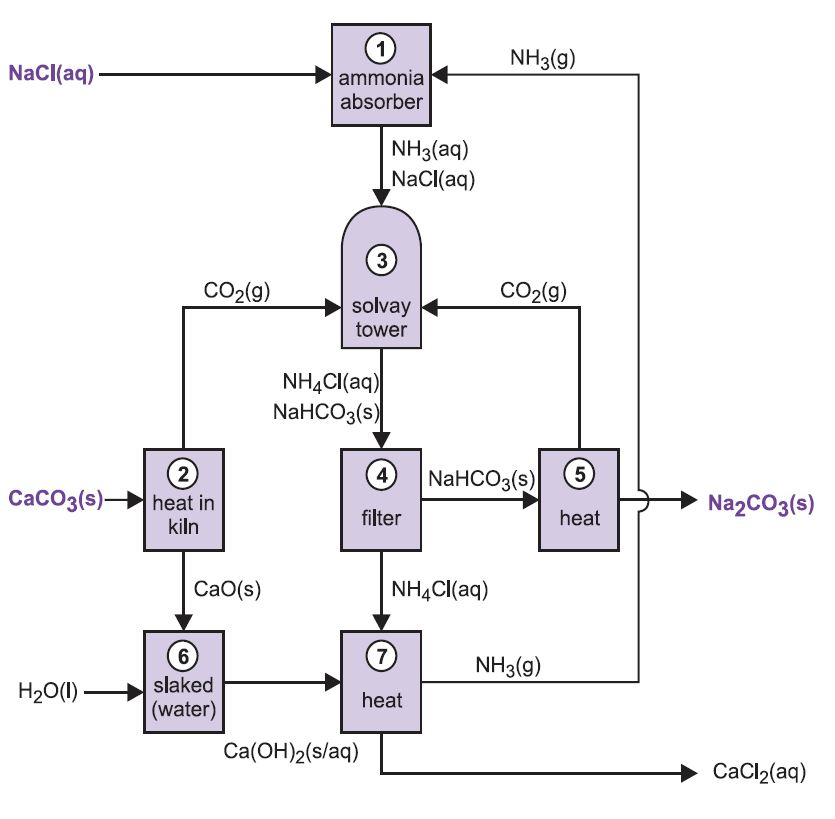
De olika stegen i Solvay-processen är sammankopplade, vilket framgår av diagrammet och beskrivningen nedan.
Figur 2 Solvayprocessens olika steg.
(1) Ammoniakering av saltlösning
Ammoniakgas absorberas i koncentrerad saltlösning för att ge en lösning som innehåller både natriumklorid och ammoniak. Na+(aq), Cl-(aq), NH4+(aq), OH-(aq) joner och NH3(aq) är närvarande.
(2) Bildning av kalciumoxid och koldioxid
Kilnar matas med en blandning av kalksten och koks (13:1 i vikt). Koken brinner i en motström av förvärmd luft:
Förbränningsvärmen höjer temperaturen i ugnen och kalkstenen sönderdelas:
Gasen, som innehåller cirka 40 % koldioxid, befrias från kalkstoft och skickas till kolsyratorn (Solvay). Återstoden, kalciumoxid, används vid återvinning av ammoniak (se steg 7 nedan).
(3) Solvay-tornet
Detta är det viktigaste steget i processen. Den ammoniakhaltiga saltlösningen från steg 1 leds ner genom Solvay-tornet medan koldioxiden från steg 2 och 5 leds upp i det. Solvay-tornet är högt och innehåller en uppsättning svampformade bafflar som bromsar och bryter upp vätskeströmmen så att koldioxiden effektivt kan absorberas av lösningen. Koldioxiden reagerar vid upplösningen med den lösta ammoniaken för att bilda ammoniumvätekarbonat:
Lösningen innehåller nu jonerna Na+(aq), Cl-(aq), NH4+(aq) och HCO3-(aq). Av de fyra ämnen som skulle kunna bildas av olika kombinationer av dessa joner är natriumvätekarbonat (NaHCO3) det minst lösliga. Det fälls ut som ett fast ämne i den nedre delen av tornet, som kyls ned. Nettoprocessen är:
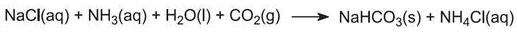
En suspension av fast natriumvätekarbonat i en lösning av ammoniumklorid rinner ut ur tornets bas.
(4) Avskiljning av fast natriumvätekarbonat
Suspensionen filtreras för att avskilja det fasta natriumvätekarbonatet från ammoniumkloridlösningen, som sedan används i steg (7).
(5) Bildning av natriumkarbonat
Natriumvätekarbonatet värms upp i roterande ugnar vid 450 K så att det sönderdelas till natriumkarbonat, vatten och koldioxid:
Koldioxiden skickas tillbaka till Solvay-tornet för användning i steg (3). Produkten från processen, vattenfritt natriumkarbonat, erhålls som ett fint vitt pulver som kallas lätt natriumkarbonat.
(6) Bildning av kalciumhydroxid
De två sista stegen, (6) och (7), handlar om regenerering av ammoniak från ammoniumklorid (tillverkad i steg 3). Den brända kalken från steg (2) släckes med överflödigt vatten vilket ger kalkmjölk:
(7) Regenerering av ammoniak
Denna kalciumhydroxidsuspension blandas med ammoniumkloridlösningen som är kvar från steg (4) och värms upp:
Ammoniaken återvinns på så sätt, och skickas tillbaka till steg (1). Kalciumklorid är den enda biprodukten i hela processen.
Den övergripande processen är elegant. I teorin är de enda råvarorna kalksten och saltvatten. Det är oundvikligt att det uppstår förluster av ammoniak, och dessa kompenseras genom tillsats av extra förnödenheter, vilket krävs i steg (1).
(b) Från trona- och nahcolitmalm
Solvay-processen används inte i USA. Istället använder industrin två malmer och detta står för cirka 30 % av världens produktion. Den ena är trona, som finns i stora mängder i Wyoming. Trona har formeln:
Malmen bryts i fast form och upphettas för att driva bort koldioxid, vilket ger natriumkarbonat:
Den andra malmen är nahcolit som är natriumvätekarbonat. Vid upphettning bildar den natriumkarbonat.