Chemický prvek kobalt se řadí mezi přechodné kovy. Byl objeven v roce 1735 Georgem Brandtem.

Datová zóna
| Klasifikace: | Kobalt je přechodný kov |
| Barva: | modrobílá |
| Atomová hmotnost: | 58.9332 |
| Stav: | pevné |
| Teplota tání: | 1495 oC, 1768 K |
| Teplota varu: | 2930 oC, 3203 K |
| Elektrony: | 27 |
| Protony: | 27 |
| Neutrony v nejhojnějším izotopu: | 32 |
| Elektronové obaly: | 2,8,15,2 |
| Elektronová konfigurace: | 3d7 4s2 |
| Hustota při 20oC: | 8.90 g/cm3 |
Zobrazit více: Sloučeniny, poloměry, vodivosti
| Objem atomu: | 6.7 cm3/mol |
| Struktura: | hcp: hexagonální uzavřený pkd |
| Tvrdost: | 5,0 mohs |
| Specifická tepelná kapacita | 0.42 J g-1 K-1 |
| Tavné teplo | 16,190 kJ mol-1 |
| Teplo atomizace | 426 kJ mol-1 |
| Teplo vypařování | 373.3 kJ mol-1 |
| 1. ionizační energie | 758.4 kJ mol-1 |
| 2. ionizační energie | 1646 kJ mol-1 |
| 3. ionizační energie | 3232.2 kJ mol-1 |
| Elektronová afinita | 63,8 kJ mol-1 |
| Minimální oxidační číslo | -1 |
| Min. běžné oxidační č. | 0 |
| Maximální oxidační číslo | 5 |
| Max. běžné oxidační číslo | 3 |
| Elektronegativita (Paulingova stupnice) | 1.88 |
| Objemová polarizovatelnost | 7,5 Å3 |
| Reakce se vzduchem | mírná, w/ht ? Co3O4 |
| Reakce s 15 M HNO3 | silná, ? Co(NO3)2, NOx |
| Reakce s 6 M HCl | mírná, ? H2, CoCl2 |
| Reakce s 6 M NaOH | – |
| Oxid(y) | CoO, Co3O4 |
| Hydrid(y) | Žádný |
| Chlorid(y) | CoCl2 |
| Atomický poloměr | 135 pm |
| Iontový poloměr (1+ ion) | – |
| Iontový poloměr (2+ ion) | 83.8 pm |
| Iontový poloměr (3+ ion) | 71.8 pm |
| Iontový poloměr (1- ion) | – |
| Iontový poloměr (2- ion) | – |
| Iontový poloměr (3- ion) | – |
| Tepelná vodivost | 100 W m-1 K-1 |
| Elektrická vodivost | 17.9 x 106 S m-1 |
| Teplota tuhnutí/topení: | 1495 oC, 1768 K |
Objev kobaltu
Od starověku se sloučeniny kobaltu používají k výrobě modrého skla a keramiky.
První prvek izoloval švédský chemik George Brandt v roce 1735. Ukázal, že modrou barvu skla způsobuje přítomnost prvku kobaltu, nikoli vizmutu, jak se dříve myslelo.
Přibližně v roce 1741 napsal: „Jako existuje šest druhů kovů, tak jsem také spolehlivými pokusy ukázal…, že existuje také šest druhů polokovů: nový polokov, totiž kobaltový regulus vedle rtuti, vizmutu, zinku a regulusů antimonu a arsenu.“
Slovo kobalt je odvozeno z německého „kobold“, což znamená skřet nebo elf. Autorem obrázku kobaltu níže je Ben Mills.


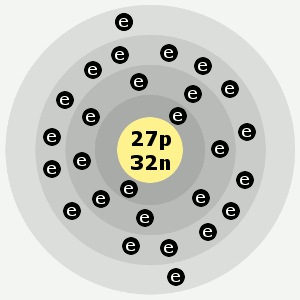
Elektronové obaly kobaltu
Vzhled a vlastnosti
Škodlivé účinky:
Kobalt a jeho sloučeniny jsou považovány za mírně toxické při styku s kůží a středně toxické při požití.
Vlastnosti:
Kobalt je modrobílý, lesklý, tvrdý, křehký kov. Je feromagnetický.
Kov je chemicky aktivní, tvoří mnoho sloučenin. Kobalt zůstává magnetický až do nejvyšší teploty ze všech magnetických prvků (má Curieův bod 1121oC).
Použití kobaltu
Kobalt se používá ve slitinách pro součástky leteckých motorů a ve slitinách s korozivzdorným/opotřebitelným použitím.
Kobalt se široce používá v bateriích a při galvanickém pokovování.
Kobaltové soli se používají k dodávání modré a zelené barvy sklu a keramice.
Radioaktivní 60Co se používá při léčbě rakoviny.
Kobalt je nezbytný pro mnoho živých tvorů a je součástí vitaminu B12.
Kobalt se také používá v samarium-kobaltových permanentních magnetech. Ty se používají v kytarových snímačích a vysokorychlostních motorech.
Obsah a izotopy
Obsah zemské kůry: 25 hmotnostních dílů na milion, 8 molů na milion
Obsah sluneční soustavy:
Cena, čistá: 21 dolarů za 100 g
Cena, volně ložená: 4,40 dolaru za 100 g
Zdroj: Kobalt se v přírodě jako volný prvek nevyskytuje. Nachází se v minerálních rudách. Hlavními rudami kobaltu jsou kobaltit (CoAsS), erytrit (hydratovaný arzeničnan kobaltnatý), glaukodot (Co,Fe)AsS a skutterudit (Co,Ni)As3. Kobalt se obvykle vyrábí jako vedlejší produkt při těžbě niklu a mědi.
Izotopy: Kobalt má 22 izotopů, jejichž poločasy rozpadu jsou známy, s hmotnostními čísly 50 až 72. Přirozeně se vyskytující kobalt se skládá ze svého jediného stabilního izotopu, 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana; or Universal Dictionary of Knowledge,, 1845, svazek 4, str. 693 William Clowes and Sons.
Citovat tuto stránku
Citovat tuto stránku
Pro online odkazování zkopírujte a vložte jeden z následujících odkazů:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
nebo
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
Chcete-li citovat tuto stránku v akademickém dokumentu, použijte prosím následující citaci v souladu s MLA:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.
.