Elementul chimic cobalt este clasificat ca fiind un metal de tranziție. A fost descoperit în 1735 de către George Brandt.

Zona de date
| Clasificare: | Cobaltul este un metal de tranziție |
| Culoarea: | alb-albastru-albastru |
| Greutate atomică: | 58.9332 |
| Stare: | solid |
| Punctul de topire: | 1495 oC, 1768 K |
| Punctul de fierbere: | |
| Punctul de fierbere: | 2930 oC, 3203 K |
| Electroni: | 27 |
| Protoni: | 27 |
| Neutroni în izotopul cel mai abundent: | 32 |
| Capacele de electroni: | |
| : | 2,8,15,2 |
| Configurația electronilor: | 3d7 4s2 |
| Densitate la 20oC: | 8.90 g/cm3 |
Arată mai mult: Călduri, energii, oxidare, reacții,
Compuși, radii, conductivități
| Volumetru atomic: | 6.7 cm3/mol |
| Structură: | |
| Duritate: | 5,0 mohs |
| Capacitate termică specifică | 0.42 J g-1 K-1 |
| Căldura de fuziune | 16.190 kJ mol-1 |
| Căldura de atomizare | 426 kJ mol-1 |
| Căldura de vaporizare | 373.3 kJ mol-1 |
| 1-a energie de ionizare | 758.4 kJ mol-1 |
| 2-a energie de ionizare | 1646 kJ mol-1 |
| 3-a energie de ionizare | 3232.2 kJ mol-1 |
| Afinitatea electronică | 63,8 kJ mol-1 |
| Numărul minim de oxidare | -1 |
| Numărul minim de oxidare comun | |
| Numărul minim de oxidare comun. | 0 |
| Numărul maxim de oxidare | 5 |
| Numărul maxim de oxidare comună | 3 |
| Electronegativitatea (scara Pauling) | 1.88 |
| Volumetrul de polarizabilitate | 7,5 Å3 |
| Reacția cu aerul | blândă, w/ht ? Co3O4 |
| Reacție cu 15 M HNO3 | vigor, ? Co(NO3)2, NOx |
| Reacție cu 6 M HCl | blândă, ? H2, CoCl2 |
| Reacție cu 6 M NaOH | – |
| Oxid(s) | CoO, Co3O4 |
| Hidrură(s) | Nimic |
| Clorură(s) | CoCl2 |
| Atomic. radio | 135 pm |
| Razonul ionic (ion 1+) | – |
| Razonul ionic (ion 2+) | 83.8 pm |
| Rază ionică (ion 3+) | 71.8 pm |
| Rază ionică (ion 1-) | – |
| Rază ionică (ion 2-) | – |
| Rază ionică (3- ion) | – |
| Conductivitatea termică | 100 W m-1 K-1 |
| Conductivitatea electrică | 17.9 x 106 S m-1 |
| Punctul de congelare/topire: | 1495 oC, 1768 K |
Descoperirea cobaltului
Din cele mai vechi timpuri, compușii de cobalt au fost folosiți pentru a produce sticlă albastră și ceramică.
Elementul a fost izolat pentru prima dată de chimistul suedez George Brandt în 1735. El a demonstrat că prezența elementului cobalt era cea care provoca culoarea albastră în sticlă, nu bismutul, așa cum se credea anterior.
În jurul anului 1741 el a scris: „Așa cum există șase feluri de metale, tot așa am demonstrat cu experimente sigure… că există, de asemenea, șase feluri de semimetale: un nou semimetal, și anume regulus de cobalt, în plus față de mercur, bismut, zinc și regulus de antimoniu și arsenic.”
Cuvântul cobalt derivă din germanul „kobold”, care înseamnă spiriduș sau elf. Imaginea cobaltului de mai jos este realizată de Ben Mills.


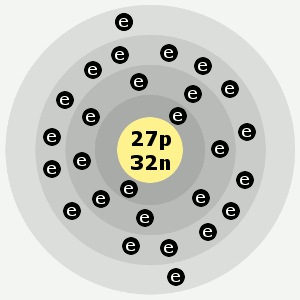
Învelișurile electronice ale cobaltului
Aparență și caracteristici
Efecte nocive:
Cobaltul și compușii săi sunt considerați ușor toxici prin contact cu pielea și moderat toxici prin ingestie.
Caracteristici:
Cobaltul este un metal alb-albăstrui, lucios, dur și casant. Este feromagnetic.
Metal este activ din punct de vedere chimic, formând mulți compuși. Cobaltul rămâne magnetic până la cea mai ridicată temperatură dintre toate elementele magnetice (are un punct Curie de 1121oC).
Utilizări ale cobaltului
Cobaltul este utilizat în aliaje pentru piese de motoare de avion și în aliaje cu utilizări rezistente la coroziune/uzură.
Cobaltul este utilizat pe scară largă în baterii și în galvanizare.
Sărurile de cobalt sunt utilizate pentru a conferi culori albastre și verzi în sticlă și ceramică.
Radioactivitatea 60Co este utilizată în tratamentul cancerului.
Cobaltul este esențial pentru multe ființe vii și este o componentă a vitaminei B12.
Cobaltul este, de asemenea, utilizat în magneții permanenți de samariu-cobalt. Aceștia sunt folosiți la pickup-urile de chitară și la motoarele de mare viteză.
Abundanță și izotopi
Abundanță scoarța terestră: 25 părți pe milion în greutate, 8 părți pe milion în moli
Abundanță sistemul solar: Cobaltul nu se găsește ca element liber în natură. Se găsește în minereuri minerale. Principalele minereuri de cobalt sunt cobaltitul (CoAsS), eritrita (arsenat hidratat de cobalt), glaucodotul (Co,Fe)AsS și skutterudita (Co,Ni)As3. Cobaltul este în general produs ca un subprodus al mineritului de nichel și cupru.
Izotopi: Cobaltul are 22 de izotopi ale căror perioade de înjumătățire sunt cunoscute, cu numere de masă cuprinse între 50 și 72. Cobaltul natural constă în singurul său izotop stabil, 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana; or Universal Dictionary of Knowledge.., 1845, Volume 4, p693 William Clowes and Sons.
Citează această pagină
Citează această pagină
Pentru a crea un link online, vă rugăm să copiați și să lipiți unul dintre următoarele:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
sau
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
Pentru a cita această pagină într-un document academic, vă rugăm să folosiți următoarea citare conformă cu MLA:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.