Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr., MD, PhD, MPH
New York City
Makulární edém představuje patologické nahromadění extracelulární tekutiny v sítnici, především ve vnější plexiformní a vnitřní jaderné vrstvě, jako nespecifickou odpověď na poruchu krevně-retinální bariéry. ME je častou příčinou ztráty zraku u pacientů s diabetes mellitus, žilní okluzí sítnice, uveitidou a po nitroočních operacích. Méně často se vyskytuje při vitreoretinální trakci, choroidální neovaskularizaci a řadě dalších stavů. K léčbě ME bylo použito mnoho strategií s různým úspěchem. Tento článek podává přehled dostupných možností léčby tohoto častého stavu.
 |
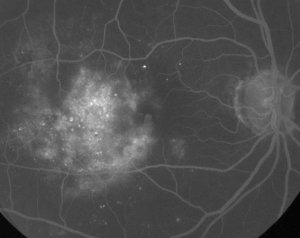 |
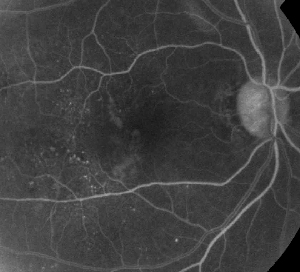
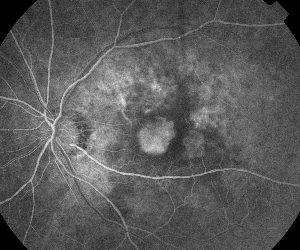
| Obrázek 1. Způsoby, jakými se lze s ME vypořádat. A. Fluoresceinová angiografie časné fáze u pacienta s neproliferativní diabetickou retinopatií. Kromě úniku fluoresceinu ve foveální avaskulární zóně jsou nejvýrazněji vidět mikroaneuryzmata temporálně od fovey. | B. Pozdní fáze FA téhož pacienta ukazující difuzní únik fluorescinu temporálně od foveální avaskulární zóny a v ní, který odpovídá diabetickému makulárnímu edému. |
Diagnostika
Klinická diagnóza ME se nejlépe stanoví pomocí kontaktní čočky a stereoskopické biomikroskopie fundu na štěrbinové lampě. ME se obvykle projevuje jako nepravidelná elevace v sítnici, často v sousedství intraretinálního lipidu, mikroaneuryzmat a/nebo krvácení v případech sekundárního diabetu, vaskulární okluze nebo ischemie. Intraretinální tekutina se může také hromadit v cystických prostorech lokalizovaných v parafoveální sítnici s přilehlými cévními abnormalitami nebo bez nich. Tento cystoidní makulární edém (CME) vzniká nejčastěji v důsledku zánětu, lokalizované trakce nebo po operaci.
Fluoresceinová angiografie je základním nástrojem při diagnostice ME. V normálním oku brání průchodu fluoresceinu do sítnice krevně-sítnicová bariéra. U ME však molekuly fluoresceinu opouštějí intravaskulární prostor a dostávají se do sítnice. Postižená místa vykazují hyperfluorescenci v časných až středních snímcích, která se v pozdějších snímcích zvětšuje (viz obrázek 1). FA nejen zvýrazňuje edém pro snadnou vizualizaci a lokalizaci léčby, ale také vytváří trvalý záznam pro budoucí srovnání. Pro ME byla vyvinuta čtyřstupňová kvantitativní škála, kde stupeň 0 neznamená žádnou perifoveální hyperfluorescenci, stupeň 1 je neúplná perifoveální hyperfluorescence, stupeň 2 je mírná 360stupňová hyperfluorescence, stupeň 3 je střední 360stupňová hyperfluorescence s hyperfluorescenční oblastí o průměru přibližně 1 disku a stupeň 4 je těžká 360stupňová hyperfluorescence s hyperfluorescenční oblastí o průměru přibližně 1,5 disku.1,2 Ačkoli je FA citlivým prostředkem k identifikaci přítomnosti ME, poskytuje relativně málo informací o anatomické distribuci tekutiny, tj. difuzní vs. cystická vs. subretinální, a o závažnosti úniku v čase. FA neposkytuje žádné kvantitativní informace týkající se ztluštění sítnice. Není proto překvapivé, že celkově tento dvourozměrný systém klasifikace založený na FA špatně koreluje s viděním.3,4
Optická koherenční tomografie (OCT III, Carl Zeiss) je bezkontaktní, neinvazivní zobrazovací technika, která poskytuje užitečný doplněk při diagnostice ME. Směřuje paprsek blízkého infračerveného světla (830 nm) kolmo na povrch sítnice a analyzuje vlastnosti odrazů. Za 1,5 sekundy vytvoří jeden lineární obraz průřezu s vysokým rozlišením. Na těchto snímcích lze zobrazit a dokonce změřit ztluštělou, cystickou sítnici, která se vyskytuje v edematózních oblastech. Je také užitečný při zobrazování vlastností sklivcového a sítnicového rozhraní a účinně demonstruje, kdy hraje sklivcová trakce roli při vzniku ME (viz obrázek 2).
Jedna studie použila OCT k vyšetření 84 očí s ME sekundární uveitidou, což přineslo další výhodu v podobě odhalení nebo potvrzení přítomnosti epiretinálních membrán a serózního odchlípení sítnice ve 41, resp. 20 % jejich případů.5 Studie zjistila mírnou korelaci mezi tloušťkou sítnice a klesající zrakovou ostrostí, ačkoli stupeň korelace se v různých studiích lišil, přičemž jiní vyšetřovatelé uváděli slabé,6 střední,7 a silné8,9,10 korelace s použitím různých statistických metod u různých populací pacientů, včetně pacientů s diabetickou retinopatií, uveitidou a CME.
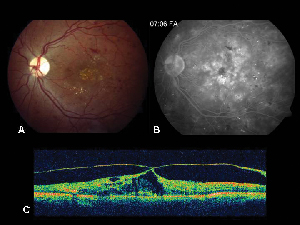
Obrázek 2. A. Barevná fotografie fundu levého oka pacienta s neproliferativní diabetickou retinopatií a exsudací lipidů ve fovee a jejím okolí. B. Pozdní fáze FA odhaluje makulární edém v centrální makule. C. Optická koherenční tomografie prokazuje abnormální vitreoretinální rozhraní i makulární edém.
Jiná skupina uvádí, že OCT je stejně účinná jako FA při detekci ME a lepší než FA při popisu axiální distribuce tekutiny.6 OCT má také schopnost identifikovat některé pacienty s ME, který není zobrazitelný na FA, jako v některých případech chronického CME, kdy je druh aktivního úniku, který je nejlépe zobrazitelný pomocí FA, minimální nebo dokonce chybí, nebo když je vyšetření fundu kompromitováno přítomností opacit v médiích, jako například u pacientů s asteroidní hyalózou.11
Analyzátor tloušťky sítnice (RTA, Talia Technology, Izrael) je podobná bezkontaktní zobrazovací technika, která umožňuje kvantifikaci tloušťky sítnice. Vytváří 16 paralelních průřezových skenů na ploše sítnice o rozměrech 3×3 mm čtverečních analýzou odrazů od šikmo směrovaného pulzu zeleného světla (540 nm) dodávaného po dobu 0,3 sekundy. OCT i RTA prokázaly vynikající přesnost jednotlivých měření tloušťky sítnice a přímé srovnání těchto technologií prokázalo statisticky významnou korelaci mezi jejich měřeními. Zatímco RTA má výhodu rychlého získání dat s možná menším množstvím artefaktů, zdá se, že je méně účinná při měření tloušťky sítnice než OCT v přítomnosti opacit v médiích.12
Jiná studie srovnávala tloušťku fovey pomocí RTA a OCT u 30 zdravých očí. U zdravých očí byla naměřena průměrná tloušťka fovey 181 µm u RTA a 153 µm u OCT. Autoři dospěli k závěru, že RTA občas produkuje falešně vysoké hodnoty, a má tedy sníženou spolehlivost ve srovnání s OCT.13 Naproti tomu analýza pacientů s mírnou neproliferativní diabetickou retinopatií zjistila, že RTA je citlivější než OCT při identifikaci oblastí ztluštění sítnice v počátečních stadiích diabetického ME.14
 |
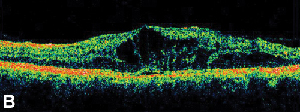 |
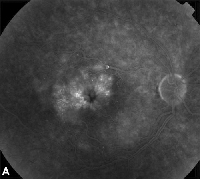
| Obr. 3. Tloušťka sítnice. A. Fluoresceinový angiogram pozdní fáze u pacienta s cystoidním makulárním edémem. | B. Optická koherentní tomografie zobrazující velké cystické prostory ve fovee. |
Léčba -Medicínská
Topické nesteroidní protizánětlivé léky jsou nejčastější léčbou ME po operaci katarakty (viz obrázek 3). Tyto přípravky jsou zaměřeny na snížení hladiny nitroočních prostaglandinů, které se podílejí na patogenezi ME. Dvojitě maskované, randomizované, aktivní a placebem kontrolované studie zahrnující pacienty podstupující operaci katarakty zaznamenaly protizánětlivé účinky lokálně aplikovaných 1% indometacinu, 0,03% flurbiprofenu, 0,5% ketorolaku a 0,1% diklofenakových očních přípravků.15,16 Diklofenak 0,1% a ketorolak 0,5% oční roztoky jsou však jedinými lokálně aplikovanými NSAID, které jsou pro tuto indikaci výslovně schváleny Úřadem pro kontrolu potravin a léčiv. Bylo zjištěno, že terapie kombinující lokální kortikosteroid a kapky NSAID má větší účinnost při léčbě ME než kterýkoli z těchto léků samostatně.16 Ačkoli nejsou schváleny FDA, lokální NSAID se často používají před operací katarakty k prevenci pooperačního ME.
Orální acetazolamid se příležitostně používá při léčbě ME sekundárních zánětlivých stavů a retinitis pigmentosa, zejména pokud selhávají lokální NSAID a kortikosteroidy. Několik prospektivních, maskovaných, zkřížených studií srovnávalo acetazolamid a placebo u pacientů s ME z různých příčin. Pěticyklová zkřížená studie u 41 pacientů zjistila reprodukovatelnou odpověď, charakterizovanou jako částečné nebo úplné vymizení ME, u více než poloviny pacientů s dědičným nebo zánětlivým onemocněním sítnice, ale žádnou odpověď u pacientů s primárním cévním onemocněním sítnice.17 Bylo zjištěno, že acetazolamid v dávce 500 mg/den nebo perorálně podávaný je účinnější než 250 mg/den při léčbě ME u pacientů s ME sekundárním k RP.18 V této studii bylo pozorováno zlepšení u 10 z 12 léčených pacientů.
Jiná skupina došla k závěru, že pacienti mladší 55 let s ME připisovaným chronické iridocyklitidě reagovali na 500 mg acetazolamidu p.o. častěji než starší pacienti.19 Nedávná studie naznačila, že acetazolamid může být účinný i při léčbě ME vyvolaného diabetem.20
Kortikosteroidy jsou silné protizánětlivé látky, které se při léčbě ME často používají. Mají více mechanismů účinku, včetně stabilizace hematoencefalické bariéry a inhibice prozánětlivých mediátorů. Způsoby podání zahrnují lokální podání, periokulární injekce, intravitreální injekce a perorální i intravenózní podání. Perorální a intravenózní kortikosteroidy sice jistě dosahují terapeutických hladin ve sklivci, ale vystavují pacienty dalšímu riziku systémových komplikací, a proto jsou obvykle vyhrazeny pro pacienty se zrak ohrožující uveitidou v rámci systémového onemocnění. Lokální kortikosteroidní kapky jsou na druhém konci spektra bezpečnosti, ale jejich schopnost dosáhnout do zadního segmentu je omezená.
Sub-Tenonovy injekce nabízejí alternativu, jak dodat do oka relativně vysoké dávky kortikosteroidů s nižším rizikem systémových komplikací.21 Ačkoli nebyly provedeny žádné randomizované, kontrolované studie, sub-Tenonovy injekce kortikosteroidů se již mnoho let účinně používají při léčbě makulárního edému. Nejběžnější technika používá krátkou jehlu 25 ga. umístěnou přes superotemporální bulbární spojivku do sub-Tenonova prostoru, zatímco se pacient dívá inferonazálně. Jehla se posouvá posteriorně podél koule klouzavým pohybem ze strany na stranu, aby se zabránilo neúmyslnému proniknutí do koule, dokud náboj nedosáhne místa vstupu do spojivky, kdy je podán lék. Jedna zpráva zahrnovala 20 po sobě jdoucích pacientů se středně těžkou uveitidou spojenou se ztrátou zraku, kteří byli léčeni subtenonovou injekcí 40 mg triamcinolon acetonidu.22 Ačkoli ne všichni pacienti vykazovali ME na FA, 67 % z nich se po jedné léčbě zlepšilo o dva řádky vidění. Rizika tohoto postupu zahrnují mimo jiné trvale zvýšený nitrooční tlak, kataraktu, ptózu a nitrooční penetraci.
V poslední době se rozšířilo používání intravitreální injekce triamcinolon acetonidu (Kenalog, 4,0 mg) vzhledem k jeho silné schopnosti zmírnit refrakterní ME sekundární k diabetes mellitus (viz obrázek 4), žilním okluzím sítnice, zánětům a dalším idiopatickým příčinám.23-26 Předběžné studie ukazují dramatické snížení ztluštění sítnice, snížení úniku fluoresceinu a zlepšení zraku, které může být u některých pacientů výrazné. Ačkoli je účinek dočasný a obvykle trvá tři až šest měsíců nebo méně, ME obvykle reaguje na opakovanou injekci. Použití intravitreálních kortikosteroidů je však spojeno s 30- až 40procentním rizikem přetrvávajícího zvýšeného nitroočního tlaku a přibližně 10procentním rizikem katarakty vyžadující chirurgický zákrok. Národní oční institut v současné době přijímá pacienty do studie SCORE, standardní péče vs. kortikosteroidy pro okluzi sítnicové žíly, která porovnává intravitreální injekce triamcinolonu (v dávkách 1 a 4 mg) se standardní péčí (pozorování a/nebo ošetření mřížkovým laserem) u pacientů s ME sekundární okluzí žíly. Studie bude sledovat celkem 1 260 pacientů a bude pokračovat v léčbě po dobu 36 měsíců.
ME se vyskytuje také u věkem podmíněné makulární degenerace (viz obrázek 5). V současné době se zkouší intravitreální injekce triamcinolon acetonidu pro kombinované použití s fotodynamickou terapií pro léčbu neovaskulární AMD (Visudyne s intravitreálním triamcinolon acetonidem, VisTA). Jedna studie zdůrazňuje význam intravitreálního triamcinolonu předcházejícího aplikaci PDT u pacientů s makulárním edémem a CNV.27 Autoři teoreticky předpokládají, že verteporfin může po fotoaktivaci léku unikat do cystických intraretinálních prostor, což vede k poškození fotoreceptorů přilehlé, normální sítnice, zatímco předchozí řešení edému sítnice může této komplikaci zabránit. Předběžné podání kortikosteroidu může také sloužit k otupení případného zvýšení hladin nitroočního VEGF vyvolaného PDT.
Samotné intravitreální injekce jsou spojeny s malým, ale určitým rizikem závažných, potenciálně oslepujících vedlejších účinků, včetně infekční endoftalmitidy, odchlípení sítnice, krvácení, oční hypertenze, katarakty a hypotonie.28 Nedávno publikované pokyny pro intravitreální injekce se snaží stanovit nejlepší postupy pro tuto stále častěji používanou techniku. Doporučení konsenzuálního panelu se zabývala otázkami před injekcí, včetně antibiotik, vyhodnocení glaukomu, použití rukavic a léčby již existujících abnormalit víček, jakož i významem zamezení nadměrné manipulace s víčky před a během zákroku. Doporučený režim před injekcí zahrnoval použití lokálního a/nebo subkonjunktiválního anestetika, lokálního jodovaného povidonu a očního zrcátka. Autoři zdůraznili význam sledování IOP a přímé vizualizace fundu po injekci k ověření perfuze zrakového nervu, intravitreální lokalizace triamcinolonu a nepřítomnosti krvácení spojeného s injekcí nebo odchlípením sítnice. Zdůraznili také význam edukace pacientů vůči včasným příznakům možných komplikací a důkladného sledování.29
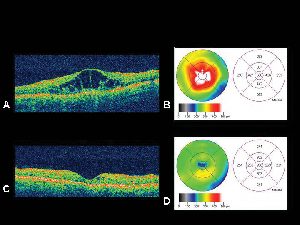
Obrázek 4. A. Optický koherentní tomografický obraz oka s diabetickým makulárním edémem s odpovídající mapou tloušťky sítniceB. vytvořenou pomocí OCT. C. OCT téhož pacienta měsíc po intravitreální injekci triamcinolon acetonidu s odpovídající mapou tloušťky sítnice. D. Řešení makulárního edému. Zraková ostrost se po léčbě zlepšila z 20/200 na 20/80.
Několik studií zkoumá alternativní zařízení pro dlouhodobé podávání kortikosteroidů uvnitř oka. Jedna studie zahrnuje chirurgické umístění pelety fluocinolonacetonidu usazené na plastové struně s řízeným uvolňováním steroidů po dobu tří let. Známý jako intravitreální implantát Envision od společností Bausch & Lomb a Control Delivery Systems je umístěn přes pars plana a přišit ke skléře. Randomizovaná, maskovaná studie fáze II/III srovnávala implantát Envision TD u 80 pacientů randomizovaných na 0,5 vs. 2,0 mg fluocinolon acetonidu oproti standardní péči sestávající z laserové fotokoagulace nebo pozorování. Po šesti měsících bylo pozorováno statisticky významné snížení ME a závažnosti diabetické retinopatie u 0,5-mg implantátu ve srovnání se standardní péčí. Kromě toho nebyly zjištěny žádné rozdíly ve výskytu závažných nežádoucích účinků. Rameno studie s implantátem 2,0 mg bylo předčasně ukončeno vzhledem k výsledkům pozorovaným v druhé studii, v níž nebyla zaznamenána žádná výhoda oproti 0,5 mg. Do druhé studie bylo zařazeno 278 pacientů s neinfekční zadní uveitidou, kteří byli randomizováni tak, aby dostávali buď 0,59 mg, nebo 2,1 mg Retisert implantátu do postiženého oka, nebo v oboustranných případech do silněji postiženého oka. Po dvou dávkách a 34 týdnech byla zaznamenána významně nižší míra recidivy u očí s implantátem (10 vs. 55,7 %, p<0,0001) s poklesem užívání systémové kortikosteroidní/imunosupresivní terapie (59,0 % na počátku vs. 13,7 % po 34 týdnech), stejně jako užívání subtenonových a lokálních steroidů. Došlo k významnému zlepšení zrakové ostrosti (p<0,05). Mezi nejčastější nežádoucí účinky patřila progrese katarakty a zvýšený nitrooční tlak, který si v 8,6 procentech případů vyžádal filtrační zákrok. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
Další studie se týká přípravku Posurdex společnosti Allergan, bioerodovatelné pelety dexametazonu vstřikované do sklivcového prostoru, která uvolňuje lék po dobu 50 až 160 dnů. Výsledky studie fáze II ukázaly, že jak 350 µg, tak 700 µg peleta významně zlepšily procento pacientů se zlepšením zraku o dvě a více čar (27,2 % a 35,7 % 350 µg a 700 µg), stejně jako se zlepšením zraku o tři a více čar (13 % a 19,4 %, pro 350 µg a 700 µg) po 180 dnech ve srovnání s placebem. Dosud nebyl zaznamenán zvýšený výskyt katarakty, ačkoli zvýšení IOP bylo pozorováno asi u 15 procent pacientů.
Léčba -Laser
Nejnověji byl přípravek Macugen společností Eyetech a Pfizer zkoumán v randomizované, dvojitě maskované, multicentrické, dávkově řízené studii fáze II u 172 pacientů s diabetickým ME. Studie zkoumala tři dávky (0,3 mg, 1,0 mg, 3,0 mg) oproti falešným injekcím podávaným každých šest týdnů po třech injekcích. Zatímco předtím byli zkoušející fokálního/mřížkového laseru požádáni, aby zařadili pouze pacienty, u nichž se cítili pohodlně, když odložili fokální/mřížkový laser o nejméně 12 týdnů. Další injekce a/nebo fokální/mřížková fotokoagulace byly podávány podle uvážení zkoušejícího od 18. do 30. týdne. Závěrečné hodnocení bylo provedeno v 36. týdnu, tedy šest týdnů po poslední plánované injekci. Celkově měly subjekty, kterým byl podáván přípravek Macugen, lepší výsledky vidění, častěji vykazovaly snížení centrální tloušťky sítnice a byly považovány za méně pravděpodobné, že budou potřebovat další laserovou terapii ve srovnání s pacienty, kterým byl podáván falešný přípravek.31 V současné době je plánována potvrzující studie fáze III.
Fokální/mřížková laserová fotokoagulace zůstává standardem léčby diabetického ME. Studie Early Treatment Diabetic Retinopathy Study ukázala, že u pacientů léčených mřížkovým laserem došlo v porovnání s pozorováním k 50procentnímu snížení středně těžké ztráty zraku, definované jako zdvojnásobení zorného úhlu nebo snížení vidění o tři řádky.30 Ačkoli přesný mechanismus, jakým laser snižuje ME, není znám, předpokládá se, že podporuje tvorbu těsných spojů mezi buňkami RPE a také snižuje potřebu kyslíku z fotoreceptorů a zvyšuje perfuzi kyslíku z cévnatky.31 Studie EDTRS identifikovala pacienty vhodné pro fokální laserovou fotokoagulaci jako pacienty s klinicky významným ME. Ta byla definována jako splnění jednoho z následujících tří kritérií: 1) ztluštění sítnice nacházející se do 500 µm od fovey; 2) tvrdé exsudáty ve vzdálenosti menší než 500 µm od fovey spojené s přilehlým ztluštěním sítnice; nebo 3) oblast edému o průměru 1 disku nebo větší, jejíž jakákoli část se nachází ve vzdálenosti menší než 1 průměr disku od fovey. EDTRS však nerozlišuje mezi fokálním ME, který odpovídá lokálnímu ztluštění sítnice přiléhajícímu k mikroaneuryzmatu, a difuzním ME, který se týká generalizovaného ztluštění zadního pólu. Z neoficiálních údajů vyplývá, že fokální diabetický ME dobře reaguje na fokální/mřížkový laser, zatímco difuzní varianta častěji selhává při laserové léčbě a vyžaduje alternativní léčbu.
 |
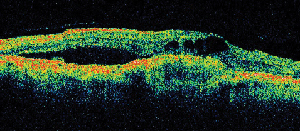 |
| Obrázek 5. Léčba fokálního ME. A. Časný fluoresceinový angiogram zobrazující klasickou subfoveální neovaskularizaci. | B. Odpovídající optická koherentní tomografie odhaluje oblasti subretinální a intraretinální akumulace tekutiny a také prokazuje neovaskularizaci (šipka). |
Léčba -chirurgie
První skupina, která uvedla přínos vitrektomie a separace zadního hyaloidu u pacientů s diabetickým ME, naznačila, že existuje podskupina pacientů, u nichž ke ztluštění sítnice přispívá sklivcová trakce a mělké makulární odchlípení.32 To bylo následně potvrzeno pomocí OCT, což vedlo k upřesnění indikací pro tuto techniku.33,34 Tři největší série35,36,37 pacientů podstupujících vitrektomii pro diabetický ME nereagující na méně invazivní léčbu analyzovaly 59, 58 a 65 pacientů. Uvádějí, že u 47 %, 53 % a 45 % jejich pacientů došlo ke zlepšení vidění o dvě řádky nebo více. Poslední z nich uváděla závažné pooperační komplikace, které se objevily u menšiny pacientů, včetně odchlípení sítnice (1,5 procenta), rubeosis iridis (4,6 procenta) epiretinální membrány (13,8 procenta), opakovaného krvácení do sklivce(1,5 procenta) a ložisek tvrdého exsudátu ve fovee (4,6 procenta), zatímco komplikace odhalené druhou skupinou zahrnovaly epiretinální membrány u 10,2 procenta a katarakty u 63,2 procenta fakických očí. Několik dalších sérií případů ukázalo podobné výsledky, všechny však byly nerandomizované, bez kontroly placebem a s použitím různých kritérií pro zařazení a vyloučení. Dále se také lišily operační techniky, takže přesné indikace k vitrektomii u pacientů s CME zůstávají otevřené interpretaci.
ME zůstává hlavní příčinou ztráty zraku navzdory různým dostupným způsobům léčby. Laserová fotokoagulace zůstává nedílnou součástí léčby ME v důsledku diabetu, ischemie a cévních okluzí. Lokální NSAID a kortikosteroidy jsou v současné době hlavní metodou kontroly pooperačního ME, zatímco acetazolamid zůstává účinným prostředkem léčby u vybraných pacientů s ME sekundárním v důsledku uveitidy a retinitis pigmentosa. Úloha intravitreálních kortikosteroidů v terapii ME se rozšiřuje, ale zůstává omezena vedlejšími účinky a dobou trvání účinku. Zdokonalení chirurgických technik bude i nadále přidávat nový rozměr ME nereagujícímu na méně invazivní léčbu, zatímco pokroky ve farmakoterapii a očním podávání léků slibují hrát roli v prevenci a léčbě všech příčin a typů ME.
Dr. Ober působí v oboru vitreoretinální chirurgie v Očním institutu Edwarda S. Harknesse na Kolumbijské univerzitě (Columbia University College of Physicians and Surgeons) a v Centru pro výzkum sítnice LuEsther T. Mertz v nemocnici Manhattan Eye, Ear and Throat Hospital. Kontaktujte ho na adrese 210 East 64th St., 8th Fl, New York, NY 10021; e-mail: [email protected]; nebo (212) 605 3777 či fax (212) 605 3795.
Dr. Klais působí v Centru pro výzkum sítnice LuEsther T. Mertzové. Kontaktujte ji na stejné adrese, telefonním či faxovém čísle nebo e-mailem na adrese [email protected].
Dr. Cunningham je klinickým profesorem oftalmologie a ředitelem služby pro léčbu zánětu očního nervu na New York University, School of Medicine. Je také zaměstnancem společnosti Eyetech Pharmaceuticals Inc. a kontaktujte ho na adrese Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., New York, N.Y. 10022, e-mailem [email protected] nebo telefonicky/faxem na čísle (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Chronický cystoidní makulární edém a prediktory zrakové ostrosti. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. Pohled na léčbu afakického cystoidního makulárního edému. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Pooperační cystoidní makulární edém. In: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity (Makulární ztluštění a zraková ostrost). Měření u pacientů s cystoidním makulárním edémem. Ophthalmology 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Patterns of macular edema in patients with uveitis: qualitative and quantitative assessment using optical coherence tomography. Ophthalmology 2004;111:946-53.
6. Antcliff RJ, Stanford MR, Chauhan DS, et al. Comparison between optical coherence tomography and fundus fluorescein angiography for the detection of cystoid macular edema in patients with uveitis. Ophthalmology 2000; 107:593-9.
7. Otani T, Kishi S, Maruyama Y. Patterns of diabetic macular edema with optical coherence tomography. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. Kvantitativní hodnocení makulárního edému pomocí optické koherentní tomografie. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Měření u pacientů s cystoidním makulárním edémem. Ophthalmology 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. Optical coherence tomographic assessment of diabetic macular edema: comparison with fluorescein angiographic and clinical findings. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. Optická koherentní tomografie k detekci makulárního edému v přítomnosti asteroidní hyalózy. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Comparison between retinal thickness analyzer and optical coherence tomography for assessment of foveal thickness in eyes with macular disease. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Porovnání tloušťky fovey měřené pomocí analyzátoru tloušťky sítnice a optické koherentní tomografie. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Tloušťka sítnice u očí s mírnou neproliferativní retinopatií u pacientů s diabetes mellitus 2. typu: srovnání měření získaných analýzou tloušťky sítnice a optickou koherentní tomografií. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Inhibitory cyklooxygenázy v oftalmologii. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac versus prednisolon versus kombinovaná terapie v léčbě akutního pseudofakického cystoidního makulárního edému. Ophthalmology 2000;107:2034-8.
17. Cox SN, Hay E, Bird AC. Léčba chronického makulárního edému acetazolamidem. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Acetazolamid k léčbě chronického makulárního edému u retinitis pigmentosa. Arch Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. Redukce makulárního edému acetazolamidem u pacientů s chronickou iridocyklitidou: randomizovaná prospektivní zkřížená studie. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. Je acetazolamid účinný v léčbě diabetického makulárního edému? Pilotní studie. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Zadní subtenonské injekce kortikosteroidů u pacientů s uveitidou a cystoidním makulárním edémem. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. Účinky zadní subtenonové injekce triamcinolon acetonidu u pacientů se středně těžkou uveitidou. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Intravitreální triamcinolon u refrakterního pseudofakického makulárního edému. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Intravitreální triamcinolon acetonid jako léčba makulárního edému při okluzi centrální retinální žíly. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Intravitreální triamcinolon pro refrakterní diabetický makulární edém. Ophthalmology 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW Jr, Rosenfeld PJ. Intravitreální triamcinolon acetonid u idiopatického cystoidního makulárního edému. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sequenced Combined Intravitreal Triamcinolone and Indocyanine Green Angiography Guided Photodynamic Therapy for Retinal Angiomatous Proliferation. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Rizika intravitreální injekce: komplexní přehled. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Evolving guidelines for intravitreal injections. Retina 2004 Oct;24(5 Suppl):S3-19.
30. .G.Jaffe, Fluocinolone Acetonide Uveitis Study Group. Intravitreální implantace fluocinolon acetonidu při uveitidě postihující zadní segment oka. ARVO 2004, poster #3369.
31. Studijní skupina pro diabetickou retinopatii Macugen. Randomizovaná, dvojitě maskovaná studie fáze II pegaptanibu, aptameru proti vaskulárnímu endoteliálnímu růstovému faktoru, pro diabetický makulární edém. Ophthalmology, In press.
32. 30. Fotokoagulace u diabetického makulárního edému. Studie časné léčby diabetické retinopatie, zpráva číslo 1. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Chirurgická a jiná léčba diabetického makulárního edému: aktualizace. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrektomie pro diabetickou makulární trakci a edém spojený se zadní hyaloidní trakcí. Ophthalmology 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Makulární trakční odchlípení a diabetický makulární edém spojený se zadní hyaloidní trakcí. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. Úloha vitrektomie v léčbě diabetického makulárního edému. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrektomie u diabetického makulárního edému spojeného s napjatým premakulárním zadním hyaloidem. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrektomie pro difuzní makulární edém v případě diabetické retinopatie. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Časné pooperační změny tloušťky sítnice a komplikace po vitrektomii pro diabetický makulární edém. Am J Ophthalmol 2003;135:14-9.
.