Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr., MD, PhD, MPH
New York City
Maculair oedeem is de pathologische ophoping van extracellulaire vloeistof in het netvlies, voornamelijk in de buitenste plexiforme en binnenste kernlagen, als een aspecifieke reactie op een storing in de bloed-retinale barrières. ME is een frequente oorzaak van gezichtsverlies bij patiënten met diabetes mellitus, veneuze occlusie van het netvlies, uveïtis, en na intraoculaire chirurgie. Het komt minder vaak voor bij vitreoretinale tractie, choroïdale neovascularisatie en een aantal andere aandoeningen. Er zijn vele strategieën toegepast om ME te behandelen, met wisselend succes. Dit artikel geeft een overzicht van de beschikbare behandelingsmogelijkheden voor deze veel voorkomende aandoening.
 |
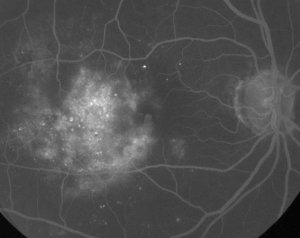 |
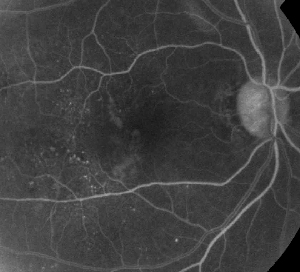
| Figuur 1. A. Vroege fase fluoresceïne-angiografie van een patiënt met niet-proliferatieve diabetische retinopathie. Microaneurysma’s zijn het duidelijkst te zien temporaal van de fovea naast fluoresceïne lekkage in de foveale avasculaire zone. | B. FA in de late fase van dezelfde patiënt toont diffuse lekkage temporaal aan en binnen de foveale avasculaire zone die overeenkomt met diabetisch maculair oedeem. |
Diagnose
De klinische diagnose van ME wordt het best gesteld met behulp van een contactlens en stereoscopische spleetlamp fundus biomicroscopie. ME manifesteert zich meestal als een onregelmatige verhoging in het netvlies, vaak grenzend aan intraretinale lipiden, microaneurysma’s en/of bloedingen in gevallen die secundair zijn aan diabetes mellitus, vasculaire occlusie, of ischemie. Intraretinaal vocht kan zich ook ophopen in cystische ruimten gelokaliseerd in het parafoveale netvlies met of zonder aangrenzende vasculaire afwijkingen. Dit cystoïd maculair oedeem (CME) is meestal het gevolg van ontsteking, plaatselijke tractie, of na chirurgie.
Fluoresceïne-angiografie is een essentieel hulpmiddel bij de diagnose van ME. In het normale oog wordt fluoresceïne door de bloed-retinale barrières verhinderd om in het netvlies te komen. Bij ME echter verlaten fluoresceïnemoleculen de intravasculaire ruimte om het netvlies binnen te dringen. De aangetaste plaatsen vertonen hyperfluorescentie in de vroege tot middenbeelden die toeneemt in oppervlakte en intensiteit in latere beelden (zie figuur 1). FA brengt niet alleen oedeem aan het licht voor een gemakkelijke visualisatie en lokalisatie van de behandeling, maar creëert ook een permanente registratie voor toekomstige vergelijking. Een kwantitatieve schaal van vier graden werd ontwikkeld voor ME, waarin graad 0 geen perifoveale hyperfluorescentie is, graad 1 onvolledige perifoveale hyperfluorescentie, graad 2 milde 360-graden hyperfluorescentie, graad 3 matige 360-graden hyperfluorescentie met een hyperfluorescerend gebied van ongeveer 1 schijfdiameter in doorsnee, en graad 4 ernstige 360-graden hyperfluorescentie met een hyperfluorescerend gebied van ongeveer 1,5 schijfdiameter in doorsnee.1,2 Hoewel FA een gevoelig middel is om de aanwezigheid van ME vast te stellen, geeft het relatief weinig informatie over de anatomische verdeling van de vloeistof, d.w.z. diffuus vs. cystisch vs. subretinaal, en de ernst van het lek in de loop van de tijd. FA geeft geen kwantitatieve informatie over de verdikking van het netvlies. Het is dan ook niet verwonderlijk dat dit op tweedimensionale FA gebaseerde beoordelingssysteem slecht correleert met het gezichtsvermogen.3,4
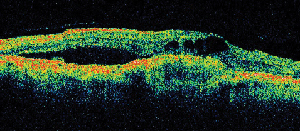
Optische coherentie tomografie (OCT III, Carl Zeiss) is een contactloze, niet-invasieve beeldvormingstechniek die een nuttige aanvulling vormt bij de diagnose van ME. Het richt een bundel nabij infrarood licht (830 nm) loodrecht op het netvliesoppervlak en analyseert de eigenschappen van de weerkaatsingen. In 1,5 seconde produceert het een enkele lineaire dwarsdoorsnede-afbeelding met hoge resolutie. Deze beelden kunnen het verdikte, cystische netvlies dat in oedeemachtige gebieden wordt aangetroffen, tonen en zelfs meten. Het is ook nuttig bij het visualiseren van de eigenschappen van de vitreoretinale interface en toont effectief aan wanneer glasvochttractie een rol speelt bij de vorming van ME (zie figuur 2).
Eén studie gebruikte OCT om 84 ogen met ME secundair aan uveïtis te onderzoeken, wat als bijkomend voordeel had dat de aanwezigheid van epiretinale membranen en sereuze netvliesloslating werd onthuld of bevestigd in respectievelijk 41 en 20 procent van hun gevallen.5 De studie vond een matige correlatie tussen netvliesdikte en afnemende gezichtsscherpte, hoewel de mate van correlatie varieerde in de verschillende studies; andere onderzoekers meldden zwakke,6 matige,7 en sterke8,9,10 correlaties met gebruikmaking van verschillende statistische methoden in diverse patiëntenpopulaties, waaronder patiënten met diabetische retinopathie, uveïtis en CME.
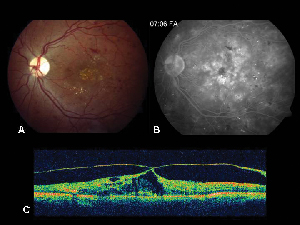
Figuur 2. A. Kleurenfundusfoto van het linkeroog van een patiënt met niet-proliferatieve diabetische retinopathie en lipide-exsudatie in en rond de fovea. B. FA in de late fase toont maculair oedeem in de centrale macula. C. Optische coherentietomografie toont de abnormale vitreoretinale interface en het maculaire oedeem.
Een andere groep meldde dat OCT even doeltreffend was als FA voor het opsporen van ME en superieur aan FA voor het beschrijven van de axiale verdeling van het vocht.6 OCT kan ook bepaalde patiënten met ME identificeren die niet zichtbaar zijn met FA, zoals in bepaalde gevallen van chronische CME waar het soort actieve lekkage dat het best zichtbaar is met FA minimaal of zelfs afwezig is, of wanneer fundusonderzoek wordt bemoeilijkt door de aanwezigheid van mediaopaciteiten, zoals bij patiënten met asteroïde hyalosis.11
De retinale dikte-analysator (RTA, Talia Technology, Israël) is een vergelijkbare contactloze beeldvormingstechniek waarmee de retinale dikte kan worden gekwantificeerd. Het produceert 16 parallelle dwarsdoorsnede scans over een 3×3 vierkante mm gebied van het netvlies door het analyseren van reflecties van een schuin gerichte puls van groen licht (540 nm) afgegeven gedurende 0,3 seconden. Zowel OCT als RTA hebben een uitstekende precisie in hun individuele metingen van de dikte van het netvlies aangetoond, en een directe vergelijking van de technologieën heeft een statistisch significante correlatie tussen hun metingen aangetoond. Hoewel RTA het voordeel heeft van snelle acquisitie met misschien minder artefacten, lijkt het minder effectief te zijn in het meten van de retinale dikte dan OCT in de aanwezigheid van media-opaciteiten.12
Een andere studie vergeleek de foveale dikte met RTA en OCT in 30 gezonde ogen. De gemiddelde foveale dikte in de normale ogen werd gemeten op 181 µm en 153 µm voor RTA en OCT, respectievelijk. De auteurs concludeerden dat RTA af en toe vals hoge waarden produceert, en dus een verminderde betrouwbaarheid heeft in vergelijking met OCT.13 Daarentegen werd in een analyse van patiënten met milde niet-proliferatieve diabetische retinopathie vastgesteld dat RTA gevoeliger was dan OCT bij het identificeren van gebieden van netvliesverdikking tijdens de eerste stadia van diabetische ME.14
 |
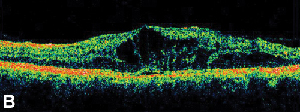 |
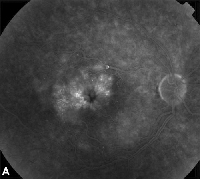
| Figuur 3. A. Late fase fluoresceïne-angiogram van een patiënt met cystoïd maculair oedeem. | B. Optische coherentietomografie die de grote cystische ruimten bij de fovea toont. |
Behandelingen -Medisch
Topische niet-steroïde anti-inflammatoire geneesmiddelen zijn de meest gebruikelijke behandeling voor ME na cataractchirurgie (zie figuur 3). Deze middelen zijn gericht op het verlagen van intra-oculaire prostaglandine niveaus, die betrokken zijn bij de pathogenese van ME. Dubbel gemaskeerde, gerandomiseerde, actieve en placebo-gecontroleerde studies met patiënten die cataractchirurgie ondergingen, hebben ontstekingsremmende effecten gerapporteerd van plaatselijk aangebrachte 1% indomethacine, 0,03% flurbiprofen, 0,5% ketorolac en 0,1% diclofenac oogheelkundige preparaten.15,16 Diclofenac 0,1% en ketorolac 0,5% oogheelkundige oplossingen zijn echter de enige plaatselijk aangebrachte NSAID’s die specifiek goedgekeurd zijn door de Food and Drug Administration voor deze indicatie. Therapie waarbij een uitwendig corticosteroïd en NSAID-druppels worden gecombineerd, blijkt een grotere werkzaamheid te hebben bij de behandeling van ME dan elk van beide geneesmiddelen afzonderlijk.16 Hoewel ze niet door de FDA zijn goedgekeurd, worden uitwendige NSAID’s vaak gebruikt vóór cataractchirurgie om postoperatieve ME te voorkomen.
Oraale acetazolamide wordt af en toe gebruikt bij de behandeling van ME secundair aan ontstekingsaandoeningen en retinitis pigmentosa, vooral wanneer topische NSAID’s en corticosteroïden falen. Verscheidene prospectieve, gemaskeerde, cross-over studies vergeleken acetazolamide en placebo bij patiënten met ME door een verscheidenheid van oorzaken. Een cross-over studie met vijf cycli bij 41 patiënten vond een reproduceerbare respons, gekarakteriseerd als gedeeltelijke of volledige oplossing van ME, bij meer dan de helft van de patiënten met erfelijke of inflammatoire retinale aandoeningen, maar geen respons bij degenen met primaire retinale vasculaire aandoeningen.17 Een oraal of 500 mg/dag acetazolamide bleek effectiever te zijn dan 250 mg/dag bij de behandeling van ME bij patiënten met ME secundair aan RP.18 In deze studie werd verbetering waargenomen bij 10 van de 12 behandelde patiënten.
Een andere groep concludeerde dat patiënten jonger dan 55 jaar met ME toegeschreven aan chronische iridocyclitis eerder reageerden op 500 mg acetazolamide b.i.d. dan oudere patiënten.19 Een recente studie heeft gesuggereerd dat acetazolamide ook effectief kan zijn voor de behandeling van door diabetes veroorzaakte ME.20
Corticosteroïden zijn krachtige ontstekingsremmende middelen die veelvuldig worden gebruikt bij de behandeling van ME. Ze hebben meerdere werkingsmechanismen, waaronder stabilisatie van de bloed-retinale barrière en remming van pro-inflammatoire mediatoren. De toedieningswijzen omvatten lokale, perioculaire injectie, intravitreale injectie, en zowel orale als intraveneuze toediening. Hoewel orale en IV-corticosteroïden zeker therapeutische niveaus bereiken in het glasvocht, stellen zij patiënten bloot aan het bijkomende risico van systemische complicaties, en worden daarom gewoonlijk gereserveerd voor patiënten met zichtbedreigende uveïtis in de setting van systemische ziekte. Topische corticosteroïdedruppels staan aan de andere kant van het veiligheidsspectrum, maar hun vermogen om het achterste segment te bereiken is beperkt.
Sub-Tenon’s injecties bieden een alternatief om relatief hoge doses corticosteroïden aan het oog toe te dienen met lagere risico’s op systemische complicaties.21 Hoewel er geen gerandomiseerde, gecontroleerde trials zijn geweest, wordt sub-Tenon’s corticosteroïden injectie al vele jaren effectief gebruikt bij de behandeling van maculair oedeem. De meest gebruikelijke techniek maakt gebruik van een korte 25-ga. naald die door de superotemporale bulbar conjunctiva in de sub-Tenon ruimte wordt geplaatst terwijl de patiënt inferonasaal kijkt. De naald wordt posterieur langs de oogbol gebracht met een vegende zijwaartse beweging om onbedoelde penetratie van de oogbol te voorkomen, totdat de hub de conjunctivale intredeplaats bereikt, waar de medicatie wordt toegediend. In één rapport werden 20 opeenvolgende patiënten met intermediaire uveïtis behandeld met een subtenon injectie van 40 mg triamcinolonacetonide.22 Hoewel niet bij alle patiënten ME op FA werd aangetoond, verbeterde 67 procent met twee lijnen van het gezichtsvermogen na één behandeling. Risico’s van deze procedure zijn onder andere blijvend verhoogde intraoculaire druk, cataract, ptosis en intraoculaire penetratie.
Recentelijk is het gebruik van intravitreale injectie van triamcinolonacetonide (Kenalog, 4,0 mg) toegenomen vanwege zijn krachtige vermogen om refractaire ME secundair aan diabetes mellitus (zie figuur 4), retinale veneuze occlusies, ontsteking, en andere idiopathische oorzaken te verbeteren.23-26 Voorlopige studies tonen een drastische vermindering van de verdikking van het netvlies, een afname van fluoresceïne lekkage, en een visuele verbetering die bij sommige patiënten duidelijk kan zijn. Hoewel het effect tijdelijk is en gewoonlijk drie tot zes maanden of minder duurt, reageert de ME gewoonlijk op herinjectie. Het gebruik van intravitreale corticosteroïden gaat echter gepaard met een risico van 30 tot 40% op een blijvend verhoogde intraoculaire druk en een risico van ongeveer 10% op cataract waarvoor chirurgie nodig is. Het National Eye Institute is momenteel patiënten aan het inschrijven voor SCORE, de standaardzorg vs. corticosteroïden voor netvliesader occlusie studie, die intravitreale injecties van triamcinolone (1- en 4-mg doses) vergelijkt met standaardzorg (observatie en/of netlaserbehandeling) bij patiënten met ME secundair aan ader occlusie. De studie zal in totaal 1.260 patiënten volgen en de behandeling gedurende 36 maanden voortzetten.
ME komt ook voor bij leeftijdsgebonden maculadegeneratie (zie figuur 5). Intravitreale injectie van triamcinolonacetonide wordt momenteel onderzocht voor gecombineerd gebruik met fotodynamische therapie voor de behandeling van neovasculaire AMD (Visudyne met intravitreaal triamcinolonacetonide, VisTA). Eén studie benadrukt het belang van intravitreale triamcinolon voorafgaand aan de toepassing van PDT bij patiënten met maculair oedeem en CNV.27 De auteurs theoretiseren dat verteporine kan lekken in cystische intraretinale ruimten, wat kan leiden tot beschadiging van de fotoreceptor van het aangrenzende, normale netvlies zodra het geneesmiddel wordt geïnactiveerd, terwijl het vooraf oplossen van retinaal oedeem deze complicatie kan voorkomen. Voorafgaande toediening van corticosteroïden kan ook dienen om een PDT-geïnduceerde verhoging van intra-oculaire VEGF niveaus af te remmen.
Intravitreale injecties zelf worden geassocieerd met kleine, maar zekere risico’s op ernstige, mogelijk blindmakende bijwerkingen, waaronder infectieuze endophthalmitis, netvliesloslating, bloeding, oculaire hypertensie, cataract en hypotonie.28 Recent gepubliceerde richtlijnen voor intravitreale injecties trachten een beste praktijkbenadering vast te stellen voor deze techniek die steeds meer gebruikt wordt. De aanbevelingen van het consensuspanel hebben betrekking op overwegingen vóór de injectie, waaronder antibiotica, glaucoom evaluatie, gebruik van handschoenen en behandeling van reeds bestaande ooglidafwijkingen, evenals het belang van het vermijden van overmatige ooglidmanipulatie vóór en tijdens de procedure. De aanbevolen peri-injectie regime omvatte het gebruik van topische en/of subconjunctivale verdoving, topische povidon jodium, en een ooglid speculum. De auteurs benadrukten het belang van controle van IOP en directe fundusvisualisatie na de injectie om perfusie van de oogzenuw, intravitreale locatie van triamcinolone, en de afwezigheid van injectie-geassocieerde bloeding of netvliesloslating te verifiëren. Zij benadrukten ook het belang van voorlichting van de patiënt met betrekking tot vroege symptomen van mogelijke complicaties en een grondige follow-up.29
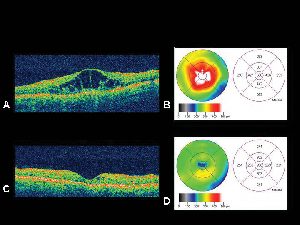
Figuur 4. A. Optische coherentie tomografie beeld van een oog met diabetisch maculair oedeem met bijbehorende netvliesdikte kaartB. gegenereerd door de OCT. C. OCT van dezelfde patiënt één maand na intravitreale triamcinolone acetonide injectie met corresponderende netvliesdiktekaart. D. Resolutie van maculair oedeem. De gezichtsscherpte verbeterde van 20/200 tot 20/80 na de behandeling.
In verschillende studies wordt onderzoek gedaan naar alternatieve middelen voor langdurige toediening van corticosteroïden voor gebruik in het oog. Bij één onderzoek wordt een fluocinolone acetonide-pellet chirurgisch aangebracht op een plastic stut, waarbij de steroïden gedurende drie jaar gecontroleerd worden afgegeven. Het Envision intravitreaal implantaat, van Bausch & Lomb en Control Delivery Systems, wordt via de pars plana geplaatst en aan de sclera gehecht. In een fase II/III-gerandomiseerd, gemaskeerd onderzoek werd het Envision TD-implantaat vergeleken bij 80 patiënten die waren gerandomiseerd naar 0,5 vs. 2,0 mg fluocinolone acetonide versus de standaardbehandeling bestaande uit laserfotocoagulatie of observatie. Na zes maanden werd een statistisch significante vermindering van ME en de ernst van diabetische retinopathie waargenomen met het 0,5 mg implantaat in vergelijking met de standaardbehandeling. Bovendien waren er geen verschillen in de incidentie van ernstige bijwerkingen. De 2,0 mg arm van de studie werd vroegtijdig gestopt als gevolg van de resultaten van een tweede studie waarin geen voordeel ten opzichte van 0,5 mg werd vastgesteld. In een tweede studie werden 278 patiënten met niet-infectieuze uveïtis posterior gerandomiseerd om ofwel een Retisert-implantaat van 0,59 mg of 2,1 mg te ontvangen in het aangetaste oog of, in bilaterale gevallen, in het zwaarder aangetaste oog. Na twee doses en 34 weken was er een significant lager recidiefpercentage in de ogen met het implantaat (10 vs. 55,7 procent, p<0,0001) met een afname in het gebruik van systemische corticosteroïden/immunosuppressieve therapie (59,0 procent bij aanvang vs. 13,7 procent na 34 weken) evenals het gebruik van sub-Tenon’s en topische steroïden. Er was een significante verbetering van de gezichtsscherpte (p<0,05). De meest voorkomende bijwerkingen waren progressie van cataract en verhoogde intraoculaire druk die een filterprocedure vereiste in 8,6 procent. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
Een ander onderzoek betreft Posurdex van Allergan, een bio-erodeerbare dexamethasonpellet die in de glasvochtruimte wordt geïnjecteerd en waarbij de medicatie in 50 tot 160 dagen vrijkomt. De resultaten van een fase II-studie toonden aan dat zowel een pellet van 350 µg als van 700 µg het percentage patiënten met een verbetering van het gezichtsvermogen met twee of meer lijnen (respectievelijk 27,2 en 35,7 procent bij 350 µg en 700 µg) en een verbetering van het gezichtsvermogen met drie of meer lijnen (respectievelijk 13 en 19,4 procent bij 350 µg en 700 µg) na 180 dagen aanzienlijk verbeterde in vergelijking met placebo. Tot dusver is er geen verhoogde incidentie van cataract gerapporteerd, hoewel IOP-verhogingen werden waargenomen bij ongeveer 15 procent van de patiënten.
Behandelingen -Laser
Het meest recent werd Eyetech’s en Pfizer’s Macugen bestudeerd in een gerandomiseerde, dubbel gemaskeerde, multicenter, dosis-afhankelijke, gecontroleerde fase II-studie met 172 patiënten met diabetische ME. De studie onderzocht drie dosissen (0,3 mg, 1,0 mg, 3,0 mg) versus schijninjecties die om de zes weken gedurende drie injecties werden toegediend. De onderzoekers werd gevraagd om alleen patiënten in te schrijven bij wie zij het comfortabel vonden om focale/grid laser ten minste 12 weken uit te stellen. Aanvullende injecties en/of focale/grid fotocoagulatie werden van week 18 tot 30 naar goeddunken van de onderzoeker toegediend. Eind evaluaties werden uitgevoerd in week 36, zes weken na de laatste geplande injectie. In het algemeen hadden de patiënten die Macugen kregen betere visusresultaten, was er meer kans op vermindering van de centrale retinale dikte, en werd het minder waarschijnlijk geacht dat ze bijkomende lasertherapie nodig hadden in vergelijking met de shampopatiënten.31 Een bevestigende Fase III studie is momenteel gepland.
Focal/grid laser photocoagulation blijft de standaardbehandeling voor de behandeling van diabetische ME. De Early Treatment Diabetic Retinopathy Study toonde aan dat patiënten behandeld met rasterlaser een vermindering van 50 procent hadden in matig visueel verlies, gedefinieerd als een verdubbeling van de gezichtshoek of een vermindering van het gezichtsvermogen met drie lijnen, vergeleken met observatie.30 Hoewel het exacte mechanisme waarmee laser ME vermindert onbekend is, wordt aangenomen dat het de vorming van tight junctions tussen RPE-cellen bevordert, het zuurstofverbruik van de fotoreceptoren vermindert en de zuurstofperfusie vanuit het vaatvlies verhoogt.31 De EDTRS identificeerde patiënten die in aanmerking kwamen voor focale laserfotocoagulatie als ze klinisch significante ME hadden. Dit werd gedefinieerd als voldoend aan één van de volgende drie criteria: 1) netvliesverdikking gelegen binnen 500 µm van de fovea; 2) harde exsudaten op minder dan 500 µm van de fovea geassocieerd met aangrenzende netvliesverdikking; of 3) een gebied van oedeem met een diameter van 1 schijf of groter, waarvan elk deel zich minder dan 1 schijfdiameter van de fovea bevond. De EDTRS maakte echter geen onderscheid tussen focale ME, wat overeenkomt met een plaatselijke verdikking van het netvlies grenzend aan microaneurysma’s, en diffuse ME, wat verwijst naar een algemene verdikking van de posterior pole. Uit anekdotisch bewijsmateriaal blijkt dat focale diabetische ME goed reageert op focale/rasterlaser, terwijl de diffuse variant vaker niet met laser kan worden behandeld en een andere behandeling vereist.
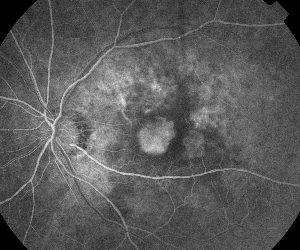 |
 |
| Figuur 5. A. Vroeg fluoresceïne-angiogram met klassieke subfoveale neovascularisatie. | B. Overeenkomstige optische coherentie tomografie toont gebieden van subretinale en intraretinale vochtophoping en toont de neovascularisatie (pijl). |
Behandelingen – Chirurgie
De eerste groep die de voordelen van vitrectomie en posterieure hyaloïdscheiding rapporteerde bij patiënten met diabetische ME, suggereerde dat er een subgroep van patiënten bestaat bij wie glasvochttractie en ondiepe maculaire loslatingen bijdragen tot de verdikking van het netvlies.32 Dit werd later bevestigd met OCT, wat leidde tot een verfijning van de indicaties voor deze techniek.33,34 De drie grootste series35,36,37 van patiënten die vitrectomie ondergingen voor diabetische ME en niet reageerden op minder invasieve behandelingen, analyseerden respectievelijk 59, 58 en 65 patiënten. Zij rapporteerden een verbetering van het gezichtsvermogen van respectievelijk 47, 53 en 45 procent van hun patiënten met twee lijnen of meer. De laatste groep rapporteerde ernstige postoperatieve complicaties bij een minderheid van de patiënten, waaronder netvliesloslating (1,5 procent), iridis rubeosis (4,6 procent), epiretinaal membraan (13,8 procent), recidiverende glasvochtbloeding (1,5 procent) en foveale harde exsudaatafzettingen (4,6 procent), terwijl de complicaties van de tweede groep epiretinaal membraan in 10,2 procent en cataract in 63,2 procent van de phakische ogen omvatten. Verscheidene andere reeksen hebben gelijkaardige resultaten aangetoond, maar zij waren allemaal niet gerandomiseerd, zonder placebocontrole, en met verschillende in- en exclusiecriteria. Bovendien verschilden ook de operatietechnieken, waardoor de precieze indicaties voor vitrectomie bij patiënten met CME voor interpretatie vatbaar zijn.
ME blijft een belangrijke oorzaak van gezichtsverlies ondanks de verscheidenheid aan beschikbare behandelingen. Laserfotocoagulatie blijft een integraal onderdeel van de behandeling van ME ten gevolge van diabetes, ischemie en vasculaire occlusies. Plaatselijke NSAID’s en corticosteroïden zijn momenteel de voornaamste methode om postoperatieve ME onder controle te houden, terwijl acetazolamide een doeltreffend middel blijft om te behandelen bij geselecteerde patiënten met ME secundair aan uveïtis en retinitis pigmentosa. De rol van intravitreale corticosteroïden in de behandeling van ME neemt toe, maar blijft beperkt door bijwerkingen en duur van het effect. Verfijningen in chirurgische technieken zullen een nieuwe dimensie blijven toevoegen aan ME die niet reageert op minder invasieve behandeling, terwijl de vooruitgang in farmacotherapie en oculaire geneesmiddelentoediening een rol belooft te spelen in de preventie en behandeling van alle oorzaken en types van ME.
Dr. Ober is een fellow in vitreoretinale chirurgie aan het Edward S. Harkness Eye Institute van het Columbia University College of Physicians and Surgeons, en het LuEsther T. Mertz Retinal Research Center van het Manhattan Eye, Ear, and Throat Hospital. U kunt hem bereiken op 210 East 64th St., 8th Fl, New York, NY 10021; e-mail: [email protected]; of (212) 605 3777 of fax (212) 605 3795.
Dr. Klais is retina fellow aan het LuEsther T. Mertz Retinal Research Center. Neem contact met haar op via hetzelfde adres, telefoon- of faxnummers, of per e-mail op [email protected].
Dr. Cunningham is klinisch hoogleraar oogheelkunde en directeur van de Uveitis Service aan de New York University, School of Medicine. Hij is tevens werknemer van Eyetech Pharmaceuticals Inc. Neem contact met hem op via Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., New York, N.Y. 10022, per e-mail [email protected], of per telefoon/fax op (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Chronic cystoid macular edema and predictors of visual acuity. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. A perspective on the treatment of aphakic cystoid macular edema. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Post-chirurgisch cystoïd maculair oedeem. In: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Meting bij patiënten met cystoïd maculair oedeem. Ophthalmology 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Patterns of macular edema in patients with uveitis: qualitative and quantitative assessment using optical coherence tomography. Ophthalmology 2004;111:946-53.
6. Antcliff RJ, Stanford MR, Chauhan DS, et al. Vergelijking tussen optische coherentie tomografie en fundus fluoresceïne-angiografie voor de detectie van cystoïd maculair oedeem bij patiënten met uveïtis. Ophthalmology 2000; 107:593-9.
7. Otani T, Kishi S, Maruyama Y. Patterns of diabetic macular edema with optical coherence tomography. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. Quantitative assessment of macular edema with optical coherence tomography. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Meting bij patiënten met cystoïd maculair oedeem. Ophthalmology 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. Optical coherence tomographic assessment of diabetic macular edema: comparison with fluorescein angiographic and clinical findings. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. Optical coherence tomography to detect macular edema in the presence of asteroid hyalosis. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Comparison between retinal thickness analyzer and optical coherence tomography for assessment of foveal thickness in eyes with macular disease. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Comparison of foveal thickness measured with the retinal thickness analyzer and optical coherence tomography. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Retinale dikte in ogen met milde niet-proliferatieve retinopathie bij patiënten met type 2 diabetes mellitus: vergelijking van metingen verkregen door retinale dikte-analyse en optische coherentie tomografie. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Cyclo-oxygenase inhibitors in oftalmology. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac versus prednisolon versus combinatietherapie bij de behandeling van acuut pseudofakisch cystoïd maculair oedeem. Ophthalmology 2000;107:2034-8.
17. Cox SN, Hay E, Bird AC. Behandeling van chronisch maculair oedeem met acetazolamide. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Acetazolamide voor de behandeling van chronisch maculair oedeem bij retinitis pigmentosa. Arch Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. Reduction of macular oedema by acetazolamide in patients with chronic iridocyclitis: a randomised prospective crossover study. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. Is acetazolamide werkzaam bij de behandeling van diabetisch macula-oedeem? Een pilootstudie. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Posterior sub-Tenon’s injections of corticosteroids in uveitis patients with cystoid macular edema. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. The effects of posterior subtenon injection of triamcinolone acetonide in patients with intermediate uveitis. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Intravitreal triamcinolone for refractory pseudophakic macular edema. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Intravitreal triamcinolone acetonide as treatment of macular edema in central retinal vein occlusion. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Intravitreal triamcinolone for refractory diabetic macular edema. Ophthalmology 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW Jr., Rosenfeld PJ. Intravitreal triamcinolone acetonide for idiopathic cystoid macular edema. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sequenced Combined Intravitreal Triamcinolone and Indocyanine Green Angiography Guided Photodynamic Therapy for Retinal Angiomatous Proliferation. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Risks of intravitreal injection: a comprehensive review. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Evolving guidelines for intravitreal injections. Retina 2004 Oct;24(5 Suppl):S3-19.
30. G.Jaffe, Fluocinolone Acetonide Uveitis Study Group. Fluocinolone Acetonide Intravitreal Implant for Uveitis Affecting the Posterior Segment of the Eye. ARVO 2004, poster #3369.
31. De Macugen Diabetic Retinopathy Study Group. A phase II randomized, double-masked trial of pegaptanib, an anti-vascular endothelial growth factor aptamer, for diabetic macular edema. Ophthalmology, In press.
32. 30. Fotocoagulatie voor diabetisch maculair oedeem. Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Surgical and other treatments of diabetic macular edema: an update. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrectomie voor diabetische maculaire tractie en oedeem geassocieerd met posterieure hyaloïdale tractie. Ophthalmology 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Macular traction detachment and diabetic macular edema associated with posterior hyaloidal traction. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. The role of vitrectomy in the treatment of diabetic macular edema. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrectomy for diabetic macular edema associated with a taut premacular posterior hyaloid. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrectomy for diffuse macular edema in cases of diabetic retinopathy. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Vroege postoperatieve netvliesdikteveranderingen en complicaties na vitrectomie voor diabetisch maculair oedeem. Am J Ophthalmol 2003;135:14-9.