Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr…, MD, PhD, MPH
New York City
L’œdème maculaire représente l’accumulation pathologique de liquide extracellulaire dans la rétine, principalement dans les couches plexiformes externes et nucléaires internes, en tant que réponse non spécifique à une rupture des barrières sang-rétine. L’EM est une cause fréquente de perte de vision chez les patients atteints de diabète sucré, d’occlusion veineuse rétinienne, d’uvéite et après une chirurgie intraoculaire. Elle est moins fréquente dans le cadre d’une traction vitréo-rétinienne, d’une néovascularisation choroïdienne et d’un certain nombre d’autres conditions. De nombreuses stratégies ont été employées pour gérer l’EM avec un succès variable. Cet article passe en revue les options de traitement disponibles pour cette affection courante.
 |
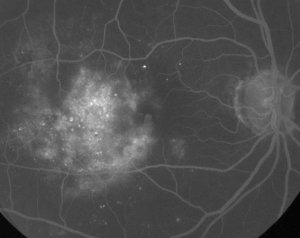 |
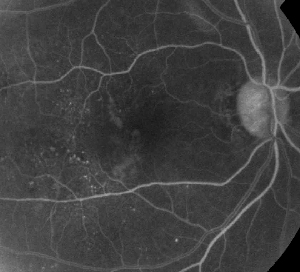
| Figure 1. A. Angiographie à la fluorescéine en phase précoce d’un patient atteint de rétinopathie diabétique non proliférante. Les microanévrismes sont vus de manière plus proéminente en temporal de la fovéa en plus de la fuite de fluorescéine dans la zone avasculaire fovéale. | B. FA en phase tardive du même patient montrant une fuite diffuse temporale et à l’intérieur de la zone avasculaire fovéale correspondant à un œdème maculaire diabétique. |
Diagnostic
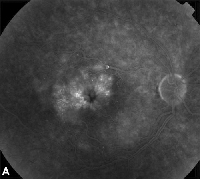
Le diagnostic clinique de l’EM est mieux fait en utilisant une lentille de contact et une biomicroscopie du fond d’œil à lampe à fente stéréoscopique. La ME se manifeste typiquement par une élévation irrégulière au sein de la rétine, souvent adjacente à des lipides intrarétiniens, des microanévrismes et/ou des hémorragies dans les cas secondaires au diabète sucré, à une occlusion vasculaire ou à une ischémie. Le liquide intrarétinien peut également s’accumuler dans des espaces kystiques localisés dans la rétine parafovéale avec ou sans anomalies vasculaires adjacentes. Cet œdème maculaire cystoïde (OMC) résulte le plus souvent d’une inflammation, d’une traction localisée ou à la suite d’une intervention chirurgicale.
L’angiographie à la fluorescéine est un outil essentiel dans le diagnostic de l’EM. Dans l’œil normal, la fluorescéine est empêchée de passer dans la rétine par les barrières hémato-rétiniennes. Dans l’EM, cependant, les molécules de fluorescéine quittent l’espace intravasculaire pour pénétrer dans la rétine. Les sites affectés présentent une hyperfluorescence dans les premières et moyennes images qui augmente en surface et en intensité dans les images suivantes (voir figure 1). L’AF permet non seulement de mettre en évidence l’œdème pour faciliter la visualisation et la localisation du traitement, mais aussi de créer un enregistrement permanent pour les comparaisons futures. Une échelle quantitative à quatre niveaux a été développée pour l’EM, le niveau 0 correspondant à une absence d’hyperfluorescence périfovéale, le niveau 1 à une hyperfluorescence périfovéale incomplète, le niveau 2 à une légère hyperfluorescence à 360 degrés, le niveau 3 à une hyperfluorescence modérée à 360 degrés avec une zone hyperfluorescente d’environ 1 diamètre de disque et le niveau 4 à une hyperfluorescence sévère à 360 degrés avec une zone hyperfluorescente d’environ 1,5 diamètre de disque.1,2 Bien que l’AF soit un moyen sensible d’identifier la présence d’EM, elle fournit relativement peu d’informations sur la distribution anatomique du liquide, c’est-à-dire diffuse, kystique ou sous-rétinienne, et sur la gravité de la fuite dans le temps. L’AF ne fournit aucune information quantitative concernant l’épaississement de la rétine. Il n’est donc pas surprenant que, dans l’ensemble, ce système de classement bidimensionnel basé sur l’AF présente une faible corrélation avec la vision.3,4
La tomographie par cohérence optique (OCT III, Carl Zeiss) est une technique d’imagerie sans contact et non invasive qui constitue un complément utile au diagnostic de l’EM. Elle dirige un faisceau de lumière proche infrarouge (830-nm) perpendiculairement à la surface de la rétine et analyse les propriétés des réflexions. En 1,5 seconde, il produit une seule image linéaire en coupe transversale à haute résolution. Ces images peuvent afficher et même mesurer la rétine épaissie et kystique que l’on trouve dans les zones œdémateuses. Elle est également utile pour visualiser les propriétés de l’interface vitréo-rétinienne et démontre efficacement quand la traction vitréenne joue un rôle dans la formation de l’EM (voir la figure 2).
Une étude a utilisé l’OCT pour examiner 84 yeux atteints d’EM secondaire à une uvéite, ce qui a offert l’avantage supplémentaire de révéler ou de confirmer la présence de membranes épirétiniennes et de décollement séreux de la rétine dans 41 et 20 % de leurs cas, respectivement5. L’étude a trouvé une corrélation modérée entre l’épaisseur de la rétine et la baisse de l’acuité visuelle, bien que le degré de corrélation ait varié selon les études, d’autres chercheurs ayant rapporté des corrélations faibles,6 modérées,7 et fortes8,9,10 en utilisant diverses méthodes statistiques dans diverses populations de patients, y compris des patients atteints de rétinopathie diabétique, d’uvéite et d’OMEC.
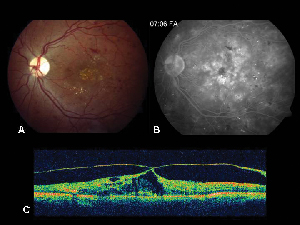
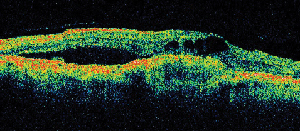
Figure 2. A. Photographie du fond d’œil en couleur de l’œil gauche d’un patient présentant une rétinopathie diabétique non proliférante et une exsudation lipidique dans et autour de la fovéa. B. La FA en phase tardive révèle un œdème maculaire dans la macula centrale. C. La tomographie par cohérence optique démontre l’interface vitréo-rétinienne anormale ainsi que l’œdème maculaire.
Un autre groupe a rapporté que l’OCT était aussi efficace que l’AF pour détecter l’EM et supérieure à l’AF pour décrire la distribution axiale du fluide.6 L’OCT a également la capacité d’identifier certains patients atteints d’EM non visualisés par l’AF, comme dans certains cas d’EMC chronique où le type de fuite active mieux visualisé par l’AF est minime, voire absent, ou lorsque l’examen du fond d’œil est compromis par la présence d’opacités médianes, comme chez les patients atteints de hyalose astéroïde.11
L’analyseur d’épaisseur de la rétine (RTA, Talia Technology, Israël) est une technique d’imagerie sans contact similaire qui permet de quantifier l’épaisseur de la rétine. Il produit 16 scans parallèles en coupe transversale sur une zone de rétine de 3×3 mm carrés en analysant les réflexions d’une impulsion de lumière verte (540 nm) dirigée obliquement et délivrée pendant 0,3 seconde. L’OCT et le RTA ont tous deux montré une excellente précision dans leurs mesures individuelles de l’épaisseur de la rétine, et une comparaison directe des technologies a démontré une corrélation statistiquement significative entre leurs mesures. Bien que la RTA présente l’avantage d’une acquisition rapide avec peut-être moins d’artefacts, elle semble être moins efficace pour mesurer l’épaisseur de la rétine que l’OCT en présence d’opacités médianes.12
Une autre étude a comparé l’épaisseur de la fovéa avec la RTA et l’OCT dans 30 yeux sains. L’épaisseur fovéale moyenne dans les yeux normaux a été mesurée à 181 µm et 153 µm pour la RTA et l’OCT, respectivement. Les auteurs ont conclu que l’ACR produit occasionnellement des valeurs faussement élevées et que sa fiabilité est donc réduite par rapport à l’OCT.13 En revanche, une analyse de patients atteints de rétinopathie diabétique non proliférante légère a révélé que l’ACR était plus sensible que l’OCT pour identifier les zones d’épaississement de la rétine au cours des premiers stades de la ME diabétique.14
 |
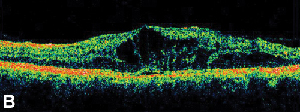 |
| Figure 3. A. Angiographie à la fluorescéine en phase tardive d’un patient présentant un œdème maculaire cystoïde. | B. Tomographie par cohérence optique montrant les grands espaces kystiques au niveau de la fovéa. |
Traitements -Médicaux
Les anti-inflammatoires non stéroïdiens topiques sont le traitement le plus courant de l’EM après une chirurgie de la cataracte (voir figure 3). Ces agents visent à diminuer les niveaux de prostaglandine intraoculaire, qui ont été impliqués dans la pathogenèse de l’EM. Des études à double insu, randomisées, actives et contrôlées par placebo, incluant des patients subissant une chirurgie de la cataracte, ont rapporté des effets anti-inflammatoires des préparations ophtalmiques d’indométhacine à 1 %, de flurbiprofène à 0,03 %, de kétorolac à 0,5 % et de diclofénac à 0,1 % appliquées par voie topique.15,16 Les solutions ophtalmiques de diclofénac à 0,1 % et de kétorolac à 0,5 % sont toutefois les seuls AINS appliqués par voie topique spécifiquement approuvés par la Food and Drug Administration pour cette indication. Une thérapie combinant un corticostéroïde topique et des gouttes d’AINS s’est avérée plus efficace pour traiter l’EM que l’un ou l’autre médicament seul.16 Bien que non approuvés par la FDA, les AINS topiques sont souvent utilisés avant une chirurgie de la cataracte pour prévenir l’EM postopératoire.
L’acétazolamide oral est parfois utilisé dans le traitement de l’EM secondaire à des conditions inflammatoires et à la rétinite pigmentaire, en particulier lorsque les AINS topiques et les corticostéroïdes échouent. Plusieurs études prospectives, masquées et croisées ont comparé l’acétazolamide et un placebo chez des patients atteints d’EM due à diverses causes. Une étude croisée de cinq cycles chez 41 patients a trouvé une réponse reproductible, caractérisée par une résolution partielle ou complète de l’EM, chez plus de la moitié des patients atteints d’une maladie rétinienne héréditaire ou inflammatoire, mais aucune réponse chez ceux atteints de maladies vasculaires rétiniennes primaires.17 Une dose de 500 mg/jour d’acétazolamide par voie orale s’est avérée plus efficace que la dose de 250 mg/jour pour traiter l’EM chez les patients atteints d’EM secondaire à une RP.18 Cette étude a observé une amélioration chez 10 des 12 patients traités.
Un autre groupe a conclu que les patients de moins de 55 ans atteints d’EM attribuée à une iridocyclite chronique étaient plus susceptibles de répondre à 500 mg d’acétazolamide b.i.d. que les patients plus âgés.19 Une étude récente a suggéré que l’acétazolamide pourrait également être efficace pour le traitement de l’EM induite par le diabète.20
Les corticostéroïdes sont des agents anti-inflammatoires puissants qui sont fréquemment utilisés dans le traitement de l’EM. Ils ont de multiples mécanismes d’action, notamment la stabilisation de la barrière hémato-rétinienne et l’inhibition des médiateurs pro-inflammatoires. Les modes d’administration comprennent l’administration topique, l’injection périoculaire, l’injection intravitréenne et l’administration orale et intraveineuse. Bien que les corticostéroïdes administrés par voie orale ou intraveineuse atteignent certainement des niveaux thérapeutiques dans le vitré, ils exposent les patients à un risque supplémentaire de complications systémiques et sont donc généralement réservés aux patients atteints d’uvéite menaçant la vue dans le cadre d’une maladie systémique. Les gouttes de corticostéroïdes topiques se situent à l’autre extrémité du spectre de sécurité, mais leur capacité à atteindre le segment postérieur est limitée.
Les injections sous-Tenon offrent une alternative pour délivrer des doses relativement élevées de corticostéroïdes dans l’œil avec des risques plus faibles de complications systémiques.21 Bien qu’il n’y ait pas eu d’essais randomisés et contrôlés, l’injection de corticostéroïdes sous-Tenon est utilisée efficacement dans le traitement de l’œdème maculaire depuis de nombreuses années. La technique la plus courante utilise une courte aiguille de calibre 25 placée à travers la conjonctive bulbaire sus-temporale dans l’espace sous-Tenon pendant que le patient regarde vers l’inféronasal. L’aiguille est avancée vers l’arrière le long du globe en effectuant un mouvement de balayage latéral pour éviter toute pénétration du globe par inadvertance, jusqu’à ce que l’embout atteigne le site d’entrée conjonctival, où le médicament est administré. Un rapport a inclus 20 patients consécutifs atteints d’uvéite intermédiaire associée à une perte de vision qui ont été traités par une injection sous-ténonienne de 40 mg d’acétonide de triamcinolone.22 Bien que tous les patients n’aient pas présenté une ME à l’AF, 67 % d’entre eux ont vu leur vision s’améliorer de deux lignes après un seul traitement. Les risques de cette procédure comprennent, entre autres, une pression intraoculaire élevée persistante, la cataracte, la ptose et la pénétration intraoculaire.
Récemment, l’utilisation de l’injection intravitréenne d’acétonide de triamcinolone (Kenalog, 4,0 mg) a augmenté en raison de sa puissante capacité à améliorer l’EM réfractaire secondaire au diabète sucré (voir figure 4), aux occlusions veineuses rétiniennes, à l’inflammation et à d’autres causes idiopathiques.23-26 Les études préliminaires montrent une réduction spectaculaire de l’épaississement de la rétine, une diminution des fuites de fluorescéine et une amélioration visuelle, qui peut être marquée chez certains patients. Bien que l’effet soit temporaire et dure généralement de trois à six mois ou moins, le ME répond généralement à une nouvelle injection. L’utilisation de corticostéroïdes intravitréens est toutefois associée à un risque de 30 à 40 % de pression intraoculaire élevée persistante et à un risque d’environ 10 % de cataracte nécessitant une intervention chirurgicale. Le National Eye Institute recrute actuellement des patients pour l’étude SCORE (Standard Care vs. Corticosteroid for Retinal Vein Occlusion), qui compare des injections intravitréennes de triamcinolone (doses de 1 et 4 mg) à des soins standard (observation et/ou traitement par laser à grille) chez des patients atteints d’EM secondaire à une occlusion veineuse. L’étude suivra un total de 1 260 patients et poursuivra le traitement pendant 36 mois.
L’EM survient également dans le cadre de la dégénérescence maculaire liée à l’âge (voir figure 5). L’injection intravitréenne d’acétonide de triamcinolone est actuellement à l’étude pour une utilisation combinée avec la thérapie photodynamique pour le traitement de la DMLA néovasculaire (Visudyne avec acétonide de triamcinolone intravitréen, VisTA). Une étude souligne l’importance de l’administration intravitréenne de triamcinolone avant l’application de la TPD chez les patients présentant un œdème maculaire et un NVC.27 Les auteurs avancent la théorie selon laquelle la vertéporfine peut fuir dans les espaces intra-rétiniens kystiques, entraînant des dommages aux photorécepteurs de la rétine normale adjacente, une fois le médicament photoactivé, alors que la résolution préalable de l’œdème rétinien peut prévenir cette complication. L’administration préalable de corticostéroïdes peut également servir à atténuer toute élévation des niveaux de VEGF intraoculaire induite par la TPD.
Les injections intravitréennes elles-mêmes sont associées à des risques faibles, mais certains, d’effets secondaires graves, potentiellement aveuglants, notamment l’endophtalmie infectieuse, le décollement de la rétine, l’hémorragie, l’hypertension oculaire, la cataracte et l’hypotonie.28 Les lignes directrices récemment publiées pour les injections intravitréennes tentent d’établir une approche des meilleures pratiques pour cette technique de plus en plus utilisée. Les recommandations du groupe de consensus portent sur les considérations préalables à l’injection, notamment les antibiotiques, l’évaluation du glaucome, l’utilisation de gants et le traitement des anomalies préexistantes des paupières, ainsi que sur l’importance d’éviter toute manipulation excessive des paupières avant et pendant la procédure. Le régime recommandé pour la péri-injection comprenait l’utilisation d’un anesthésique topique et/ou sous-conjonctival, de povidone iodée topique et d’un spéculum pour les paupières. Les auteurs ont souligné l’importance de la surveillance de la PIO et de la visualisation directe du fond d’œil après l’injection pour vérifier la perfusion du nerf optique, la localisation intravitréenne de la triamcinolone et l’absence d’hémorragie ou de décollement de la rétine associés à l’injection. Ils ont également souligné l’importance de l’éducation des patients vis-à-vis des symptômes précoces de complications potentielles et d’un suivi complet.29
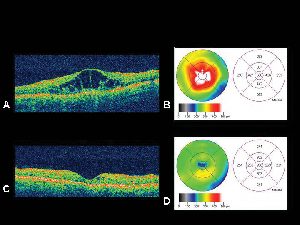
Figure 4. A. Image de tomographie par cohérence optique d’un œil présentant un œdème maculaire diabétique avec la carte d’épaisseur rétinienne correspondanteB. générée par l’OCT. C. OCT du même patient un mois après l’injection intravitréenne d’acétonide de triamcinolone avec la carte d’épaisseur rétinienne correspondante. D. Résolution de l’œdème maculaire. L’acuité visuelle s’est améliorée de 20/200 à 20/80 après le traitement.
Plusieurs essais étudient des dispositifs alternatifs d’administration de corticostéroïdes à long terme à l’intérieur de l’œil. Une étude porte sur la mise en place chirurgicale d’une pastille d’acétonide de fluocinolone enchâssée dans une entretoise en plastique avec libération contrôlée de stéroïdes sur trois ans. Connu sous le nom d’implant intravitréen Envision, par Bausch & Lomb et Control Delivery Systems, il est placé à travers la pars plana et suturé à la sclère. Une étude de phase II/III randomisée et masquée a comparé l’implant Envision TD chez 80 patients randomisés entre 0,5 mg et 2,0 mg d’acétonide de fluocinolone et le traitement standard consistant en une photocoagulation au laser ou une observation. Après six mois, une réduction statistiquement significative de la ME et de la gravité de la rétinopathie diabétique a été observée avec l’implant de 0,5 mg par rapport au traitement standard. En outre, il n’y avait pas de différences dans l’incidence des effets indésirables graves. Le volet de l’étude portant sur l’implant de 2,0 mg a été interrompu prématurément en raison des résultats observés dans une deuxième étude, dans laquelle aucun avantage par rapport à l’implant de 0,5 mg n’a été noté. Une deuxième étude a porté sur 278 patients atteints d’uvéite postérieure non infectieuse, randomisés pour recevoir un implant Retisert de 0,59 mg ou de 2,1 mg dans l’œil atteint ou, dans les cas bilatéraux, dans l’œil le plus gravement atteint. Après deux doses et 34 semaines, on a constaté un taux de récidive significativement plus faible dans les yeux ayant reçu l’implant (10 contre 55,7 %, p<0,0001) avec une diminution de l’utilisation de la corticothérapie systémique/du traitement immunosuppresseur (59,0 % au départ contre 13,7 % à 34 semaines) ainsi que de l’utilisation de stéroïdes sous-ténoniens et topiques. Une amélioration significative de l’acuité visuelle a été constatée (p<0,05). Les effets indésirables les plus fréquents étaient la progression de la cataracte et l’augmentation de la pression intraoculaire qui a nécessité une procédure de filtrage dans 8,6 % des cas. (Jaffe G. Invest Ophthalmol Vis Sci. 2004 ; 44 ARVO E-Abstract #3369.)
Un autre essai concerne le Posurdex d’Allergan, une pastille de dexaméthasone bioérodable injectée dans l’espace vitré qui libère le médicament sur 50 à 160 jours. Les résultats d’un essai de phase II ont révélé qu’une pastille de 350 µg et de 700 µg améliorait significativement le pourcentage de patients présentant une amélioration de la vision de deux lignes ou plus (27,2 % et 35,7 % pour 350 µg et 700 µg, respectivement) ainsi qu’une amélioration de la vision de trois lignes ou plus (13 % et 19,4 % pour 350 µg et 700 µg, respectivement) à 180 jours par rapport au placebo. Jusqu’à présent, aucune augmentation de l’incidence de la cataracte n’a été signalée, bien que des augmentations de la PIO aient été observées chez environ 15 pour cent des patients.
Traitements -Laser
Plus récemment, le Macugen d’Eyetech et de Pfizer a été étudié dans le cadre d’un essai de phase II randomisé, à double insu, multicentrique, à doses variables et contrôlé, mené auprès de 172 patients atteints d’EM diabétique. L’étude a porté sur trois doses (0,3 mg, 1,0 mg, 3,0 mg) par rapport à des injections fictives effectuées toutes les six semaines pendant trois injections. Alors qu’avant le laser focal/grille, il a été demandé aux investigateurs de n’inscrire que les patients chez qui ils se sentaient à l’aise pour différer le laser focal/grille pendant au moins 12 semaines. Des injections supplémentaires et/ou une photocoagulation focale/grid ont été effectuées à la discrétion de l’investigateur de la semaine 18 à la semaine 30. Les évaluations finales ont été effectuées à la semaine 36, six semaines après la dernière injection prévue. Dans l’ensemble, les sujets assignés à recevoir Macugen avaient de meilleurs résultats en matière de vision, étaient plus susceptibles de présenter une réduction de l’épaisseur de la rétine centrale et étaient jugés moins susceptibles d’avoir besoin d’une thérapie laser supplémentaire par rapport aux patients fictifs.31 Une étude de confirmation de phase III est actuellement prévue.
La photocoagulation laser focale/grille reste la norme de soins pour le traitement de la ME diabétique. L’étude sur le traitement précoce de la rétinopathie diabétique a montré que les patients traités par laser à grille présentaient une réduction de 50 % de la perte visuelle modérée, définie comme un doublement de l’angle visuel ou une diminution de la vision de trois lignes, par rapport à l’observation.30 Bien que le mécanisme exact par lequel le laser diminue l’EM soit inconnu, on pense qu’il favorise la formation de jonctions serrées entre les cellules de l’EPR ainsi que la réduction de la demande en oxygène des photorécepteurs et l’augmentation de la perfusion d’oxygène de la choroïde.31 L’EDTRS a identifié les patients éligibles pour la photocoagulation au laser focal comme ayant une EM cliniquement significative. Cette dernière a été définie comme répondant à l’un des trois critères suivants : 1) un épaississement de la rétine situé à moins de 500 µm de la fovéa ; 2) des exsudats durs à moins de 500 µm de la fovéa associés à un épaississement de la rétine adjacente ; ou 3) une zone d’œdème d’un diamètre de disque ou plus, dont toute partie est située à moins d’un diamètre de disque de la fovéa. L’EDTRS ne faisait toutefois pas de distinction entre l’EM focal, qui correspond à un épaississement local de la rétine adjacent aux microanévrismes, et l’EM diffus, qui désigne un épaississement généralisé du pôle postérieur. Des données anecdotiques montrent que l’EM diabétique focale répond bien au laser focal/grille alors que la variété diffuse échoue plus fréquemment au traitement laser et nécessite une autre prise en charge.
 |
 |
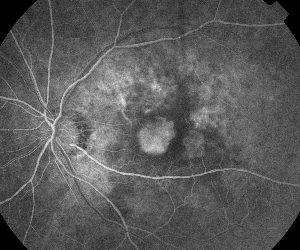
| Figure 5. A. Angiographie précoce à la fluorescéine montrant une néovascularisation sous-fovéale classique. | B. La tomographie par cohérence optique correspondante révèle des zones d’accumulation de liquide sous-rétinien et intrarétinien ainsi que la démonstration de la néovascularisation (flèche). |
Traitements -Chirurgie
Le premier groupe qui a rapporté les avantages de la vitrectomie et de la séparation hyaloïde postérieure chez les patients atteints d’EM diabétique a suggéré qu’il existe un sous-groupe de patients chez qui la traction vitréenne et les décollements maculaires peu profonds contribuent à l’épaississement de la rétine32. Cela a ensuite été confirmé par l’OCT, ce qui a permis d’affiner les indications de cette technique.33,34 Les trois plus grandes séries35,36,37 de patients subissant une vitrectomie pour une EM diabétique ne répondant pas à des traitements moins invasifs ont analysé 59, 58 et 65 patients, respectivement. Elles ont rapporté que 47 %, 53 % et 45 %, respectivement, de leurs patients ont vu leur vision s’améliorer de deux lignes ou plus. Le dernier groupe a signalé de graves complications postopératoires chez une minorité de patients, notamment un décollement de la rétine (1,5 %), une rubéose iridienne (4,6 %), une membrane épirétinienne (13,8 %), une hémorragie récurrente du vitré (1,5 %) et des dépôts d’exsudat dur fovéal (4,6 %), tandis que les complications révélées par le second groupe comprenaient des membranes épirétiniennes dans 10,2 % des cas et des cataractes dans 63,2 % des yeux phakiques. Plusieurs autres séries de cas ont montré des résultats similaires, mais toutes étaient non randomisées, sans contrôle par placebo, et utilisaient des critères d’inclusion et d’exclusion différents. En outre, les techniques chirurgicales ont également différé, laissant les indications exactes de la vitrectomie chez les patients atteints d’EMC ouvertes à l’interprétation.
L’EMC reste une cause majeure de perte visuelle malgré la variété des traitements disponibles. La photocoagulation au laser reste une partie intégrante de la gestion de l’EM due au diabète, à l’ischémie et aux occlusions vasculaires. Les AINS et les corticostéroïdes topiques sont actuellement la principale méthode de contrôle de l’EM postopératoire, tandis que l’acétazolamide reste un moyen efficace de traiter certains patients atteints d’EM secondaire à une uvéite ou à une rétinite pigmentaire. Le rôle des corticostéroïdes intravitréens dans le traitement de l’EM se développe, mais reste limité par les effets secondaires et la durée de l’effet. Les perfectionnements des techniques chirurgicales continueront à ajouter une nouvelle dimension à l’EM ne répondant pas à un traitement moins invasif, tandis que les progrès de la pharmacothérapie et de l’administration de médicaments oculaires promettent de jouer un rôle dans la prévention et la gestion de toutes les causes et de tous les types d’EM.
Le Dr Ober est fellow en chirurgie vitréo-rétinienne au Edward S. Harkness Eye Institute du Columbia University College of Physicians and Surgeons, et au LuEsther T. Mertz Retinal Research Center du Manhattan Eye, Ear, and Throat Hospital. Contactez-le au 210 East 64th St., 8th Fl, New York, NY 10021 ; e-mail : [email protected] ; ou (212) 605 3777 ou fax (212) 605 3795.
Le Dr. Klais est boursier en rétine au LuEsther T. Mertz Retinal Research Center. Vous pouvez la contacter à la même adresse, aux mêmes numéros de téléphone ou de télécopieur, ou par courriel à [email protected].
Le Dr Cunningham est professeur clinicien d’ophtalmologie et directeur du service d’uvéite à l’école de médecine de l’Université de New York. Il est également un employé de Eyetech Pharmaceuticals Inc.Contactez-le à Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., New York, N.Y. 10022, par e-mail [email protected], ou par téléphone/télécopie au (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Œdème maculaire cystoïde chronique et prédicteurs de l’acuité visuelle. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. Une perspective sur le traitement de l’œdème maculaire cystoïde aphaque. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Œdème maculaire cystoïde post-chirurgical. In : Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Épaississement maculaire et acuité visuelle. Mesure chez les patients présentant un œdème maculaire cystoïde. Ophtalmology 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Patterns of macular edema in patients with uveitis : qualitative and quantitative assessment using optical coherence tomography. Ophtalmologie 2004;111:946-53.
7. Otani T, Kishi S, Maruyama Y. Patterns of diabetic macular edema with optical coherence tomography. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. Évaluation quantitative de l’œdème maculaire avec la tomographie par cohérence optique. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Mesure chez les patients présentant un œdème maculaire cystoïde. Ophtalmology 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. Évaluation par tomographie à cohérence optique de l’œdème maculaire diabétique : comparaison avec les résultats angiographiques à la fluorescéine et les résultats cliniques. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. La tomographie par cohérence optique pour détecter l’œdème maculaire en présence d’une hyalose astéroïde. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Comparaison entre l’analyseur d’épaisseur rétinienne et la tomographie par cohérence optique pour l’évaluation de l’épaisseur fovéale dans les yeux atteints de maladie maculaire. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Comparaison de l’épaisseur fovéale mesurée avec l’analyseur d’épaisseur rétinienne et la tomographie par cohérence optique. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Épaisseur de la rétine dans les yeux présentant une rétinopathie non proliférante légère chez les patients atteints de diabète sucré de type 2 : comparaison des mesures obtenues par analyse de l’épaisseur de la rétine et par tomographie par cohérence optique. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Les inhibiteurs de la cyclo-oxygénase en ophtalmologie. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac versus prednisolone versus thérapie combinée dans le traitement de l’œdème maculaire cystoïde pseudophaque aigu. Ophthalmology 2000;107:2034-8.
17. Cox SN, Hay E, Bird AC. Traitement de l’œdème maculaire chronique avec l’acétazolamide. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. L’acétazolamide pour le traitement de l’œdème maculaire chronique dans la rétinite pigmentaire. Arch Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. Reduction of macular oedema by acetazolamide in patients with chronic iridocyclitis : a randomised prospective crossover study. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. L’acétazolamide est-il efficace dans le traitement de l’œdème maculaire diabétique ? A pilot study. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Injections sous-ténoniennes postérieures de corticostéroïdes chez les patients atteints d’uvéite avec œdème maculaire cystoïde. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. Les effets de l’injection subtenonale postérieure d’acétonide de triamcinolone chez les patients atteints d’uvéite intermédiaire. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Triamcinolone intravitréenne pour l’œdème maculaire pseudophaque réfractaire. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. L’acétonide de triamcinolone intravitréen comme traitement de l’œdème maculaire dans l’occlusion de la veine centrale de la rétine. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Intravitreal triamcinolone for refractory diabetic macular edema. Ophthalmology 2002 ; 109 : 920-7.
26. 26. Scott IU, Flynn HW Jr. et Rosenfeld PJ. L’acétonide de triamcinolone intravitréen pour l’œdème maculaire cystoïde idiopathique. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sequenced Combined Intravitreal Triamcinolone and Indocyanine Green Angiography Guided Photodynamic Therapy for Retinal Angiomatous Proliferation. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Risques de l’injection intravitréenne : un examen complet. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Evolving guidelines for intravitreal injections. Retina 2004 Oct;24(5 Suppl):S3-19.
30. .G.Jaffe, Groupe d’étude sur l’uvéite à l’acétonide de fluocinolone. Implant intravitréen d’acétonide de fluocinolone pour l’uvéite affectant le segment postérieur de l’œil. ARVO 2004, poster #3369.
31. Le groupe d’étude Macugen sur la rétinopathie diabétique. Un essai de phase II randomisé, à double insu, du pegaptanib, un aptamère anti-facteur de croissance endothélial vasculaire, pour l’œdème maculaire diabétique. Ophtalmology, In press.
32. 30. Photocoagulation pour l’œdème maculaire diabétique. Rapport numéro 1 de l’étude sur le traitement précoce de la rétinopathie diabétique. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Traitements chirurgicaux et autres de l’œdème maculaire diabétique : une mise à jour. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrectomie pour traction maculaire diabétique et œdème associé à une traction hyaloïdale postérieure. Ophthalmology 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Macular traction detachment and diabetic macular edema associated with posterior hyaloidal traction. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. Le rôle de la vitrectomie dans le traitement de l’œdème maculaire diabétique. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrectomie pour un œdème maculaire diabétique associé à une hyaloïde postérieure prémaculaire tendue. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrectomie pour un œdème maculaire diffus en cas de rétinopathie diabétique. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Early postoperative retinal thickness changes and complications after vitrectomy for diabetic macular edema. Am J Ophthalmol 2003;135:14-9.