Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr., MD, PhD, MPH
New York City
Makulært ødem repræsenterer den patologiske ophobning af ekstracellulær væske i nethinden, primært i de ydre plexiforme og indre kernelag, som et uspecifikt svar på et sammenbrud i de blod-retinale barrierer. ME er en hyppig årsag til synstab hos patienter med diabetes mellitus, retinal venøs okklusion, uveitis og efter intraokulær kirurgi. Det forekommer mindre hyppigt i forbindelse med vitreoretinal traktion, choroidal neovaskularisering og en række andre tilstande. Der har været anvendt mange strategier til at håndtere ME med varierende succes. I denne artikel gennemgås de tilgængelige behandlingsmuligheder for denne almindelige tilstand.
 |
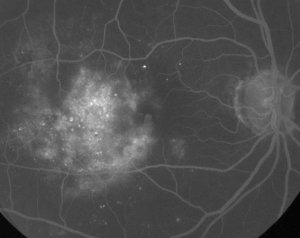 |
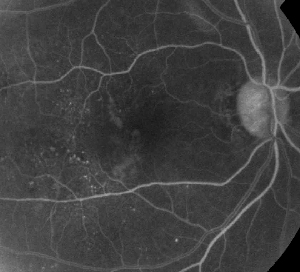
| Figur 1. A. Fluorescein-angiografi i tidlig fase af en patient med ikke-proliferativ diabetisk retinopati. Mikroaneurismer ses mest fremtrædende temporalt ved fovea ud over fluoresceinlækage i den foveale avaskulære zone. | B. Sen fase FA af samme patient, der viser diffus lækage temporalt til og inden for den foveale avaskulære zone svarende til diabetisk makulaødem. |
Diagnose
Den kliniske diagnose af ME stilles bedst ved hjælp af en kontaktlinse og stereoskopisk spalte-lampe fundusbiomikroskopi. ME manifesterer sig typisk som en uregelmæssig forhøjning i nethinden, ofte ved siden af intraretinal lipid, mikroaneurismer og/eller blødninger i tilfælde, der er sekundære til diabetes mellitus, vaskulær okklusion eller iskæmi. Intraretinal væske kan også ophobes i cystiske rum lokaliseret til den parafoveale retina med eller uden tilstødende vaskulære abnormiteter. Dette cystoide makulaødem (CME) skyldes oftest inflammation, lokaliseret trækkraft eller efter en operation.
Fluoresceinangiografi er et vigtigt redskab i forbindelse med diagnosticering af ME. I det normale øje forhindres fluorescein i at passere ind i nethinden af de blod-retinale barrierer. Ved ME forlader fluoresceinmolekyler imidlertid det intravaskulære rum for at komme ind i nethinden. De berørte områder viser hyperfluorescens i de tidlige til midterste billeder, som øges i areal og intensitet i de senere billeder (se figur 1). FA fremhæver ikke kun ødemet for at gøre det let at visualisere og lokalisere behandlingen, men skaber også en permanent registrering til fremtidig sammenligning. Der blev udviklet en kvantitativ skala med fire grader for ME, hvor grad 0 er ingen perifoveal hyperfluorescens, grad 1 er ufuldstændig perifoveal hyperfluorescens, grad 2 er mild 360-graders hyperfluorescens, grad 3 er moderat 360-graders hyperfluorescens med et hyperfluorescerende område på ca. 1 diskdiameter på tværs, og grad 4 er alvorlig 360-graders hyperfluorescens med et hyperfluorescerende område på ca. 1,5 diskdiameter på tværs.1,2 Mens FA er et følsomt middel til at identificere tilstedeværelsen af ME, giver det relativt få oplysninger om væskens anatomiske fordeling, dvs. diffus vs. cystisk vs. subretinal, og om lækagens sværhedsgrad over tid. FA giver ingen kvantitative oplysninger om fortykkelse af nethinden. Det er derfor ikke overraskende, at dette todimensionelle FA-baserede klassificeringssystem generelt set korrelerer dårligt med synet.3,4
Optisk kohærenstomografi (OCT III, Carl Zeiss) er en berøringsfri, ikke-invasiv billeddannelsesteknik, der giver et nyttigt supplement til diagnosticering af ME. Den retter en stråle af nær-infrarødt lys (830 nm) vinkelret på nethindens overflade og analyserer egenskaberne af refleksionerne. På 1,5 sekunder fremstiller den et enkelt lineært tværsnitsbillede med høj opløsning. Disse billeder kan vise og endda måle den fortykkede, cystiske nethinde, der findes i ødematøse områder. Det er også nyttigt til at visualisere egenskaberne af den vitreoretinale grænseflade og viser effektivt, hvornår glaslegemets trækkraft spiller en rolle i dannelsen af ME (se figur 2).
En undersøgelse anvendte OCT til at undersøge 84 øjne med ME sekundært til uveitis, hvilket gav den ekstra fordel at afsløre eller bekræfte tilstedeværelsen af epiretinale membraner og serøs nethindeløsning i henholdsvis 41 og 20 procent af deres tilfælde.5 Undersøgelsen fandt en moderat korrelation mellem nethindetykkelse og faldende synsstyrke, selv om graden af korrelation har varieret på tværs af undersøgelser, idet andre undersøgere har rapporteret svage,6 moderate,7 og stærke8,9,10 korrelationer ved hjælp af varierende statistiske metoder i forskellige patientpopulationer, herunder patienter med diabetisk retinopati, uveitis og CME.
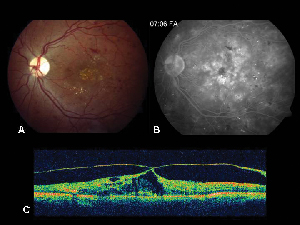
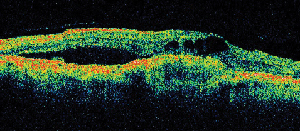
Figur 2. A. Fundusfotografi i farve af venstre øje hos en patient med ikke-proliferativ diabetisk retinopati og lipidexsudation i og omkring fovea. B. FA i sen fase afslører makulært ødem i den centrale macula. C. Optisk kohærens tomografi viser den unormale vitreoretinale grænseflade samt makulært ødem.
En anden gruppe rapporterede, at OCT var lige så effektiv som FA til at påvise ME og overlegen i forhold til FA til at beskrive den aksiale fordeling af væske.6 OCT har også evnen til at identificere nogle patienter med ME, der ikke visualiseres på FA, som i visse tilfælde af kronisk CME, hvor den form for aktiv lækage, der bedst visualiseres med FA, er minimal eller endog fraværende, eller når fundusundersøgelsen er kompromitteret af tilstedeværelsen af mediaopaciteter, som f.eks. hos patienter med asteroid hyalosis.11
Retinal thickness analyzer (RTA, Talia Technology, Israel) er en lignende berøringsfri billeddannelsesteknik, der giver mulighed for kvantificering af retinal tykkelse. Den frembringer 16 parallelle tværsnitsscanninger over et 3×3 kvadratmillimeter stort område af nethinden ved at analysere refleksioner fra en skråt rettet impuls af grønt lys (540 nm), der leveres over 0,3 sekunder. Både OCT og RTA har vist fremragende præcision i deres individuelle målinger af nethindetykkelse, og en direkte sammenligning af teknologierne har vist en statistisk signifikant korrelation mellem deres målinger. Mens RTA har den fordel, at den har hurtig erhvervelse med måske færre artefakter, synes den at være mindre effektiv til måling af nethindetykkelse end OCT i tilstedeværelse af medieopaciteter.12
En anden undersøgelse sammenlignede foveal tykkelse med RTA og OCT i 30 raske øjne. Den gennemsnitlige foveale tykkelse i de normale øjne blev målt til 181 µm og 153 µm for henholdsvis RTA og OCT. Forfatterne konkluderede, at RTA lejlighedsvis producerer falske høje værdier og derfor har nedsat pålidelighed sammenlignet med OCT.13 I modsætning hertil viste en analyse af patienter med mild ikke-proliferativ diabetisk retinopati, at RTA var mere følsom end OCT til at identificere områder med nethindetykkelse i de indledende faser af diabetisk ME.14
 |
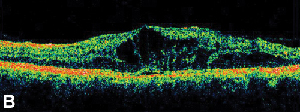 |
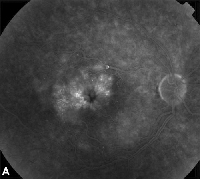
| Figur 3. A. Fluorescein-angiogram i sen fase af en patient med cystoidt makulaødem. | B. Optisk kohærenstomografi, der viser de store cystiske rum ved fovea. |
Behandlinger -Medicinsk
Topiske ikke-steroide antiinflammatoriske lægemidler er den mest almindelige behandling af ME efter kataraktoperation (se figur 3). Disse midler er rettet mod at nedsætte de intraokulære prostaglandinniveauer, som er blevet impliceret i patogenesen af ME. Dobbeltmaskede, randomiserede, aktive og placebokontrollerede undersøgelser med patienter, der har gennemgået kataraktoperation, har rapporteret om antiinflammatoriske virkninger af topisk påførte 1 % indometacin, 0,03 % flurbiprofen, 0,5 % ketorolac og 0,1 % diclofenac oftalmiske præparater.15,16 Diclofenac 0,1 % og ketorolac 0,5 % oftalmiske opløsninger er imidlertid de eneste topisk påførte NSAID’er, der specifikt er godkendt af Food and Drug Administration til denne indikation. Behandling, der kombinerer et aktuelt kortikosteroid og NSAID-dråber, har vist sig at have større effektivitet i behandlingen af ME end begge lægemidler alene.16 Selv om de ikke er FDA-godkendt, anvendes aktuelt anvendte NSAID’er ofte før kataraktoperation for at forebygge postoperativ ME.
Oral acetazolamid anvendes lejlighedsvis til behandling af ME sekundært til inflammatoriske tilstande og retinitis pigmentosa, især når topikale NSAID’er og kortikosteroider ikke virker. Flere prospektive, maskerede crossover-undersøgelser med sammenligning af acetazolamid og placebo hos patienter med ME på grund af forskellige årsager. En fem-cyklisk crossover-undersøgelse hos 41 patienter fandt et reproducerbart respons, karakteriseret som enten delvis eller fuldstændig opløsning af ME, hos mere end halvdelen af patienterne med arvelig eller inflammatorisk nethindesygdom, men intet respons hos dem med primære retinale kar-sygdomme.17 En 500 mg/dag eller oral acetazolamid viste sig at være mere effektiv end 250 mg/dag til behandling af ME hos patienter med ME sekundært til RP.18 Denne undersøgelse observerede forbedring hos 10 ud af 12 behandlede patienter.
En anden gruppe konkluderede, at patienter under 55 år med ME tilskrevet kronisk iridocyclitis var mere tilbøjelige til at reagere på 500 mg acetazolamid b.i.d. end ældre patienter.19 En nylig undersøgelse har antydet, at acetazolamid også kan være effektivt til behandling af diabetesinduceret ME.20
Cortikosteroider er potente antiinflammatoriske midler, der ofte anvendes i behandlingen af ME. De har flere virkningsmekanismer, herunder stabilisering af den blod-retinale barriere og hæmning af proinflammatoriske mediatorer. De kan gives lokalt, ved periokulær injektion, intravitreal injektion og ved både oral og intravenøs indgift. Selv om orale og intravenøse kortikosteroider helt sikkert når terapeutiske niveauer i glaslegemet, udsætter de patienterne for en yderligere risiko for systemiske komplikationer, og de er derfor normalt forbeholdt patienter med synstruende uveitis i forbindelse med systemisk sygdom. Topiske kortikosteroiddråber befinder sig i den anden ende af sikkerhedsspektret, men deres evne til at nå det bageste segment er begrænset.
Sub-Tenons injektioner tilbyder et alternativ til at afgive relativt høje doser kortikosteroider til øjet med lavere risiko for systemiske komplikationer.21 Selv om der ikke har været nogen randomiserede, kontrollerede forsøg, har sub-Tenons kortikosteroidinjektion været anvendt effektivt til behandling af makulaødem i mange år. Den mest almindelige teknik anvender en kort 25-ga. nål, der placeres gennem den superotemporale bulbære konjunktiva ind i sub-Tenon-rummet, mens patienten ser inferonasalt. Nålen føres bagud langs globen med en fejende side-til-side-bevægelse for at forhindre utilsigtet penetration af globen, indtil nålen når indgangsstedet i konjunktiva, hvor medicinen afgives. En rapport omfattede 20 på hinanden følgende patienter med intermediær uveitis i forbindelse med synstab, som blev behandlet med sub-Tenon-injektion af 40 mg triamcinolonacetonid.22 Selv om ikke alle patienter viste ME på FA, forbedrede 67 % sig med to synslinjer efter én behandling. Risici ved denne procedure omfatter bl.a. vedvarende forhøjet intraokulært tryk, katarakt, ptose og intraokulær penetration.
Nu er brugen af intravitreal injektion af triamcinolonacetonid (Kenalog, 4,0 mg) steget på grund af dets potente evne til at forbedre refraktær ME sekundært til diabetes mellitus (se figur 4), retinale venøse okklusioner, inflammation og andre idiopatiske årsager.23-26 Foreløbige undersøgelser viser en dramatisk reduktion i retinal fortykkelse, nedsat fluoresceinlækage og visuel forbedring, som kan være markant hos nogle patienter. Selv om virkningen er midlertidig og typisk varer i tre til seks måneder eller mindre, reagerer ME normalt på geninjektion. Brugen af intravitreale kortikosteroider er imidlertid forbundet med en risiko på 30-40 % for vedvarende forhøjet intraokulært tryk og en risiko på ca. 10 % for katarakt, der kræver operation. National Eye Institute er i øjeblikket i gang med at rekruttere patienter til SCORE, standardbehandling vs. kortikosteroid for retinal veneokklusion, som sammenligner intravitreale injektioner af triamcinolon (1- og 4-mg-doser) med standardbehandling (observation og/eller gitterlaserbehandling) hos patienter med ME som følge af veneokklusion. Undersøgelsen vil følge i alt 1.260 patienter og fortsætte behandlingen i 36 måneder.
ME forekommer også i forbindelse med aldersrelateret makuladegeneration (se figur 5). Intravitreal injektion af triamcinolonacetonid undersøges i øjeblikket med henblik på kombineret anvendelse med fotodynamisk terapi til behandling af neovaskulær AMD (Visudyne med intravitreal triamcinolonacetonid, VisTA). En undersøgelse understreger betydningen af intravitreal triamcinolon forud for anvendelsen af PDT hos patienter med makulaødem og CNV.27 Forfatterne teoretiserer, at verteporfin kan lække ind i cystiske intraretinale rum, hvilket kan føre til fotoreceptorskader på tilstødende, normal nethinde, når lægemidlet er fotoaktiveret, mens forudgående opløsning af nethindeødem kan forhindre denne komplikation. Forudgående indgivelse af kortikosteroid kan også tjene til at afbøde enhver PDT-induceret forhøjelse af de intraokulære VEGF-niveauer.
Intravitreale injektioner er i sig selv forbundet med små, men klare risici for alvorlige, potentielt blændende bivirkninger, herunder infektiøs endophthalmitis, nethindeløsning, blødning, okulær hypertension, katarakt og hypotoni.28 Nyligt offentliggjorte retningslinjer for intravitreale injektioner forsøger at etablere en bedste praksis for denne teknik, der anvendes i stigende grad. Konsensuspanelets anbefalinger omhandler overvejelser før injektion, herunder antibiotika, glaukomvurdering, brug af handsker og behandling af allerede eksisterende øjenlågsabnormaliteter samt vigtigheden af at undgå overdreven manipulation af øjenlåget før og under proceduren. Det anbefalede peri-injektionsregime omfattede brug af lokal og/eller subkonjunktival bedøvelse, lokal povidonjodin og et øjenlågsspekulum. Forfatterne understregede vigtigheden af at overvåge IOP og direkte fundusvisualisering efter injektionen for at verificere perfusion af synsnerven, intravitreal placering af triamcinolon og fravær af injektionsassocieret blødning eller nethindeløsning. De understregede også vigtigheden af patientuddannelse i forhold til tidlige symptomer på potentielle komplikationer og grundig opfølgning.29
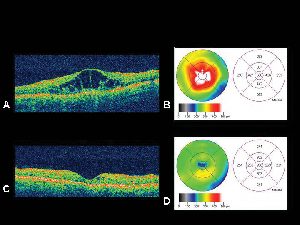
Figur 4. A. Optisk kohærens tomografibillede af et øje med diabetisk makulaødem med tilhørende nethindetykkelseskortB. genereret af OCT’en. C. OCT af den samme patient en måned efter intravitreal triamcinolonacetonidinjektion med tilsvarende nethindetykkelseskort. D. Opløsning af makulaødem. Synsstyrken forbedredes fra 20/200 til 20/80 efter behandlingen.
I flere forsøg undersøges alternative langtidsfordelere af kortikosteroid til brug i øjet. En undersøgelse omfatter kirurgisk anbringelse af en fluocinolonacetonidpellet indlejret på en plastikstrut med kontrolleret afgivelse af steroider over tre år. Det kaldes Envision intravitreal implantat fra Bausch & Lomb og Control Delivery Systems, og det placeres gennem pars plana og sutureres til sclera. En fase II/III-randomiseret, maskeret undersøgelse sammenlignede Envision TD-implantatet hos 80 patienter, der blev randomiseret til 0,5 vs. 2,0 mg fluocinolonacetonid vs. standardbehandling bestående af laserfotokokokulering eller observation. Efter seks måneder blev der set en statistisk signifikant reduktion i ME og sværhedsgraden af diabetisk retinopati med 0,5-mg-implantatet sammenlignet med standardbehandling. Desuden var der ingen forskelle i forekomsten af alvorlige bivirkninger. 2,0-mg-delen af undersøgelsen blev stoppet før tid på grund af de resultater, der blev observeret i en anden undersøgelse, hvor der ikke blev konstateret nogen fordel i forhold til 0,5 mg. Et andet studie omfattede 278 patienter med ikke-infektiøs posteriort uveitis, der randomiseres til at modtage enten et 0,59 mg eller 2,1 mg Retisert-implantat i det angrebne øje eller, i bilaterale tilfælde, i det sværest angrebne øje. Efter to doser og 34 uger var der en signifikant lavere recidivfrekvens i øjne med implantatet (10 vs. 55,7 procent, p<0,0001) med et fald i brugen af systemisk kortikosteroid/immunosuppressiv behandling (59,0 procent ved baseline vs. 13,7 procent efter 34 uger) samt brug af subtenon- og topisk steroid. Der var en signifikant forbedring af synsstyrken (p<0,05). De mest almindelige bivirkninger omfattede kataraktprogression og øget intraokulært tryk, som krævede en filtreringsprocedure hos 8,6 procent. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
Et andet forsøg omfatter Allergans Posurdex, en bioerodérbar dexamethasonpellet, der injiceres i glaslegemet, og som frigiver medicin over 50 til 160 dage. Resultaterne af et fase II-forsøg viste, at både en pille på 350 µg og 700 µg signifikant forbedrede procentdelen af patienter med to linjer eller mere forbedring af synet (henholdsvis 27,2 procent og 35,7 procent for 350 µg og 700 µg) samt tre linjer eller mere forbedring af synet (henholdsvis 13 procent og 19,4 procent for 350 µg og 700 µg) efter 180 dage sammenlignet med placebo. Indtil videre er der ikke rapporteret om øget forekomst af katarakt, selv om der blev set IOP-stigninger hos ca. 15 procent af patienterne.
Behandlinger -Laser
Sidst for nylig blev Eyetechs og Pfizers Macugen undersøgt i et randomiseret, dobbeltmaskeret, multicenter, dosisdifferentieret, kontrolleret fase II-forsøg med 172 patienter med diabetisk ME. I undersøgelsen blev tre doser (0,3 mg, 1,0 mg, 3,0 mg) undersøgt i forhold til skindinjektioner givet hver sjette uge i tre injektioner. Mens undersøgere af tidligere fokal/grid laserundersøgelser kun blev bedt om at tilmelde patienter, hos hvem de følte sig trygge ved at udskyde fokal/grid laser i mindst 12 uger. Yderligere injektioner og/eller fokal/grid-fotokoagulation blev givet efter investigatorens skøn fra uge 18 til 30. De endelige vurderinger blev foretaget i uge 36, seks uger efter den sidste planlagte injektion. Samlet set havde de personer, der fik tildelt Macugen, bedre synsresultater, var mere tilbøjelige til at vise reduktion i central nethindetykkelse og blev anset for mindre tilbøjelige til at have behov for yderligere laserbehandling sammenlignet med skindpatienter.31 En bekræftende fase III-undersøgelse er i øjeblikket planlagt.
Fokal/grid laserfotokoagulation er fortsat standardbehandlingsmetoden til behandling af diabetisk ME. Early Treatment Diabetic Retinopathy Study viste, at patienter, der blev behandlet med grid-laser, havde en 50-procent reduktion i moderat synstab, defineret som en fordobling af synsvinklen eller et fald i synet på tre linjer, sammenlignet med observation.30 Selv om den nøjagtige mekanisme, hvorved laser mindsker ME, er ukendt, men det antages, at den fremmer dannelsen af tætte forbindelser mellem RPE-celler samt reducerer iltbehovet fra fotoreceptorer og øger iltperfusionen fra choroid.31 EDTRS identificerede patienter, der er berettiget til fokal laserfotokoagulation, som har klinisk signifikant ME. Dette blev defineret som opfyldelse af et af følgende tre kriterier: 1) nethindetykkelse inden for 500 µm fra fovea; 2) hårde eksudater mindre end 500 µm fra fovea i forbindelse med tilstødende nethindetykkelse; eller 3) et ødemområde med en diskdiameter på 1 diskusdiameter eller derover, hvoraf en del er placeret mindre end 1 diskusdiameter fra fovea. EDTRS skelner imidlertid ikke mellem fokal ME, som svarer til en lokal fortykkelse af nethinden ved siden af mikroaneurismer, og diffus ME, som henviser til en generaliseret fortykkelse af den bageste pol. Anekdotiske beviser viser, at fokal diabetisk ME responderer godt på fokal/grid laser, mens den diffuse variant oftere mislykkes ved laserbehandling og kræver alternativ behandling.
 |
 |
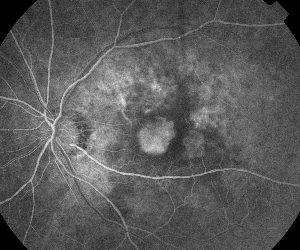
| Figur 5. A. Tidligt fluorescein angiogram, der viser klassisk subfoveal neovaskularisering. | B. Tilsvarende optisk kohærens tomografi afslører områder med subretinal og intraretinal væskeansamling samt demonstrerer neovaskulariseringen (pil). |
Behandlinger -Kirurgi
Den første gruppe, der rapporterede om fordelene ved vitrektomi og posteriort hyaloide separation hos patienter med diabetisk ME, antydede, at der findes en undergruppe af patienter, hos hvem glaslegemstraktion og overfladiske makuladelevationer bidrager til fortykkelse af nethinden.32 Dette er efterfølgende blevet bekræftet med OCT, hvilket har ført til en finjustering af indikationerne for denne teknik.33,34 De tre største serier35,36,37 af patienter, der har gennemgået vitrektomi for diabetisk ME, som ikke reagerede på mindre invasive behandlinger, analyserede henholdsvis 59, 58 og 65 patienter. De rapporterede, at henholdsvis 47 procent, 53 procent og 45 procent af deres patienter fik forbedret synet med to linjer eller mere. Den sidste af disse rapporterede alvorlige postoperative komplikationer udviklede sig hos et mindretal af patienterne, herunder nethindeløsning (1,5 procent), rubeosis iridis (4,6 procent) epiretinal membran (13,8 procent), tilbagevendende glaslegemeblødning(1,5 procent) og foveale hårde exudataflejringer (4,6 procent), mens komplikationerne afslørede den anden gruppe omfattede epiretinal membran i 10,2 procent og katarakt i 63,2 procent af de phake øjne. Flere andre caseserier har vist lignende resultater, men alle var ikke-randomiserede, uden placebokontrol og med forskellige inklusions- og eksklusionskriterier. Endvidere har de kirurgiske teknikker også været forskellige, hvilket gør de nøjagtige indikationer for vitrektomi hos patienter med CME åbne for fortolkning.
ME er fortsat en væsentlig årsag til synstab på trods af de mange forskellige tilgængelige behandlinger. Laserfotokokokulation er fortsat en integreret del af behandlingen af ME på grund af diabetes, iskæmi og vaskulære okklusioner. Topiske NSAID’er og kortikosteroider er i øjeblikket den primære metode til at kontrollere postoperativ ME, mens acetazolamid fortsat er et effektivt middel til behandling hos udvalgte patienter med ME sekundært til uveitis og retinitis pigmentosa. Intravitreale kortikosteroider spiller en stadig større rolle i behandlingen af ME, men er fortsat begrænset af bivirkninger og virkningsvarighed. Forfininger inden for kirurgiske teknikker vil fortsat tilføje en ny dimension til ME, der ikke reagerer på mindre invasiv behandling, mens fremskridt inden for farmakoterapi og okulær lægemiddeltilførsel lover at spille en rolle i forebyggelsen og behandlingen af alle årsager og typer af ME.
Dr. Ober er stipendiat i vitreoretinalkirurgi ved Edward S. Harkness Eye Institute ved Columbia University College of Physicians and Surgeons og LuEsther T. Mertz Retinal Research Center ved Manhattan Eye, Ear, and Throat Hospital. Kontakt ham på 210 East 64th St., 8th Fl, New York, NY 10021; e-mail: [email protected]; eller (212) 605 3777 eller fax (212) 605 3795.
Dr. Klais er retina fellow på LuEsther T. Mertz Retinal Research Center. Kontakt hende på samme adresse, telefon- eller faxnummer eller via e-mail på [email protected].
Dr. Cunningham er klinisk professor i oftalmologi og leder af Uveitis Service på New York University, School of Medicine. Han er også ansat hos Eyetech Pharmaceuticals Inc. Kontakt ham på Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., New York, N.Y. 10022, pr. e-mail [email protected] eller pr. telefon/fax på (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Kronisk cystoid makulært ødem og prædiktorer for synsstyrken. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. Et perspektiv på behandlingen af aphakisk cystoidt makulaødem. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Postoperativt cystoid makulært ødem. In: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Makulær fortykkelse og synsstyrke. Måling hos patienter med cystoidt makulaødem. Ophthalmology 1987;94;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Mønstre af makulaødem hos patienter med uveitis: kvalitativ og kvantitativ vurdering ved hjælp af optisk kohærenstomografi. Ophthalmology 2004;111:946-53.
6. Antcliff RJ, Stanford MR, Chauhan DS, et al. Sammenligning mellem optisk kohærenstomografi og fundus fluoresceinangiografi til påvisning af cystoidt makulaødem hos patienter med uveitis. Ophthalmology 2000; 107:593-9.
7. Otani T, Kishi S, Maruyama Y. Patterns of diabetic macular edema with optical coherence tomography. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Puliafito CA, Wong C, et al. Kvantitativ vurdering af makulaødem med optisk kohærenstomografi. Arch Ophthalmol 1995;113;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Måling hos patienter med cystoidt makulaødem. Ophthalmology 1987;94;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. Optical coherence tomographic assessment of diabetic macular edema: comparison with fluorescein angiographic and clinical findings. Ophthalmologica 2005;219;219:86-92.
11. Browning DJ, Fraser CM. Optisk kohærenstomografi til påvisning af makulaødem ved tilstedeværelse af asteroide hyalose. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Sammenligning mellem retinal tykkelsesanalysator og optisk kohærenstomografi til vurdering af foveal tykkelse i øjne med makulær sygdom. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Sammenligning af foveal tykkelse målt med retinal tykkelsesanalysator og optisk kohærenstomografi. Retina 2001;21;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Retinal tykkelse i øjne med mild ikke-proliferativ retinopati hos patienter med type 2-diabetes mellitus: sammenligning af målinger opnået ved retinal tykkelsesanalyse og optisk kohærens tomografi. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Cyclo-oxygenasehæmmere i oftalmologi. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac versus prednisolon versus kombinationsbehandling ved behandling af akut pseudophakisk cystoid maculaødem. Ophthalmology 2000;107;107:2034-8.
17. Cox SN, Hay E, Bird AC. Behandling af kronisk makulaødem med acetazolamid. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Acetazolamid til behandling af kronisk makulaødem ved retinitis pigmentosa. Arch Ophthalmol 1989;107;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. Reduktion af makulært ødem ved acetazolamid hos patienter med kronisk iridocyclitis: en randomiseret prospektiv crossover-undersøgelse. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. Er acetazolamid effektivt til behandling af diabetisk makulaødem? En pilotundersøgelse. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Rusin MM, Tessler HH, Cunha-Vaz JG. Posterior sub-Tenon-injektioner af kortikosteroider hos uveitis-patienter med cystoidt makulaødem. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. Virkningerne af posterior subtenon-injektion af triamcinolonacetonid hos patienter med intermediær uveitis. Am J Ophthalmol 1995;120;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Intravitreal triamcinolon til behandling af refraktært pseudophakisk makulaødem. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Intravitrealt triamcinolonacetonid som behandling af makulaødem ved central retinal veneokklusion. Graefes Arch Clin Exp Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Intravitreal triamcinolon til behandling af refraktært diabetisk makulaødem. Ophthalmology 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW Jr., Rosenfeld PJ. Intravitrealt triamcinolonacetonid til idiopatisk cystoidt makulaødem. Am J Ophthalmol 2003;136;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sekvenseret kombineret intravitreal triamcinolon og indocyaningrøn angiografistyret fotodynamisk terapi for retinal angiomatøs proliferation. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Patel SC, Cunningham ET Jr. Risici ved intravitreal injektion: en omfattende gennemgang. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Evolving guidelines for intravitreale injektioner. Retina 2004 Oct;24(5 Suppl);24(5 Suppl):S3-19.
30. .G.Jaffe, Fluocinolonacetonid Uveitis Study Group. Fluocinolonacetonid Intravitreal Implantat for Uveitis Affecting the Posterior Segment of the Eye. ARVO 2004, plakat nr. 3369.
31. Macugen Diabetic Retinopathy Study Group. Et fase II-randomiseret, dobbeltmaskeret forsøg med pegaptanib, en anti-vaskulær endothelial vækstfaktor-aptamer, til behandling af diabetisk makulaødem. Ophthalmology, In press.
32. 30. Fotokoagulation ved diabetisk makulaødem. Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Kirurgisk og anden behandling af diabetisk makulaødem: en opdatering. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrektomi ved diabetisk makulær traktion og ødem i forbindelse med posteriort hyaloidal traktion. Ophthalmology 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Macular traction detachment and diabetic macular edema associated with posterior hyaloidal traction. Am J Ophthalmol 2001;131;131:44-9.
36. Lewis H. Vitrektomiens rolle i behandlingen af diabetisk makulaødem. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrektomi ved diabetisk makulaødem i forbindelse med et stramt præmakulært posteriort hyaloid. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrektomi for diffust makulaødem i tilfælde af diabetisk retinopati. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Tidlige postoperative nethindetykkelsesændringer og komplikationer efter vitrektomi for diabetisk makulaødem. Am J Ophthalmol 2003;135:14-9.