Det kemiske grundstof kobolt er klassificeret som et overgangsmetal. Det blev opdaget i 1735 af George Brandt.

Datazone
| Klassifikation: | Kobolt er et overgangsmetal |
| Farve: | |
| Atomvægt: | 58.9332 |
| Status: | |
| Protoner: | |
| Protoner: | |
| Neutroner i den hyppigste isotop: | |
| Elektronskaller: | |
| Elektronskaller: | |
Vis mere: Varme, energi, oxidation, reaktioner,
forbindelser, radier, ledningsevner
| Struktur: | |
| Specifik varmekapacitet | |
| Smeltningsvarme | |
| fordampningsvarme | |
| 1. ioniseringsenergi | |
| 2. ioniseringsenergi | |
| 3. ioniseringsenergi | |
| Elektronaffinitet | |
| Polarisérbarhed volumen | 7,5 Å3 |
| mild, m/ht ? Co3O4 | |
| Reaktion med 6 M NaOH | – |
| Hydrid(er) | |
| Atomisk radius | |
| Ionisk radius (1+ ion) | |
| Ionisk radius (2+ ion) | 83.8 pm |
| Ionisk radius (3+ ion) | |
| Ionisk radius (1-ion) | |
| 17.9 x 106 S m-1 | |
| Frost-/smeltepunkt: | 1495 oC, 1768 K |
Offentliggørelse af kobolt
Siden oldtiden har koboltforbindelser været anvendt til fremstilling af blåt glas og keramik.
Elementet blev først isoleret af den svenske kemiker George Brandt i 1735. Han viste, at det var tilstedeværelsen af grundstoffet kobolt, der forårsagede den blå farve i glas, og ikke bismuth, som man tidligere havde troet.
Omkring 1741 skrev han: “Ligesom der findes seks slags metaller, har jeg også med pålidelige eksperimenter vist … at der også findes seks slags halvmetaller: et nyt halvmetal, nemlig kobolt regulus ud over kviksølv, bismuth, zink og regulus af antimon og arsenik.”
Ordet kobolt er afledt af det tyske “kobold”, der betyder trold eller nisse. Billedet af kobolt nedenfor er af Ben Mills.


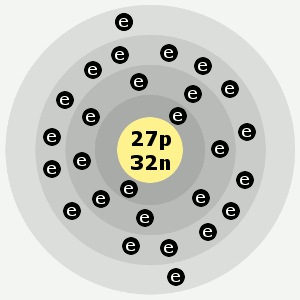
Kobalts elektronskaller
Udseende og egenskaber
Skadelige virkninger:
Kobolt og dets forbindelser anses for at være svagt giftige ved hudkontakt og moderat giftige ved indtagelse.
Karakteristika:
Kobolt er et blåligt hvidt, skinnende, hårdt og skørt metal. Det er ferromagnetisk.
Metallet er kemisk aktivt og danner mange forbindelser. Kobolt forbliver magnetisk til den højeste temperatur af alle de magnetiske grundstoffer (det har et Curiepunkt på 1121oC).
Anvendelser af kobolt
Kobolt anvendes i legeringer til dele til flymotorer og i legeringer med korrosions-/slidbestandige anvendelser.
Kobolt er meget anvendt i batterier og til galvanisering.
Kobaltsalte anvendes til at give glas og keramik blå og grønne farver.
Radioaktivt 60Co anvendes til behandling af kræft.
Kobolt er vigtigt for mange levende væsener og er en bestanddel af vitamin B12.
Kobolt anvendes også i permanente samarium-kobolt-magneter. Disse bruges i guitar-pickupper og højhastighedsmotorer.
Forsyning og isotoper
Forsyning af jordskorpen: 25 vægtdele pr. million, 8 dele pr. million i mol
Forsyning af solsystemet: 4 vægtdele pr. million, 0,7 moldele pr. million
Kostpris, ren: $21 pr. 100 g
Kostpris, bulk: $4,40 pr. 100 g
Kilde: Kobolt findes ikke som frit grundstof i naturen. Det findes i mineralske malme. De vigtigste malme af kobolt er cobaltit (CoAsS), erythrit (hydreret arsenat af cobalt), glaucodot (Co,Fe)AsS og skutterudit (Co,Ni)As3. Kobolt fremstilles generelt som et biprodukt af nikkel- og kobberudvinding.
Isotoper: Kobolt har 22 isotoper, hvis halveringstider er kendt, med massetal 50 til 72. Naturligt forekommende kobolt består af dets ene stabile isotop, 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana; or Universal Dictionary of Knowledge.., 1845, Volume 4, p693 William Clowes and Sons.
Cite this Page
Cite this Page
For online linking, please copy and paste one of the following:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
or
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
To cite this page in a academic document, please use the following MLA-compliant citation:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.