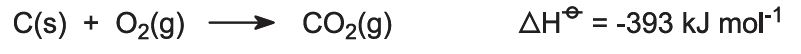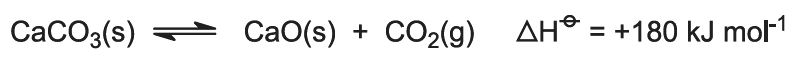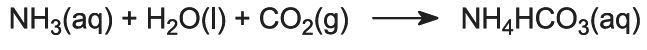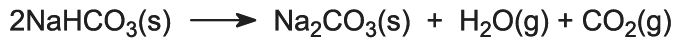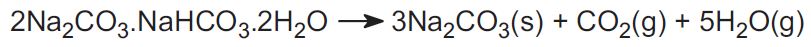- Verwendungszwecke von Natriumkarbonat
- Jährliche Produktion von Natriumkarbonat
- Herstellung von Natriumcarbonat
- (a) aus Natriumchlorid und Kalziumkarbonat
- (1) Ammoniakisierung von Salzsole
- (2) Bildung von Calciumoxid und Kohlendioxid
- (3) Der Solvay-Turm
- (4) Abtrennung von festem Natriumhydrogencarbonat
- (5) Bildung von Natriumcarbonat
- (6) Bildung von Kalziumhydroxid
- (7) Regenerierung von Ammoniak
- (b) Aus Trona- und Nahkoliterzen
Verwendungszwecke von Natriumkarbonat
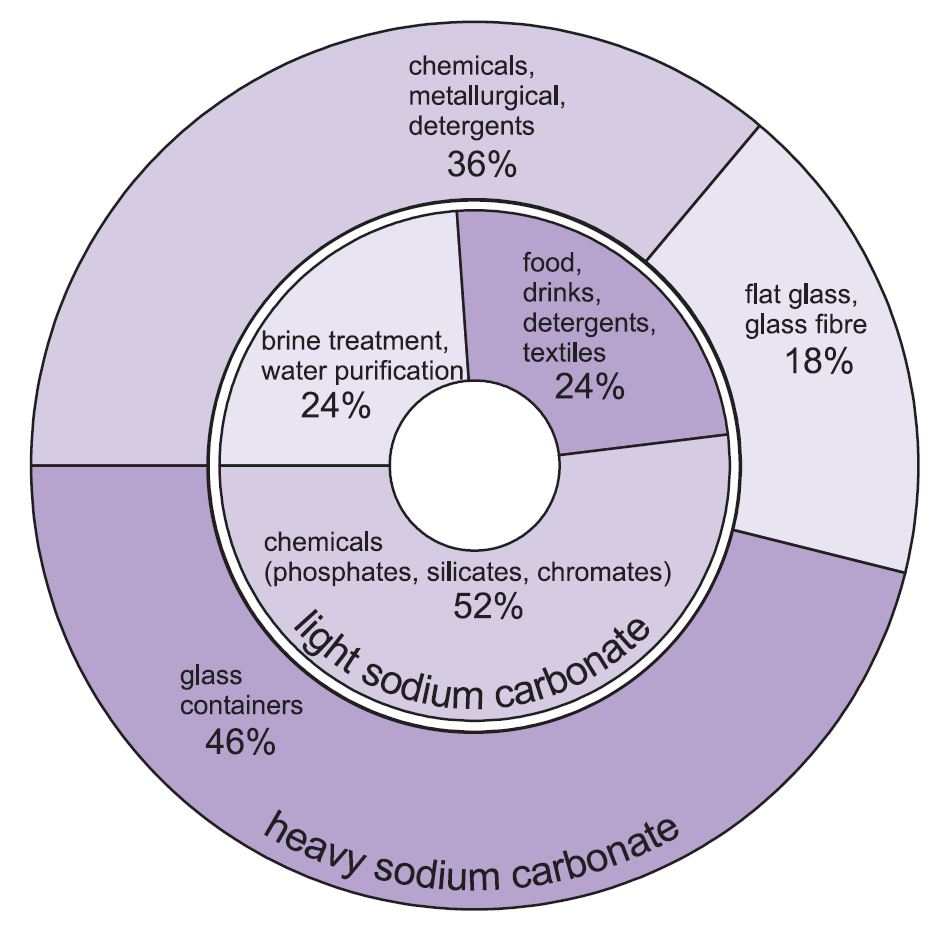
Zwei Formen von Natriumkarbonat (Soda) werden verwendet – schweres und leichtes. Die leichte Form wird zuerst gewonnen und ein Teil wird dann in die schwere Form umgewandelt. Leichtes Natriumkarbonat enthält weniger als 0,5 % Natriumchlorid. Schweres Natriumcarbonat wird durch Hydratation von leichtem Natriumcarbonat zum Monohydrat (Na2CO3.H2O) und anschließende Dehydratisierung gewonnen, um ein Produkt mit größerer Kristallgröße und Dichte zu erhalten.
Die beiden Qualitäten haben unterschiedliche Verwendungszwecke.
Das schwere Natriumcarbonat wird hauptsächlich als Feststoff verwendet, insbesondere in der Glasherstellung, wo es als Flussmittel beim Schmelzen von Quarz (Sand) eingesetzt wird.
Das leichte Natriumcarbonat wird traditionell dort verwendet, wo die Chemikalie in Lösung benötigt wird.
Abbildung 1 Verwendung von schwerem und leichtem Natriumkarbonat.
Insgesamt werden etwa 50 % der Gesamtproduktion von Natriumkarbonat zur Herstellung von Glas, 18 % zur Herstellung anderer Chemikalien und 10 % in Seifen und Reinigungsmitteln verwendet.
Jährliche Produktion von Natriumkarbonat
China ist der weltweit größte Produzent von Natriumkarbonat, mit einem Anteil von 46 % an der Weltproduktion und 23 % in den USA. (IHS Markit, 2015)
| Welt | 52 Millionen Tonnen1,2 |
| China | 25 Millionen Tonnen3 |
| U.S. | 12 Millionen Tonnen1 |
| Europa | 11 Millionen Tonnen |
| Russland | 0.71 Millionen Tonnen4 |
Daten aus:
1. 2018 Elements of the Business of Chemistry, American Chemistry Council.
2. Hiervon werden 14,7 Tonnen abgebaut. Der überwiegende Teil wird in den USA (11,7 Millionen Tonnen) und der Türkei (2 Millionen Tonnen) abgebaut. Der Rest wird aus Natriumchlorid und Calciumcarbonat hergestellt.
3. IHS Markit, 2015
4. Federal State Statistics Service: Russische Föderation 2011
Herstellung von Natriumcarbonat
Es gibt zwei Hauptquellen für Natriumcarbonat:
a) aus Salz und Kalziumkarbonat (über das Ammoniak-Soda-Verfahren (Solvay))
b) aus Natriumkarbonat und Hydrogenkarbonaterzen (Trona und Nahkolith)
(a) aus Natriumchlorid und Kalziumkarbonat
Die Gesamtreaktion kann als zwischen Kalziumkarbonat und Natriumchlorid angesehen werden:
Allerdings ist Calciumcarbonat zu unlöslich, um mit einer Salzlösung zu reagieren. Stattdessen wird das Produkt in einer Reihe von sieben Stufen gewonnen.
Das Verfahren ist als Ammoniak-Soda-Verfahren oder Solvay-Verfahren bekannt, benannt nach dem belgischen Industriechemiker, der es 186I patentierte.
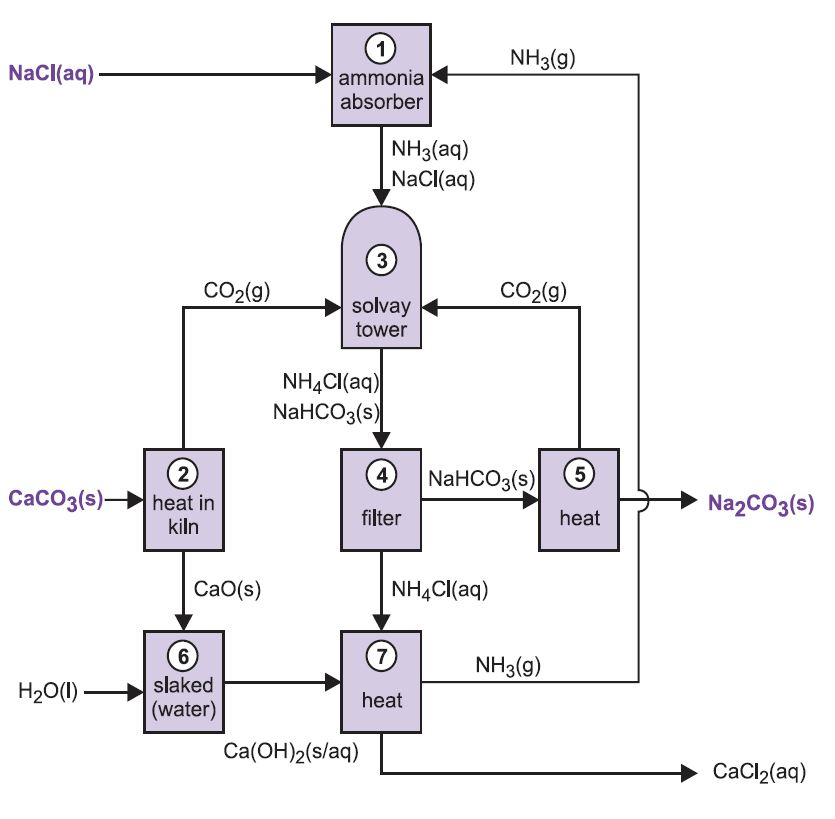
Die verschiedenen Stufen des Solvay-Verfahrens sind miteinander verknüpft, wie aus dem folgenden Diagramm und der Beschreibung hervorgeht.
Abbildung 2 Verschiedene Stufen des Solvay-Prozesses.
(1) Ammoniakisierung von Salzsole
Ammoniakgas wird in konzentrierter Salzsole absorbiert, so dass eine Lösung entsteht, die sowohl Natriumchlorid als auch Ammoniak enthält. Es sind Na+(aq), Cl-(aq), NH4+(aq), OH-(aq) und NH3(aq) Ionen vorhanden.
(2) Bildung von Calciumoxid und Kohlendioxid
Die Öfen werden mit einem Kalkstein-Koks-Gemisch (13:1 nach Masse) beschickt. Der Koks verbrennt im Gegenstrom mit vorgewärmter Luft:
Die Verbrennungswärme erhöht die Temperatur des Ofens und der Kalkstein zersetzt sich:
Das Gas, das etwa 40 % Kohlendioxid enthält, wird vom Kalkstaub befreit und zu den Karbonisierungstürmen (Solvay) geleitet. Der Rückstand, Kalziumoxid, wird zur Ammoniakrückgewinnung verwendet (siehe Schritt 7 unten).
(3) Der Solvay-Turm
Dies ist die wichtigste Stufe des Verfahrens. Die ammoniakhaltige Sole aus Schritt (1) wird durch den Solvay-Turm nach unten geleitet, während das Kohlendioxid aus den Schritten (2) und (5) nach oben geleitet wird. Der Solvay-Turm ist hoch und enthält eine Reihe pilzförmiger Leitbleche, die den Flüssigkeitsstrom verlangsamen und aufbrechen, so dass das Kohlendioxid effizient von der Lösung absorbiert werden kann. Das Kohlendioxid reagiert beim Lösen mit dem gelösten Ammoniak und bildet Ammoniumhydrogencarbonat:
Die Lösung enthält nun die Ionen Na+(aq), Cl-(aq), NH4+(aq) und HCO3-(aq). Von den vier Stoffen, die durch verschiedene Kombinationen dieser Ionen gebildet werden können, ist Natriumhydrogencarbonat (NaHCO3) der am wenigsten lösliche. Es fällt als Feststoff im unteren Teil des Turms aus, der abgekühlt wird. Der Nettoprozess ist:
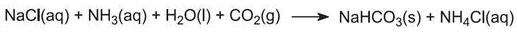
Eine Suspension von festem Natriumhydrogencarbonat in einer Ammoniumchloridlösung wird aus dem Boden des Turms abgelassen.
(4) Abtrennung von festem Natriumhydrogencarbonat
Die Suspension wird filtriert, um das feste Natriumhydrogencarbonat von der Ammoniumchloridlösung zu trennen, die dann in Stufe (7) verwendet wird.
(5) Bildung von Natriumcarbonat
Das Natriumhydrogencarbonat wird in Rotationsöfen bei 450 K erhitzt, so dass es sich zu Natriumcarbonat, Wasser und Kohlendioxid zersetzt:
Das Kohlendioxid wird zur Verwendung in Schritt (3) zurück in den Solvay-Turm geschickt. Das Produkt des Verfahrens, wasserfreies Natriumkarbonat, wird als feines weißes Pulver gewonnen, das als leichtes Natriumkarbonat bekannt ist.
(6) Bildung von Kalziumhydroxid
Die letzten beiden Stufen, (6) und (7), befassen sich mit der Regeneration von Ammoniak aus Ammoniumchlorid (hergestellt in Stufe 3). Der Branntkalk aus Schritt (2) wird mit überschüssigem Wasser gelöscht, wodurch Kalkmilch entsteht:
(7) Regenerierung von Ammoniak
Diese Kalziumhydroxid-Suspension wird mit der Ammoniumchlorid-Lösung aus Schritt (4) gemischt und erhitzt:
Das Ammoniak wird auf diese Weise zurückgewonnen und zurück zu Schritt (1) geleitet. Kalziumchlorid ist das einzige Nebenprodukt des gesamten Prozesses.
Der gesamte Prozess ist ein elegantes Verfahren. Theoretisch sind die einzigen Rohstoffe Kalkstein und Salzsole. Es kommt zwangsläufig zu Ammoniakverlusten, die durch die Zugabe zusätzlicher Rohstoffe ausgeglichen werden, wie es in Schritt (1) erforderlich ist.
(b) Aus Trona- und Nahkoliterzen
Das Solvay-Verfahren wird in den USA nicht angewandt. Stattdessen verwendet die Industrie zwei Erze, auf die etwa 30 % der Weltproduktion entfallen. Das eine ist Trona, das in Wyoming in großen Mengen vorkommt. Trona hat die Formel:
Das Erz wird als Feststoff abgebaut und erhitzt, um das Kohlendioxid auszutreiben und Natriumcarbonat zu gewinnen:
Das andere Erz ist Nahkolith, das Natriumhydrogencarbonat ist. Beim Erhitzen bildet es Natriumcarbonat.