- Introduction
- Methoden
- Einschluss und Ausschluss von Patienten
- Standardprotokollgenehmigungen und Patienteneinwilligungen
- Untersuchungsprogramm
- Statistik
- Ergebnisse
- Häufigkeit von IDNA bei RLS-Patienten
- Klinische Merkmale von RLS-Patienten mit IDNA im Vergleich zu NID
- Klinische Merkmale von RLS-Patienten mit IDNA im Vergleich zu IDA
- Hämatologische Merkmale bei Kontrollpersonen
- Diskussion
- Klinische Merkmale von IDNA bei RLS
- Ist IDNA ein Frühstadium vor IDA bei RLS?
- Zugang und Diagnose von IDNA bei RLS
- Schlussfolgerung
- Datenverfügbarkeitserklärung
- Ethikerklärung
- Beiträge der Autoren
- Finanzierung
- Interessenkonflikt
- Danksagungen
- Ergänzendes Material
- Abkürzungen
Introduction
Das Syndrom der unruhigen Beine (RLS) ist eine häufige neurologische Störung (1), und Eisenmangel spielt eine Schlüsselrolle in der Pathogenese (2, 3). Eisenmangel kommt bei RLS häufig vor, und Eisenmangelanämie (IDA) ist eine bekannte Ursache für sekundäres RLS (4, 5), die mit einem sechsfach erhöhten Risiko für RLS in der Allgemeinbevölkerung verbunden ist (6). Eisenmangel ohne Anämie (IDNA, auch nichtanämischer Eisenmangel) ist in der Regel schleichend und hat in jüngster Zeit aufgrund seiner weltweiten Verbreitung und der damit verbundenen Herausforderung für Diagnose und Behandlung Aufmerksamkeit erregt (7). Obwohl ein klarer Zusammenhang zwischen der klinischen Bedeutung von RLS in der IDA-Population (6) besteht, wurden die Prävalenz und die Merkmale von IDNA bei RLS nicht systematisch untersucht. Es ist nicht bekannt, ob IDNA eine Untergruppe des RLS darstellt und ob IDNA ein frühes Stadium vor IDA beim RLS ist. In dieser Studie wollen wir die klinischen Merkmale von RLS mit IDNA im Vergleich zu denen ohne Eisenmangel (NID, auch Nicht-Eisenmangel) und zu IDA-Patienten in einer konsekutiven Kohorte von chinesischen RLS-Patienten untersuchen.
Methoden
Einschluss und Ausschluss von Patienten
Wir rekrutierten kontinuierlich Patienten aus unserer RLS-Spezialklinik und der Klinik für Bewegungsstörungen in der Abteilung für Neurologie, Shanghai General Hospital, Shanghai Jiao Tong University School of Medicine zwischen Jan. 2017 und Okt. 2018. Das RLS wurde nach den Diagnosekriterien der International Restless Legs Syndrome Study Group (RLSSG) von 2014 diagnostiziert (1). Patienten mit anderen neurologischen Erkrankungen, schlechter Kooperation oder kognitiven Beeinträchtigungen wurden von der Studie ausgeschlossen. Alters- und geschlechtsgleiche gesunde Kontrollpersonen ohne Anämie wurden im gleichen Zeitraum im Gesundheitsuntersuchungszentrum unseres Krankenhauses rekrutiert. Die Kontrollen waren frei von neurologischen Erkrankungen, einschließlich RLS, und wurden von Angesicht zu Angesicht befragt.
Standardprotokollgenehmigungen und Patienteneinwilligungen
Die Studie wurde vom Shanghai General Hospital Institutional Review Board genehmigt, und alle Patienten und gesunden Kontrollen, die an der Studie teilnahmen, gaben ihre schriftliche Einwilligung.
Untersuchungsprogramm
RLS-Patienten wurden wie zuvor beschrieben untersucht (8). Kurz gesagt, wir befragten die Patienten persönlich in unserer Ambulanz. Patienten, bei denen ein RLS festgestellt wurde, wurden von zwei auf RLS spezialisierten Neurologen diagnostiziert. Wir erfassten demografische Informationen, Anamnese, Symptome, Medikamente, allgemeine neurologische und medizinische Untersuchungen sowie den MMSE-Wert für alle rekrutierten Patienten. Darüber hinaus wurde ein halbstrukturierter Fragebogen ausgewertet, der das Alter bei Auftreten des RLS, die RLS-Familienanamnese (Vertrautheit definiert als „Verwandte ersten Grades“), Art und Topographie der Empfindungen und die Frage, ob die RLS-Symptome mit jahreszeitlichen Schwankungen korrelierten, umfasste. Der Schweregrad des RLS in der Woche vor der Befragung wurde anhand der Internationalen RLS-Ratingskala (IRLSRS) bewertet (9). Untersuchungen wie vaskulärer Ultraschall, Nervenleitgeschwindigkeiten, Elektromyographie usw. wurden durchgeführt, wenn dies klinisch angezeigt war, um mögliche RLS-Mimiken wie periphere Polyneuropathien, venöse Stase, vaskuläre Claudicatio, rheumatoide Arthritis usw. auszuschließen. Probanden, die in den vorangegangenen drei Monaten Neuroleptika oder andere Medikamente eingenommen hatten, die nach Ansicht der Autoren möglicherweise mit RLS in Zusammenhang stehen, wurden ebenfalls ausgeschlossen. Ausgeschlossen wurden Personen mit auffälligen Begleiterkrankungen, die mit sekundärem RLS in Verbindung gebracht wurden, wie chronisches Nierenversagen, Schwangerschaft, Parkinson-Krankheit, periphere Neuropathie, Schlaganfall und Ataxie. Es wurden Bluttests für Hämoglobin und den peripheren Eisenstatus einschließlich Serumferritin, Eisen, Transferrin und Gesamteisenbindungskapazität (TIBC) durchgeführt. Die Transferrinsättigung (TSAT) wurde als Serumeisen/TIBC × 100 berechnet. Als normaler Hämoglobinwert wurde bei Frauen ein Wert von ≥ 113 g/L und bei Männern ein Wert von ≥ 131 g/L gemäß dem in unserem Krankenhaus geltenden Normalwert definiert. IDNA ist definiert als Serumferritin <75 μg/L (oder Ferritin ≥ 75 μg/L, aber TSAT <20%) bei normalem Hämoglobinwert (10, 11). IDA wird diagnostiziert, wenn Hämoglobin <113 g/L (Frauen) oder <131 g/L (Männer) sowie Serumferritin <75 μg/L (oder Serumferritin ≥ 75 μg/L, aber TSAT <20%).
Statistik
Daten wurden mit SPSS 21.0 für Windows (IBM Co., USA) analysiert. Alle Daten sind als Mittelwerte ± Standardabweichungen angegeben. Da die meisten Variablen nicht normalverteilt waren, wurde der Kruskal-Wallis-Test für den Vergleich einzelner Variablen zwischen drei Gruppen verwendet, und post-hoc Mann-Whitney, wenn P < 0,05. Unterschiede in den Proportionen wurden gegebenenfalls mit dem Chi-Quadrat-Test von Pearson oder dem exakten Test von Fisher analysiert. P < 0,05 wurde als signifikant angesehen. In Anbetracht der möglichen Auswirkungen einer medikamentösen Therapie auf die RLS-Symptome und andere Merkmale haben wir alle Daten zweimal berechnet, und zwar für die RLS-Patienten insgesamt und für die RLS-Patienten ohne Medikamente.
Ergebnisse
In diese Studie haben wir kontinuierlich insgesamt 196 primäre RLS-Patienten ohne Anämie (IDNA RLS und NID RLS) aufgenommen, darunter 66 männliche Patienten (33,7%) und 130 weibliche Patienten (66,3%). Das Durchschnittsalter betrug 53,0 ± 13,5 Jahre. 65,8 % (129/196) der RLS-Patienten nahmen keine Medikamente gegen RLS ein (109 medikamentenfrei und 20 medikamentenfrei seit mehr als 2 Wochen bei der Befragung). Wir schlossen auch 26 RLS-Patienten mit IDA ein (22 medikamenten-naiv). Wir schlossen fünf anämische RLS-Patienten aus (Hb <113 g/L bei Frauen und Hb <131 g/L bei Männern), die keine Anzeichen von Eisenmangel aufwiesen (Serumferritin ≥ 75 μg/L sowie TIBC ≥ 20%, mittleres Serumferritin 236,1 ± 119,3 μg/L). Keiner der RLS-Patienten mit IDA hatte irgendwelche Anzeichen einer Infektion, und die Ursachen für IDA RLS wurden aufgelistet (Tabelle 1). Zusätzlich sammelten wir 63 gesunde Kontrollpersonen, darunter 22 männliche Probanden (34,9 %) und 41 weibliche Probanden (65,1 %), und das Durchschnittsalter der Kontrollgruppe betrug 51,0 ± 12,0 Jahre (das Durchschnittsalter von 51,0 ± 10,4 und 51,0 ± 12,8 für Männer bzw. Frauen). Es gab keine signifikanten Unterschiede in Bezug auf das Geschlecht (RLS vs. Kontrolle: 66,3 vs. 65,1% für Frauen, P > 0,05) und das Alter (RLS vs. Kontrolle: 53,0 ± 13,5 vs. 51,0 ± 12,0, P > 0,05) zwischen RLS-Patienten und Kontrollen. Detaillierte demografische Daten der RLS-Patienten in jeder Gruppe sind in Tabelle 2 aufgeführt.
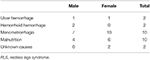
Tabelle 1. Mögliche Ursachen für Eisenmangel bei anämischen RLS-Patienten.
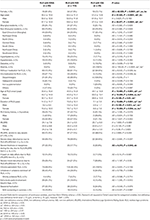
Tabelle 2. Demografische Informationen und klinische Merkmale von RLS-Patienten mit IDNA, NID und IDA.
Häufigkeit von IDNA bei RLS-Patienten
Von den 196 RLS-Patienten (130 Frauen, 66 Männer) ohne Anämie oder andere Komorbiditäten wiesen 83 (42,3 %) einen Eisenmangel auf. Die Prävalenz von IDNA bei Frauen (58,5 %, 76/130) ist in dieser Kohorte von RLS-Patienten ohne Anämie viel höher als bei Männern (10,6 %, 7/66) (Tabelle 2), mit einem relativen Risiko von 5,51 (95 % Konfidenzintervall 2,70-11,27, p < 0,0001).
Klinische Merkmale von RLS-Patienten mit IDNA im Vergleich zu NID
Bei weiblichen RLS-Patienten ohne Anämie war die IDNA-Gruppe im Vergleich zur NID-Gruppe sowohl bei der Befragung als auch beim Auftreten des RLS jünger (P < 0,01; Tabelle 2). Obwohl es keinen Unterschied im Schweregrad des RLS nach IRLSRS gab, fanden wir in der IDNA-Gruppe mehr Patienten mit schwerer/sehr schwerer Müdigkeit oder Schläfrigkeit während des Tages als in der NID-Gruppe (32,5 vs. 17,7%, P < 0,05; Tabelle 2). Hinsichtlich der Familienanamnese, des Schweregrads, der Lateralität, der Lokalisation und der saisonalen Fluktuation des RLS gab es keine Unterschiede zwischen der IDNA- und der NID-Gruppe, weder bei Männern noch bei Frauen. Die IDNA-RLS-Gruppe wies im Vergleich zur NID-RLS-Gruppe ein niedrigeres Serumferritin (Männer und Frauen, P < 0,0001) sowie höhere Transferrin- und TIBC-Werte (Frauen, P < 0,0001) auf (Abbildung 1, Tabelle 3).
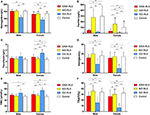
Abbildung 1. Die hämatologischen und Eisenparameter nach Gruppe und Geschlecht (A) Hämoglobin. (B) Ferritin. (C) Transferrin. (D) Eisen. (E) TIBC. (F) TSAT. **P < 0,01, *P < 0,05, Kruskal-Wallis-Test und post-hoc Mann-Whitney-Test. Daten im Vergleich zwischen IDNA RLS (n = 83), NID RLS (n = 113), IDA RLS (n = 26) und Kontrollen (n = 63). ##P < 0,01, #P < 0,05, Mann-Whitney U-Test. Die Daten wurden zwischen Männern und Frauen in jeder Gruppe von IDNA RLS, NID RLS, IDA RLS und Kontrollen verglichen. Eisenmangel war definiert als Ferritinspiegel <75 μg/L oder Ferritin 75 μg/L, aber TSAT <20%. IDA, Eisenmangelanämie; IDNA, Eisenmangel ohne Anämie; NID, nicht eisenarm; RLS, Restless-Legs-Syndrom; TIBC, Gesamteisenbindungskapazität; TSAT, Transferrinsättigung.
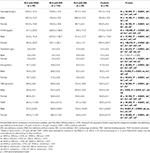
Tabelle 3. Hämatologische Daten von RLS-Patienten mit IDNA, NID, IDA und Kontrollen.
Nach Ausschluss der RLS-Patienten, die Medikamente gegen RLS einnehmen, wies die IDNA-RLS-Gruppe im Vergleich zur NID-RLS-Gruppe immer noch eine höhere Rate an schwerer/sehr schwerer Tagesmüdigkeit/Schläfrigkeit auf, wenn auch nicht auf einem signifikanten Niveau (35 vs. 18,8 %, P = 0,078). Andere Merkmale zwischen IDNA RLS und NID RLS waren ähnlich (ergänzende Tabelle 1).
Klinische Merkmale von RLS-Patienten mit IDNA im Vergleich zu IDA
Die IDA-Gruppe hatte stärker gestörte Serum-Eisenstoffwechselparameter als die IDNA-Gruppe, einschließlich eines niedrigeren Ferritins (männlich, P < 0.05; weiblich, P < 0,0001), höhere Transferrin- (weiblich, P < 0,0001), niedrigere Eisen- (männlich, P < 0,05; weiblich, P < 0,0001), höhere TIBC- (weiblich, P < 0,0001) und niedrigere TSAT-Werte (männlich, P < 0,05; weiblich, P < 0,0001) im Serum (Abbildung 1, Tabelle 3). IDNA RLS hatte eine längere Krankheitsdauer (P < 0,01 bei Männern, P < 0,05 bei Frauen) und ein jüngeres Alter bei Beginn (nur signifikant bei Männern mit P < 0,05) als IDA RLS. Hinsichtlich der positiven Familienanamnese, des Schweregrads (IRLSRS), der Lateralität, der Lokalisation und der saisonalen Fluktuation des RLS gab es keine Unterschiede zwischen IDNA RLS und IDA RLS, weder bei Männern noch bei Frauen (Tabelle 2). Die Ergebnisse waren ähnlich, wenn man RLS-Patienten mit RLS-Medikamenten ausschloss (ergänzende Tabelle 1).
Hämatologische Merkmale bei Kontrollpersonen
Die diagnostischen Kriterien für Eisenmangel unterscheiden sich zwischen der Allgemeinbevölkerung und RLS-Patienten (siehe Diskussion unten). Gemäß dem Cut-off-Wert unseres Krankenhauses für Eisenmangel in der Allgemeinbevölkerung (20 μg/L) stellten wir fest, dass keiner der männlichen Probanden in der Kontrollgruppe Eisenmangel hatte, während vier weibliche Kontrollpersonen Eisenmangel aufwiesen (zwei Probanden mit Serumferritin <20 μg/L und zwei Probanden mit Ferritin ≥ 20 μg/L, aber TSAT <20%). Es gab keinen signifikanten Unterschied in der Prävalenz des Eisenmangels bei den Kontrollen zwischen Männern (0%, 0/22) und Frauen (9,8%, 4/41; P = 0,288). Die hämatologischen Tests zu Hämoglobin und Eisenparametern in der Kontrollgruppe waren der NID-RLS-Gruppe im Vergleich zur IDNA- oder IDA-Gruppe am ähnlichsten (Abbildung 1, Tabelle 3).
Diskussion
Die Pathophysiologie des primären und sekundären RLS ist nur unvollständig verstanden. Eisenmangel im Gehirn spielt eine grundlegende Rolle in der Pathogenese des RLS, und Bedingungen, die durch systemischen Eisenmangel gekennzeichnet sind, wie Anämie und Schwangerschaft, sind mit einer höheren Prävalenz von RLS-Symptomen verbunden (2, 3, 5, 6). IDA ist eine anerkannte Komorbidität im Zusammenhang mit sekundärem RLS (4-6, 12). IDNA ist schleichender, und ihre Merkmale sind bei RLS-Patienten weniger bekannt.
Klinische Merkmale von IDNA bei RLS
Im Allgemeinen sind Frauen anfälliger für RLS (1, 13, 14). Frauen im gebärfähigen Alter weisen zudem einen höheren Eisenmangel auf als Männer in der Allgemeinbevölkerung (15). In dieser Studie über RLS-Patienten ohne Anämie fanden wir ebenfalls eine signifikante geschlechtsspezifische Diskriminierung. Weibliche RLS-Patienten haben ein wesentlich höheres Risiko für IDNA als männliche RLS-Patienten (relatives Risiko von 5,51, p < 0,0001). Weniger männliche RLS-Patienten litten an Eisenmangel, entweder mit oder ohne Anämie. Bei den Kontrollen fanden wir, wenn auch ohne statistische Signifikanz, dass 9,8 % der weiblichen Probanden an Eisenmangel litten, während dies bei keinem der männlichen Probanden der Fall war. Wenn also männliche RLS-Patienten an Eisenmangel leiden, sollten zusätzliche Untersuchungen durchgeführt werden, um sekundäre Ursachen wie chronische Blutungen und Unterernährung aufgrund von Magen-Darm-Erkrankungen auszuschließen.
Im Vergleich zur „normalen“ NID-RLS-Gruppe wies die IDNA-RLS-Gruppe bei Frauen ein früheres RLS-Eintrittsalter und ein jüngeres Alter bei der Befragung auf, nicht jedoch bei Männern (Tabelle 2). In einer früheren Studie stellten wir fest, dass bei früh einsetzendem RLS eine positivere RLS-Familienanamnese und stärker gestörte periphere Eisenparameter (niedrigeres Serumferritin und höhere Serumtransferrin- und TIBC-Werte) im Vergleich zu spät einsetzendem RLS vorlagen (8). Kürzlich haben wir festgestellt, dass IDNA bei RLS im Vergleich zu NID bei RLS einige genetische Faktoren vorhersagt (unveröffentlichte Daten). Ein möglicher Subtyp in Verbindung mit dem genetischen Hintergrund, Eisenmangel und früh einsetzendem RLS verdient weitere Untersuchungen. Müdigkeit, Schwäche, Konzentrationsschwierigkeiten, Gedächtnisschwäche und schlechte Arbeitsleistung sind unspezifische Symptome, die häufig mit Eisenmangel in Verbindung gebracht werden (7, 16). Allen et al. (6) berichteten zuvor, dass IDA-Patienten mit RLS im Vergleich zu IDA-Patienten ohne RLS mehr Müdigkeit, eine schlechtere Schlafqualität und eine geringere Tagesenergie aufweisen. Wir fanden heraus, dass RLS-Patienten mit IDNA im Vergleich zu RLS-Patienten mit NID auch häufiger unter Manifestationen von schwerer/sehr schwerer Müdigkeit oder Schläfrigkeit während des Tages aufgrund von RLS litten (Cut-off-Punkt bei 75 μg/L, 32,5 vs. 17,7 %, P < 0,05, Tabelle 2). Bei einer erneuten Analyse nur der RLS-Patienten ohne Medikamente zeigte sich bei den IDNA-RLS-Patienten immer noch ein Trend zu einer höheren Anfälligkeit für schwere/sehr schwere Tagesmüdigkeit oder Schläfrigkeit, auch wenn dieser keine statistische Signifikanz erreichte (35 vs. 18,8 %, P = 0,078, ergänzende Tabelle 1). Zwischen IDNA RLS und IDA RLS wurde in dieser Studie kein Unterschied hinsichtlich schwerer/sehr schwerer Tagesmüdigkeit oder Schläfrigkeit festgestellt (Tabelle 2). Ein verminderter Eisenspeicher auf einem Kontinuum von IDA bis IDNA wird mit einer verminderten Aktivität eisenabhängiger Enzyme, einer reduzierten zellulären oxidativen Kapazität sowie einer verminderten Energieeffizienz in Verbindung gebracht (17-19). Bei Verwendung einer strengeren Definition für IDNA (Serumferritin-Cut-off-Wert von 50 μg/L) fanden wir immer noch mehr IDNA-RLS-Patienten, die unter schwerer/sehr schwerer Müdigkeit oder Schläfrigkeit während des Tages litten, als NID-RLS-Patienten (32,3 vs. 19,8 %), allerdings war dies nicht signifikant (P > 0,05; ergänzende Tabelle 2). Periodische Beinbewegungen im Schlaf (PLMS) stehen in engem Zusammenhang mit RLS, und ein Locus im BTBD9-Gen ist mit dem Risiko sowohl für PLMS als auch für RLS korreliert (20, 21). Bemerkenswert ist, dass wir nur die Schlafqualität mit Hilfe des IRLSRS-Unterpunkts 4 bewertet haben und keine detaillierte Bewertung des Schlafstatus mit Hilfe der Polysomnographie (PSG) durchgeführt haben. Folglich standen keine Daten zu PLMS und anderen schlafbezogenen Parametern zur Verfügung, die möglicherweise wesentlich zur Tagesmüdigkeit oder Schläfrigkeit beitragen. Daher muss der Zusammenhang zwischen Tagesmüdigkeit/Schläfrigkeit und IDNA weiter untersucht werden. Wir fanden keinen signifikanten Unterschied im Schweregrad des RLS zwischen der IDNA- und der NID-Gruppe. Peripherer Eisenmangel erhöht in früheren klinischen Studien das Risiko für die Prävalenz von RLS (6). Reduzierte Eisenkonzentrationen im Serum verringern global den Eisenspiegel im Gehirn, und eine Eisenbehandlung kommt RLS-Patienten mit niedrigen peripheren Eisenspiegeln zugute (10). Dennoch weisen zahlreiche RLS-Patienten ohne systemischen Eisenmangel ein hirnspezifisches Defizit an Eisen auf (22). Studien an Nagetieren haben gezeigt, dass der Serumeisenstatus nicht mit den regionalen Eisenspiegeln im Gehirn korreliert und daher nur begrenzt mit den Merkmalen des RLS in Verbindung gebracht werden kann (23, 24).
Ist IDNA ein Frühstadium vor IDA bei RLS?
Eisenmangel kann je nach Hämoglobinmesswert in zwei Stufen, IDNA und IDA, eingeteilt werden. In dieser Studie hatten RLS-Patienten mit IDA die niedrigsten Hämoglobin-, Ferritin- und Eisenwerte sowie die höchsten Transferrin- und TIBC-Werte im Vergleich zu IDNA RLS und NID RLS (Abbildung 1, Tabelle 3). Obwohl es bei den Hämoglobinwerten keine signifikanten Unterschiede zwischen IDNA RLS und NID RLS gab (sowohl bei männlichen als auch bei weiblichen RLS-Patienten), war das Serumhämoglobin bei IDNA RLS-Patienten im Vergleich zu den Kontrollen niedriger (nur bei Frauen, P < 0,05, Abbildung 1, Tabelle 3). Darüber hinaus lagen die Werte der Eisenparameter in der IDNA-RLS-Gruppe zwischen denen der NID-RLS- oder der Kontrollgruppe und der IDA-RLS-Gruppe (Abbildung 1, Tabelle 3). Diese Ergebnisse stimmen mit dem Standpunkt überein, dass IDNA ein milderer Eisenmangel vor der Entwicklung einer Anämie ist. Es ist zu beachten, dass die Serumeisenparameter den peripheren Eisenstatus hauptsächlich in den Erythronen widerspiegeln (25), während die Eisenspeicherung in anderen Organen (wie Leber, Gehirn usw.) bei IDNA-Patienten validiert werden muss.
Dennoch sind die Ursachen und Merkmale von IDNA-RLS und IDA-RLS nicht völlig ähnlich. In dieser Studie wiesen die meisten RLS-Patienten mit IDA bemerkenswerte Komorbiditäten auf, die mit Unterernährung oder chronisch übermäßigem Blutverlust einhergingen, einschließlich Blutungen im Verdauungstrakt, Hämorrhoidenblutungen und Menorrhagie (Tabelle 1), was mit der früheren Studie (12) übereinstimmt. Es ist erwähnenswert, dass Menorrhagie eine häufige Ursache für IDA bei Frauen im reproduktiven Alter ist, die eine Folge von Uterusmyomen, Adenomyose und anderen gynäkologischen Erkrankungen sein kann. Eine Unterernährung kann sekundär zu gastrointestinalen Störungen, vegetarischer Ernährung und falschen Vorstellungen vom eigenen Körperbild bei jungen Frauen auftreten. Daher handelt es sich bei der Mehrheit der IDA-RLS-Patienten in dieser Studie um „absoluten Eisenmangel“. Im Gegensatz dazu weisen RLS-Patienten mit IDNA in der Regel keine nennenswerten Komorbiditäten auf. Die Ursachen für IDNA-RLS sind schleichend, und IDNA bei RLS gehört im Allgemeinen in den Bereich des primären RLS (4), das mit „funktionellem Eisenmangel“ assoziiert ist. Allerdings können wir bei IDNA-RLS-Patienten heimtückische sekundäre Ursachen nicht ausschließen, die zu einer unzureichenden Eisenversorgung im Körper führen können.
Im Vergleich zu RLS mit IDNA hatten Patienten mit IDA ein älteres Alter bei Beginn des RLS sowie eine kürzere Dauer des RLS sowohl bei Männern als auch bei Frauen (signifikanter bei Männern; Tabelle 2), was mit dem Standpunkt übereinstimmt, dass sekundäres RLS in der Regel ein älteres Anfangsalter hat (26). Nach unserer Erfahrung weisen diese IDA-RLS-Patienten mit nennenswerten Ursachen (wie akutem Blutverlust) in der Regel eine kürzere Krankheitsdauer und eine schnellere Erholung oder Linderung auf, wenn behandelbare komorbide Störungen korrigiert und der Eisenstatus wiederhergestellt werden. Sie benötigen in der Regel keine langfristige RLS-Therapie, was sich von primären RLS-Patienten etwas unterscheidet. Künftige Längsschnittstudien sind notwendig, um die Behandlungseffekte von Eisenpräparaten bei RLS-Patienten mit IDA zu bestätigen. Andere Studien zum komorbiden RLS in der Schwangerschaft (27) und bei Urämie (28) berichteten über eine Besserung nach der Entbindung und Nierentransplantation, was darauf hindeutet, dass Veränderungen bei assoziierten Stoffwechselfaktoren das RLS bei empfänglichen Personen auslösen können (5).
Daher gibt es sowohl beim IDA-RLS als auch beim IDNA-RLS Heterogenität. Obwohl IDNA im Allgemeinen als ein frühes Stadium vor einer Anämie angesehen wird (7), ist IDNA RLS möglicherweise nicht einfach ein Prodromalstadium vor IDA RLS.
Zugang und Diagnose von IDNA bei RLS
Obwohl die Knochenmarksbiopsie als bester Indikator für den Eisenstatus gilt, wird sie aufgrund potenzieller Infektions- oder Blutungsrisiken an der Biopsiestelle nur selten durchgeführt (29). Der am häufigsten verwendete Laborindikator für den Eisenstatus ist das Ferritin, das entweder die Eisenspeicher im Gewebe oder die ausreichende Menge an Eisen widerspiegelt, das für die Erythropoese zur Verfügung steht (30). Obwohl das Serumferritin ein empfindlicher Marker für die Bewertung des Gesamteisenspeichers im Körper ist, können andere Bedingungen wie der Entzündungsstatus, das Alter und die Nierenfunktion den Serumferritinspiegel erhöhen (31). Ferritin und Transferrin sind auch Akute-Phase-Reaktanten, und unter entzündlichen Bedingungen kann der Ferritinspiegel erhöht und der Transferrinspiegel verringert sein (32). Daher kann selbst bei einem Serumferritinwert von ≥ 75 μg/L und einem TSAT-Wert von <20 % ein tatsächlicher Eisenmangel vorliegen (11, 33).
Ein Grenzwert für die Serumferritinkonzentration von <30 μg/L ist am empfindlichsten und spezifischsten für die Erkennung eines potenziellen Eisenmangels in der Allgemeinbevölkerung (17, 18), und IDNA wird als normaler Hämoglobinwert mit erniedrigtem Serumferritinwert (<20 μg/L) eingestuft (34, 35). Klinische Labors setzen die untere Grenze des Referenzbereichs für Serumferritin in der Regel auf 10-20 μg/L in der Allgemeinbevölkerung fest (36) (in unserem Krankenhaus liegt die untere Grenze bei 20 μg/L). Deutlich höhere Schwellenwerte für Serumferritin werden in der Regel zur Definition von Eisenmangel bei chronischen Erkrankungen wie Herzinsuffizienz und chronischen Nierenerkrankungen verwendet (7, 17). Die Beurteilungskriterien für die Definition von Eisenmangel bei RLS unterscheiden sich ebenfalls von denen gesunder Kontrollpersonen, obwohl der genaue Grenzwert für Ferritin zur Bestimmung von IDNA bei RLS noch keine Einigkeit erzielt hat. Neuere Studien legen nahe, dass RLS-Patienten als eisenarm gelten sollten, wenn ihre Ferritin-Konzentration unter 75 μg/L liegt (10, 11, 27). In früheren Studien wurde jedoch meist eine Ferritinkonzentration unter 50 μg/L als „niedriger Eisenstatus“ bei RLS definiert (37, 38). Da keine Daten über Beschreibungen verschiedener Grenzwerte vorliegen, verglichen wir die Merkmale von IDNA RLS und NID RLS, indem wir sowohl 75 als auch 50 μg/L als Grenzwerte für Ferritin für Eisenmangel verwendeten. Wir fanden heraus, dass bei Verwendung von 50 μg/L als unterer Grenzwert für Ferritin 33,2 % (65/196) der RLS-Patienten die Kriterien der IDNA erfüllen. Die Ergebnisse waren für die beiden verwendeten Schwellenwerte recht ähnlich, mit der Ausnahme, dass die erhöhte schwere/sehr schwere Müdigkeit oder Schläfrigkeit während des Tages bei IDNA RLS im Vergleich zu NID RLS nicht signifikant war, wenn der Grenzwert für Ferritin auf 50 μg/L festgelegt wurde (Tabelle 2, ergänzende Tabelle 2).
Unsere Studie hatte einige Einschränkungen: Erstens handelte es sich um eine Querschnittsstudie, und das Fehlen von Längsschnittdaten machte es schwierig, die Entwicklung der RLS-Symptome und die Auswirkungen der Behandlung zu ermitteln. Darüber hinaus könnte es einen Recall-Bias geben. Zweitens handelte es sich um eine Studie an einem einzigen Zentrum, da etwa ein Viertel der Patienten aus Shanghai stammte und die Mehrheit der Patienten aus Ostchina kam. In Anbetracht des riesigen Gebietes in China und möglicher verschiedener Umweltfaktoren kann es zu einer Verzerrung der Auswahl kommen. Drittens haben wir keine PSG-Messungen durchgeführt, um den Schlafstatus von RLS-Patienten und Kontrollpersonen detailliert zu untersuchen. Viertens erhielt etwa ein Drittel der RLS-Patienten in dieser Studie eine Therapie mit Dopaminergika und/oder Gabapentin enacarbil (nur ein Patient erhielt eine Eisenergänzungstherapie), was die klinischen Merkmale beeinflussen könnte. Wir haben jedoch alle Daten bei RLS-Patienten ohne Medikamente neu berechnet und sind zu demselben Ergebnis gekommen. Abgesehen davon hat unsere Studie einige Vorteile. Wir haben das klinische Spektrum des RLS eingehend untersucht und andere Komorbiditäten oder RLS-Mimiken ausgeschlossen. Wir haben jeden Patienten persönlich befragt und die atypischen RLS-Patienten bei der Nachuntersuchung sorgfältig ausgeschlossen. Da es nur wenige Studien zu den Merkmalen von IDNA bei RLS gibt, untersuchten wir die detaillierten klinischen Merkmale von IDNA bei konsekutiven chinesischen RLS-Patienten.
Schlussfolgerung
IDNA ist bei Patienten mit RLS häufig, insbesondere bei Frauen, und weist einige besondere klinische Merkmale auf. IDNA war im Vergleich zu NID bei weiblichen RLS-Patienten sowohl bei der Befragung als auch beim Auftreten des RLS jünger. IDNA ist bei männlichen RLS-Patienten nicht sehr häufig und Männer mit Eisenmangel sollten auf komorbide Störungen untersucht werden. Die Merkmale von RLS-Patienten mit IDNA unterscheiden sich von RLS mit IDA. RLS mit IDNA stellt ein wichtiges und übersehenes Problem der öffentlichen Gesundheit dar, das mehr klinische Aufmerksamkeit verdient und in der Behandlungsstrategie berücksichtigt werden sollte. Ein regelmäßiges Screening der peripheren Eisenparameter selbst bei Patienten mit normalem Blutbild wird für eine rechtzeitige angemessene Therapie empfohlen.
Datenverfügbarkeitserklärung
Die für diese Studie generierten Datensätze sind auf Anfrage beim entsprechenden Autor erhältlich.
Ethikerklärung
Die Studien mit menschlichen Teilnehmern wurden vom Shanghai General Hospital Institutional Review Board geprüft und genehmigt. Die Patienten/Teilnehmer gaben ihre schriftliche Einwilligung zur Teilnahme an dieser Studie.
Beiträge der Autoren
X-YZ: Konzeption/Design/Durchführung des Projekts/Erstellung des Manuskripts. T-TW: Durchführung des Projekts/Sammlung und Interpretation der Daten/Abfassung des Manuskripts. H-MW und JS: Labormessungen. XL, L-YN, T-JC und M-YQ: Durchführung des Projekts/Erhebung und Auswertung der Daten. TL und WO: Kritische Überarbeitung des Manuskripts auf wichtigen intellektuellen Inhalt. Y-CW: Konzeption/Design/Betreuung des Projekts, kritische Überarbeitung des Manuskripts für wichtigen geistigen Inhalt. Alle Autoren: Manuskriptvorbereitung.
Finanzierung
Diese Arbeit wurde von der Shanghai Municipal Planning Commission of Science and Research Fund (201740017), dem Clinical Research Innovation Plan of Shanghai General Hospital (CTCCR-2018C02), dem Interdisciplinary Program of Shanghai Jiao Tong University (YG2015QN21) und der National Natural Science Foundation of China (No. 81671251).
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir danken allen Patienten und gesunden Kontrollpersonen, die an dieser Studie teilgenommen haben. Wir danken den Mitarbeitern des Zentrums für körperliche Untersuchungen im Shanghai General Hospital. Wir danken auch der Abteilung für Bioinformatik und Biostatistik, School of Life Sciences and Biotechnology, Shanghai Jiao Tong University, Yue Zhang für die statistische Beratung.
Ergänzendes Material
Das ergänzende Material zu diesem Artikel finden Sie online unter: https://www.frontiersin.org/articles/10.3389/fneur.2020.00298/full#supplementary-material
Abkürzungen
CI, Konfidenzintervall; IRLSSG, International Restless Legs Study Group; MMSE, Mini-Mental State Examination; NID, ohne Eisenmangel; RLS, Restless Legs Syndrom; IDA, Eisenmangelanämie; IDNA, Eisenmangel ohne Anämie; IRLSRS, International Restless Legs Syndrome Rating Scale; TIBC, Gesamteisenbindungskapazität; TSAT, Transferrinsättigung.
1. Allen RP, Picchietti DL, Garcia-Borreguero D, Ondo WG, Walters AS, Winkelman JW, et al. Restless legs syndrome/Willis-Ekbom disease diagnostic criteria: updated International Restless Legs Syndrome Study Group (RLSSG) consensus criteria-history, rationale, description, and significance. Sleep Med. (2014) 15:860-73. doi: 10.1016/j.sleep.2014.03.025
CrossRef Full Text | Google Scholar
2. Connor JR, Boyer PJ, Menzies SL, Dellinger B, Allen RP, Ondo WG, et al. Neuropathologische Untersuchung deutet auf gestörte Eisenaufnahme im Gehirn beim Restless-Legs-Syndrom hin. Neurology. (2003) 61:304-9. doi: 10.1212/01.WNL.0000078887.16593.12
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Allen RP, Earley CJ. Die Rolle von Eisen beim Restless-Legs-Syndrom. Mov Disord. (2007) 18(22 Suppl):S440-8. doi: 10.1002/mds.21607
CrossRef Full Text | Google Scholar
4. Trenkwalder C, Allen R, Hogl B, Clemens S, Patton S, Schormair B, et al. Comorbidities, treatment, and pathophysiology in restless legs syndrome. Lancet Neurol. (2018) 17:994-1005. doi: 10.1016/S1474-4422(18)30311-9
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Trenkwalder C, Allen R, Hogl B, Paulus W, Winkelmann J. Restless legs syndrome associated with major diseases: a systematic review and new concept. Neurology. (2016) 86:1336-43. doi: 10.1212/WNL.0000000000002542
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Allen RP, Auerbach S, Bahrain H, Auerbach M, Earley CJ. Die Prävalenz und die Auswirkungen des Restless-Legs-Syndroms bei Patienten mit Eisenmangelanämie. Am J Hematol. (2013) 88:261-4. doi: 10.1002/ajh.23397
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Soppi ET. Eisenmangel ohne Anämie – eine klinische Herausforderung. Clin Case Rep. (2018) 6:1082-6. doi: 10.1002/ccr3.1529
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Zhu XY, Wu TT, Wang HM, Ni LY, Li X, Liu Y, et al. Clinical features and subtypes of restless legs syndrome in Chinese population: a study of 359 patients. Sleep Med. (2019) 59:15-23. doi: 10.1016/j.sleep.2019.01.053
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP, et al. International Restless Legs Syndrome Study, Validation of the International Restless Legs Syndrome Study Group rating scale for restless legs syndrome. Sleep Med. (2003) 4:121-32. doi: 10.1016/S1389-9457(02)00258-7
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. International Restless Legs Syndrome Study, Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report. Sleep Med. (2018) 41:27-44. doi: 10.1016/j.sleep.2017.11.1126
CrossRef Full Text | Google Scholar
11. Trenkwalder C, Winkelmann J, Oertel W, Virgin G, Roubert B, Mezzacasa A, et al. Ferric carboxymaltose in patients with restless legs syndrome and nonanemic iron deficiency: a randomized trial. Mov Disord. (2017) 32:1478-82. doi: 10.1002/mds.27040
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Mehmood T, Auerbach M, Earley CJ, Allen RP. Reaktion auf intravenöses Eisen bei Patienten mit Eisenmangelanämie (IDA) und Restless-Leg-Syndrom (Willis-Ekbom-Krankheit). Sleep Med. (2014) 15:1473-6. doi: 10.1016/j.sleep.2014.08.012
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Thomas K, Watson CB. Restless legs syndrome in women: a review. J Womens Health. (2008) 17:859-68. doi: 10.1089/jwh.2007.0515
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Ohayon MM, O’Hara R, Vitiello MV. Epidemiologie des Restless-Legs-Syndroms: eine Synthese der Literatur. Sleep Med Rev. (2012) 16:283-95. doi: 10.1016/j.smrv.2011.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Umbreit J. Iron deficiency: a concise review. Am J Hematol. (2005) 78:225-31. doi: 10.1002/ajh.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Sawada T, Konomi A, Yokoi K. Iron deficiency without anemia is associated with anger and fatigue in young Japanese women. Biol Trace Elem Res. (2014) 159:22-31. doi: 10.1007/s12011-014-9963-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Camaschella C. Iron-deficiency anemia. N Engl J Med. (2015) 372:1832-43. doi: 10.1056/NEJMra1401038
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Iron deficiency anaemia. Lancet. (2016) 387:907-16. doi: 10.1016/S0140-6736(15)60865-0
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Haas JD, Brownlie T. Iron deficiency reduced work capacity: a critical review of the research to determine a causal relationship. J Nutr. (2001) 131:676S-88S; discussion 688S-90S. doi: 10.1093/jn/131.2.676S
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Stefansson H, Rye DB, Hicks A, Petursson H, Ingason A, Thorgeirsson TE, et al. A genetic risk factor for periodic limb movements in sleep. N Engl J Med. (2007) 357:639-47. doi: 10.1056/NEJMoa072743
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Li G, Tang H, Wang C, Qi X, Chen J, Chen S, et al. Association of BTBD9 and MAP2K5/SKOR1 with restless legs syndrome in Chinese population. Sleep. (2017) 40:zsx028. doi: 10.1093/sleep/zsx028
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Earley CJ, Connor J, Garcia-Borreguero D, Jenner P, Winkelman J, Zee PC, et al. Altered brain iron homeostasis and dopaminergic function in Restless Legs Syndrome (Willis-Ekbom Disease). Sleep Med. (2014) 15:1288-301. doi: 10.1016/j.sleep.2014.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Erikson KM, Pinero DJ, Connor JR, Beard JL. Regionale Eisen-, Ferritin- und Transferrinkonzentrationen im Gehirn während Eisenmangel und Eisenauffüllung bei sich entwickelnden Ratten. J Nutr. (1997) 127:2030-8. doi: 10.1093/jn/127.10.2030
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Yin L, Unger EL, Jellen LC, Earley CJ, Allen RP, Tomaszewicz A, et al. Systems genetic analysis of multivariate response to iron deficiency in mice. Am J Physiol Regul Integr Comp Physiol. (2012) 302:R1282-96. doi: 10.1152/ajpregu.00634.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hallberg L, Hulthen L. Perspectives on iron absorption. Blood Cells Mol Dis. (2002) 29:562-73. doi: 10.1006/bcmd.2002.0603
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Shukla G, Gupta A, Pandey RM, Kalaivani M, Goyal V, Srivastava A, et al. What features differentiate unilateral from bilateral restless legs syndrome? Eine vergleichende Beobachtungsstudie mit 195 Patienten. Sleep Med. (2014) 15:714-9. doi: 10.1016/j.sleep.2014.01.025
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Picchietti DL, Hensley JG, Bainbridge JL, Lee KA, Manconi M, McGregor JA, et al. International Restless Legs Syndrome Study, Consensus clinical practice guidelines for the diagnosis and treatment of restless legs syndrome/Willis-Ekbom disease during pregnancy and lactation. Sleep Med Rev. (2015) 22:64-77. doi: 10.1016/j.smrv.2014.10.009
CrossRef Full Text | Google Scholar
28. Winkelmann J, Stautner A, Samtleben W, Trenkwalder C. Langfristiger Verlauf des Restless-Legs-Syndroms bei Dialysepatienten nach Nierentransplantation. Mov Disord. (2002) 17:1072-6. doi: 10.1002/mds.10231
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Bain BJ. Morbidität der Knochenmarksbiopsie: Rückblick auf 2003. J Clin Pathol. (2005) 58:406-8. doi: 10.1136/jcp.2004.022178
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Baynes RD. Assessment of iron status. Clin Biochem. (1996) 29:209-15. doi: 10.1016/0009-9120(96)00010-K
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Wish JB. Bewertung des Eisenstatus: über Serumferritin und Transferrinsättigung hinaus. Clin J Am Soc Nephrol. (2006) 1(1 Suppl):S4-8. doi: 10.2215/CJN.01490506
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Tietz NW, Rinker AD, Morrison SR. Wann ist ein Serumeisen wirklich ein Serumeisen? Der Status von Serumeisenmessungen. Clin Chem. (1994) 40:546-1. doi: 10.1093/clinchem/40.4.546
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Mackie S, Winkelman JW. Normales Ferritin bei einem Patienten mit Eisenmangel und RLS. J Clin Sleep Med. (2013) 9:511-3. doi: 10.5664/jcsm.2680
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Vergleich von zwei Dosierungen von elementarem Eisen bei der Behandlung von latentem Eisenmangel: Wirksamkeit, Nebenwirkungen und Verblindung. Nutrients. (2014) 6:1394-405. doi: 10.3390/nu6041394
PubMed Abstract | Querverweis Volltext | Google Scholar
35. D’Adamo CR, Novick JS, Feinberg TM, Dawson VJ, Miller LE. Ein Nahrungsergänzungsmittel mit einer niedrigen Eisendosis verbesserte die Marker des Eisenstatus bei Frauen mit nicht anämischem Eisenmangel. J Am Coll Nutr. (2018) 37:342-9. doi: 10.1080/07315724.2018.1427158
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Goodnough LT, Nemeth E, Ganz T. Detection, evaluation, and management of iron-restricted erythropoiesis. Blood. (2010) 116:4754-61. doi: 10.1182/blood-2010-05-286260
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Lee CS, Lee SD, Kang SH, Park HY, Yoon IY. Vergleich der Wirksamkeit von oralem Eisen und Pramipexol bei der Behandlung von Patienten mit Restless-Legs-Syndrom und niedrigem Serumferritin. Eur J Neurol. (2014) 21:260-6. doi: 10.1111/ene.12286
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Tilma J, Tilma K, Norregaard O, Ostergaard JR. Frühkindliches Restless-Legs-Syndrom: Symptome und Wirkung einer oralen Eisenbehandlung. Acta Paediatr. (2013) 102:e221-6. doi: 10.1111/apa.12173
PubMed Abstract | CrossRef Full Text | Google Scholar