- Introduction
- Materialien und Methoden
- Klinische Untersuchung der Patienten
- Ethische Standardprotokollgenehmigungen, Registrierung und Patienteneinwilligung
- Neurochirurgischer Eingriff
- Statistische Analyse
- Ergebnisse
- Patientenmerkmale und Symptome
- Symptome, klinische Zeichen und Befunde 1 Woche nach der Operation
- Symptome, klinische Zeichen und Befunde 3 Monate nach der Operation
- Diskussion
- Ethikerklärung
- Beiträge der Autoren
- Erklärung zu Interessenkonflikten
- Danksagung
- Förderung
- Ergänzendes Material
Introduction
Die Chiari-Malformation umfasst eine Gruppe von pathologischen Entitäten, die durch anatomische Deformationen des Kleinhirns und des Hirnstamms gekennzeichnet sind. Zu den typischen Symptomen gehören okzipitale Kopfschmerzen, die sich durch Husten verstärken, motorische und/oder sensorische Störungen, insbesondere der oberen Gliedmaßen, und Ungeschicklichkeit (1, 2).
Die derzeitige Behandlung umfasst eine Dekompression der subokzipitalen Region zur Vergrößerung des Durchmessers des Foramen magnum und eine Resektion des hinteren Bogens von C1. Es wurde jedoch viel kritisch diskutiert, ob man nicht auch die Arachnoidea eröffnen und die Kleinhirntonsillen entfernen sollte (3). Die postoperativen Risiken dieses Verfahrens scheinen höher zu sein, einschließlich Pseudomeningozele und Hygrombildung, Meningitis und Kopfschmerzen (2). Andererseits ist eine ausreichende Dekompression des Hirnstamms wahrscheinlicher, wenn die Arachnoidea und die Tonsillen manipuliert werden (1, 4) (Einzelheiten in Datenblatt S1 im ergänzenden Material). Die Daten über das klinische Ergebnis nach der chirurgischen Behandlung variieren aufgrund der unterschiedlichen Operationsmethoden, Patientenkohorten und Symptome. Klinische Verbesserungen und Verbesserungen im täglichen Leben wurden in verschiedenen Studien bei 50-75 % der Patienten beschrieben (2, 3). Augenmotorische Störungen verbesserten sich bei 75-100% der Patienten (5-7).
Erfahrungen mit Kleinhirnläsionen, z.B. durch ischämische Infarkte, lehren uns, dass Tonsillenläsionen zu erheblichen okulomotorischen Defiziten führen können, die Schwindel verursachen (8). Die Auswirkungen einer unilateralen Tonsillektomie auf die Augenmotorik und die Kleinhirnfunktion sind jedoch noch nicht systematisch untersucht worden. Das Hauptziel unserer Studie war es, zu untersuchen, ob das chirurgische Verfahren der subokzipitalen Dekompression, einschließlich der Verkleinerung einer Kleinhirntonsille, zu okulomotorischen, vestibulären oder zerebellären Defiziten bei Patienten mit Chiari-Malformation Typ I führt.
Materialien und Methoden
Klinische Untersuchung der Patienten
Für diese Studie wurden vierzehn konsekutive Patienten mit radiologischem Nachweis einer Chiari-Malformation Typ 1 in den Abteilungen für Neurologie und Neurochirurgie des Universitätsklinikums München untersucht. Drei Patienten hatten leichte klinische Anzeichen und wurden konservativ behandelt. Elf Patienten unterzogen sich einem chirurgischen Eingriff mit Resektion oder Reduktion einer Kleinhirntonsille und wurden in die Studie aufgenommen. Ein Patient wurde nicht in die Studie aufgenommen.
Die Patienten wurden vor und zu zwei Zeitpunkten nach dem chirurgischen Eingriff untersucht: einmal direkt nach dem Eingriff und einmal bei der Nachuntersuchung etwa drei Monate nach der Operation. Die Patienten erhielten einen standardisierten Fragebogen zu typischen Beschwerden. Die Patienten wurden nach Kopf- oder Nackenschmerzen (Art und auslösende Faktoren), Gangunsicherheit, Schwindel oder Benommenheit (Art und auslösende Faktoren), Sehproblemen, audiologischen Problemen, motorischen Anzeichen, sensorischen Defiziten und Defiziten der unteren Hirnnerven gefragt.
Die Untersuchung bestand aus einer standardisierten neurologischen, neuro-ophthalmologischen und neuro-otologischen Untersuchung. Dazu gehörten der Head-Thrust-Test, die Untersuchung auf Spontannystagmus mit der Frenzel-Brille in der Primärposition und bei Blickabweichung, Smooth Pursuit, Sakkaden, optokinetischer Nystagmus, visuelle Fixationsunterdrückung des vestibulo-okulären Reflexes (VOR), Kopfschüttelnystagmus und die Bestimmung der subjektiven visuellen Vertikale (SVV). Abweichungen über 2,5° wurden als pathologisch eingestuft (9). Die Funktion des Kleinhirns wurde anhand von Ataxie-Ratingskalen bewertet, nämlich der Skala zur Beurteilung und Bewertung von Ataxie (SARA) (10) und dem Funktionsindex für spinozerebelläre Ataxie (SCAFI) (11). Während der dreimonatigen Nachuntersuchung wurde die vestibuläre Funktion neurophysiologisch mit bithermischen kalorischen Tests mit dem EyeSeeCam System® (pathologische Seitendifferenz nach der Jongkee-Formel größer als 25 %) und luftgeleiteten zervikalen und knochengeleiteten okulären vestibulär-evozierten myogenen Potenzialen (c/oVEMP) mit dem Interacoustics Eclipse System® (12) untersucht. Das Asymmetrieverhältnis , sollte unter 35 % liegen (13). Die posturographischen Messungen wurden in aufrechter Position nach dem Standardprotokoll mit 10 verschiedenen Bedingungen mit steigendem Schwierigkeitsgrad durchgeführt (14). Die subjektive Verbesserung wurde durch eine Befragung gemessen. Die Patienten wurden zu allen Beschwerden zusammen befragt, ob sie 3 Monate nach der Intervention eine Verbesserung ihrer Symptome feststellen konnten. Die subjektive Beeinträchtigung in Bezug auf Schwindel und Benommenheit wurde mit dem Dizziness Handicap Inventory (DHI) gemessen (15, 16). Das DHI ist ein Selbstbewertungsinventar mit einem Mindestwert von 0 und einem Höchstwert von 100 (maximale Auswirkung des Schwindels auf das tägliche Leben). Der klinisch relevante Veränderungswert zwischen Vor- und Nachbehandlung beträgt in der Originalarbeit 18 (16). Bei allen Patienten wurde nach 3 Monaten eine routinemäßige postoperative MRT durchgeführt. Im Falle einer bestehenden Syrinx wurde die Größe (Länge und Durchmesser in Millimetern) gemessen und mit präoperativen MRT-Scans verglichen.
Ethische Standardprotokollgenehmigungen, Registrierung und Patienteneinwilligung
Diese Studie wurde in Übereinstimmung mit den Empfehlungen des Institutional Review Board der Ethikkommission der Ludwig-Maximilians-Universität München mit schriftlicher Einwilligung aller Probanden durchgeführt. Alle Probanden gaben ihre schriftliche Einwilligung nach Aufklärung gemäß der Deklaration von Helsinki. Das Protokoll wurde durch das Institutional Review Board der Ethikkommission der Ludwig-Maximilians-Universität München genehmigt. Die Indikation zum chirurgischen Eingriff wurde unabhängig von der Teilnahme an dieser Studie gestellt.
Neurochirurgischer Eingriff
Die Patienten wurden intraoperativ elektrophysiologisch auf untere Hirnnerven, motorisch evozierte Potentiale und somatosensorisch evozierte Potentiale überwacht, um eine zusätzliche Beeinflussung des Hirnstamms durch eine übertriebene Kopfneigung zu vermeiden. In Bauchlage wurde der Kopf des Patienten mit einer Mayfield-Klemme fixiert. Der chirurgische Eingriff bestand aus einer subokzipitalen medialen Dissektion des Halsmuskels, die den Bogen von C1 und das Hinterhaupt um das Foramen magnum freilegte. Zunächst wurde das Foramen magnum durch eine osteoklastische Kraniektomie von etwa 3 cm × 4 cm vergrößert, wobei die Breite an die Größe des Foramen magnum angepasst wurde. Anschließend wurde eine Laminektomie des C1-Bogens in der gleichen Breite des Wirbelkanals durchgeführt. Mittels intraoperativem Ultraschall konnten die Tonsillenspitzen sichtbar gemacht werden, um so weit wie nötig nach unten zu dekomprimieren. Manchmal war eine Laminotomie des oberen Randes des C2-Bogens erforderlich. Eine C2-Laminektomie wurde nie durchgeführt, um eine zervikale Instabilität zu vermeiden. Anschließend wurde die Dura Y-förmig eröffnet und mit dem Periost des Hinterhauptes vernäht. Nach sorgfältiger Dissektion der Arachnoidea wurden die längere und größere Kleinhirntonsille sowie der untere Hirnstamm und das Rückenmark identifiziert. Die identifizierte Tonsille wurde zunächst durch Koagulation der äußeren und medialen Oberfläche geschrumpft, ohne die intrakraniellen Gefäße zu beeinträchtigen. Die Pia der koagulierten Tonsille wurde inzidiert und das Tonsillengewebe durch sanftes Absaugen und bipolare Koagulation entfernt. Schließlich wurde die reduzierte Tonsille auf der Höhe des Foramen magnum abgelegt. Das mittlere Volumen des resezierten Tonsillengewebes lag zwischen 0,6 und 2,7 cm3 (Mittelwert 1,4 cm3, SD 0,6 cm3). Schließlich wurde die Region des Obex inspiziert, um einen freien Abfluss des zentralen Kanals innerhalb des Rückenmarks zu gewährleisten, soweit dies sicher möglich war. Zur weiteren Vergrößerung des kraniozervikalen Raumes wurde ein Duralersatz (Lyoplant®, B. Braun) implantiert und wasserdicht vernäht. Schließlich wurde die Wunde in mehreren Schichten, z. B. Muskeln, Faszien, Subkutis und Cutis, sorgfältig verschlossen, um ein Austreten von Liquor zu verhindern.
Statistische Analyse
Die statistische Analyse wurde mit SPSS Statistics 20 (IBM, Armonk, NY, USA) durchgeführt. Da die Daten nicht normalverteilt waren, wurden nichtparametrische gepaarte Tests mit dem Wilcoxon-Test für den Vergleich zweier verwandter Proben und dem Mann-Whitney-U-Test für Vergleiche zwischen den Gruppen durchgeführt. Unterschiede wurden als signifikant angesehen, wenn p < 0,05. Dieses Studiendesign war explorativ.
Ergebnisse
Patientenmerkmale und Symptome
Zehn Patienten mit einer durch MRT bestätigten Chiari-Malformation Typ 1 (6 Frauen, Durchschnittsalter 37 Jahre, Spanne 18-57) wurden in diese Studie aufgenommen. Die folgenden Werte sind Mittelwerte ± Standardabweichung. Die Teilnehmer wurden präoperativ (27 ± 48 Tage vor der Operation; Spanne 1 Tag-5 Monate, n = 10) und zu zwei Zeitpunkten nach dem chirurgischen Eingriff untersucht. Weitere Einzelheiten zu den klinischen Daten sind Tabelle 1 zu entnehmen. In unserer Kohorte betrug die mittlere Dauer der Symptome 4 ± 3 Jahre (Spanne 3 Monate-11 Jahre). Die Zeit zwischen dem Auftreten der Symptome und der korrekten Diagnose betrug 3 ± 3 Jahre (Bereich 3 Monate-10 Jahre). Im MRT wurde bei 70 % der Patienten eine Syringomyelie festgestellt. Die Tonsillenabweichung reichte von 0,7 bis 2,2 cm (Mittelwert 1,4 cm, SD 0,6 cm). Die Länge der Syringomyelie variierte zwischen einem und mehr als 10 Wirbelsäulensegmenten, die Größe zwischen 1,5 und 0,3 mm im maximalen Durchmesser. Abbildung 1 zeigt Patient Nummer vier mit einer signifikanten Syringomyelie aufgrund einer Chiari-Typ-I-Malformation prä- und postoperativ.
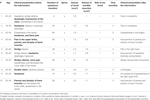
Tabelle 1. Klinische Präsentation und Verlauf nach chirurgischem Eingriff.
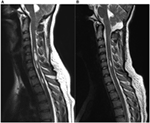
Abbildung 1. Syringomyelie aufgrund einer Chiari-Typ-I-Malformation vor (A) und 3 Monate nach (B) der chirurgischen Dekompression. (A) Diese 19-jährige Frau klagte über okzipitale Kopfschmerzen, Hypästhesie der oberen Extremitäten sowie Schwindelattacken. Präoperative sagittale T2-gewichtete MR-Bilder zeigen eine Tonsillensenkung bis zum unteren Rand des Bogens von C2 und eine signifikante mehrkompartimentale Syringomyelie im zervikalen Rückenmark. (B) Die postoperativen MR-Bilder zeigen deutlich eine deutliche Verkleinerung der vorbestehenden Syrinx sowie eine reduzierte Tonsillenlänge am Foramen magnum. Der Patient berichtete über eine bemerkenswerte Verbesserung der Symptome nach der chirurgischen Dekompression.
Die Hauptsymptome waren wiederkehrende Anfälle von Schwindel oder Benommenheit (60 %), Kopf- und Nackenschmerzen, die sich beim Husten und bei bestimmten Kopfbewegungen verschlimmerten (50 %), sowie Dys-/Hypästhesien in den oberen Extremitäten (50 %).
In Bezug auf die klinisch-neurologischen Merkmale waren die Hauptbefunde Ataxie in den oberen Gliedmaßen (Fingerbewegungsdysmetrie, Intentionstremor, Dysdiadochokinese) (6/10 Patienten) und Dys- und Hypästhesie (5/10 Patienten). Für weitere Einzelheiten der klinischen Untersuchung siehe Tabelle 2 (A).
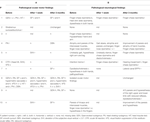
Tabelle 2. Augenmotorische (A) und neurologische Befunde (B) vor und nach dem chirurgischen Eingriff.
Bei der neuro-ophthalmologischen Untersuchung wiesen fünf Patienten auffällige okulomotorische Befunde auf, darunter Kopfschüttel-Nystagmus (n = 3), Blick-evozierter-Nystagmus, gestörte Fixationssuppression des VOR, pathologischer Kopfimpulstest (jeweils n = 2), Abweichung der SVV, Kopfneigung, hypermetrische Sakkaden, Rebound-Nystagmus, sakkadisches Smooth Pursuit und Downbeat-Nystagmus (DBN) (jeweils n = 1). Für weitere Informationen siehe Tabelle 2 (B).
Die Patienten wiesen bei den untersuchten Scores leichte zerebelläre Defizite auf. Der mittlere SARA-Gesamtscore betrug 0,6 ± 0,9 (der Score reicht von 0 = keine Ataxie bis 40 = schwere Ataxie). Der mittlere 8MW betrug 5,1 ± 0,5 s. Der 9-Hole-Peg-Test (9HPT) der dominanten Hand betrug 20,1 ± 2,2 s und der nicht-dominanten Hand 21,3 ± 2,6 s. Die mittlere PATA-Rate betrug 27,9 ± 3,9. Für weitere Informationen siehe Tabelle 3.

Tabelle 3. Bewertung der Kleinhirnfunktion anhand der Skala zur Beurteilung und Bewertung von Ataxie (SARA) und des Funktionsindexes für spinozerebelläre Ataxie (SCAFI) vor und nach dem chirurgischen Eingriff.
Neun von zehn Patienten wurden vor dem chirurgischen Eingriff kalorisch getestet, acht mit o/cVEMP. Sechs Patienten wiesen bei diesen Tests eine abnorme vestibuläre Funktion auf: Drei Patienten (Nr. 2, 3 und 7) hatten eine pathologische Seitendifferenz bei der kalorischen Prüfung, was auf ein Defizit in der Funktion des horizontalen Kanals hindeutet; drei weitere Patienten hatten eine pathologische o/cVEMP-Prüfung, was auf ein Defizit in der Otolithenfunktion hindeutet (Nr. 1, 9 und 10).
Der mittlere DHI betrug insgesamt 17 (Bereich 0-70), was auf eine leichte Behinderung hindeutet. Für weitere Informationen siehe Tabelle 4.

Tabelle 4. Vestibuläre Tests des horizontalen Kanals (kalorischer Test), der sakkulären und utriculären Funktion sowie der subjektiven Beeinträchtigung, gemessen mit dem Dizziness Handicap Inventory (DHI), vor und 3 Monate nach dem chirurgischen Eingriff.
Die Patienten hatten eine Tendenz zu schlechteren Leistungen in der Posturographie im Vergleich zu gesunden Kontrollen, die in anderen Studien in unserem Zentrum veröffentlicht wurden (17). Beim Stehen auf festem Boden zeigten neun von 10 Patienten ein Schwankungsmuster, das dem phobischen Lagerungsschwindel im künstlichen Netz ähnelte (14). Für weitere Informationen siehe Tabelle 5.

Table 5. Auszug der Posturographiedaten mit Gesamt- und Richtungsschwankung, Root Mean Square (RMS) sowie Fast Fourier Transformation (FFT) vor und nach dem chirurgischen Eingriff bei vier ausgewählten Untersuchungen.
Symptome, klinische Zeichen und Befunde 1 Woche nach der Operation
Die neuro-ophthalmologische Untersuchung ergab eine Abweichung des SVV nach rechts nach Resektion der linken Tonsille (Patient Nr. 5 5,2° und Patient Nr. 10 4,5°) und neue Smooth Pursuit Defizite (Nr. 1). Für weitere Informationen siehe Tabelle 2.
Symptome, klinische Zeichen und Befunde 3 Monate nach der Operation
Die ausreichende subokzipitale Dekompression führte bei 9/10 der Patienten in der Nachbeobachtung zu einer Verbesserung der Symptome (gemessen mit einer Befragung zu allen Symptomen vor dem Eingriff), ohne Einfluss auf die Seite der resezierten Tonsille. Zwei Patienten waren nach dem neurochirurgischen Eingriff beschwerdefrei (Nr. 1, 2). Bei sieben Patienten verbesserten sich die Symptome (Nr. 3-8, Nr. 10). Bei einem Patienten kam es zu schwerwiegenden Komplikationen aufgrund eines Liquoraustrittes und einer anschließenden Meningitis. Bei ihm war eine chirurgische Revision wegen eines Durallecks erforderlich, und die Symptome besserten sich langsam über mehrere Wochen (Nr. 9). Bei der Nachuntersuchung hatte er eine verbleibende leichte rechtsseitige Hemiparese. Bei allen anderen Patienten traten keine weiteren Komplikationen auf. Bei allen Patienten verringerte sich die Größe und Länge der vorher bestehenden Syringomyelie. Weitere Informationen finden Sie in den Tabellen 1 und 2 (B).
Neuro-ophthalmologisch verbesserten sich Kopfschüttelnystagmus, VOR, Augenneigungsreaktion und DBN bei allen betroffenen Patienten. Eine teilweise Verbesserung konnte beim blickinduzierten Nystagmus und der Fixationssuppression des VOR beobachtet werden.
Neue okulomotorische Störungen nach der Operation waren Smooth-Pursuit-Defizite (Nr. 1, 7, 9, 10), DBN (Nr. 4) und blick-evozierter Nystagmus und Rebound-Nystagmus (Nr. 9). Alle diese Patienten waren asymptomatisch. Bei Patient Nr. 9 mit schwerwiegenden postoperativen Komplikationen traten weitere neue vestibulozerebelläre Funktionsstörungen auf, darunter ein blickinduzierter Nystagmus, ein Rebound-Nystagmus, ein vertikales Smooth-Pursuit-Defizit und ein vestibuläres Defizit im kalorischen Test, und er berichtete über eine stärkere Beeinträchtigung im DHI. Weitere Informationen finden Sie in Tabelle 2 (A) und Tabelle 4.
Die beiden Patienten mit pathologischem cVEMP verbesserten sich, ebenso wie einer von drei Patienten mit abnormalen kalorischen Tests. Der mittlere DHI verbesserte sich nach dem chirurgischen Eingriff von 17 auf 6 (p = 0,273), insbesondere bei zwei Patienten (Nr. 2, 6), die eine deutliche Verbesserung der Beeinträchtigung durch Schwindel und Benommenheit aufwiesen. Weitere Ergebnisse siehe Tabelle 4.
Bei den posturographischen Messungen nach der Operation veränderte sich das Gesamtschwanken (und die RMS-Werte) nicht signifikant. Es gab kein typisches zerebelläres 3 Hz-Schwanken. Für weitere Informationen siehe Tabelle 5.
Diskussion
Die wichtigsten Ergebnisse dieser prospektiven Studie sind wie folgt.
Erstens wurden bei der präoperativen neuro-opthalmologischen Untersuchung bei 50 % der Patienten abnorme Befunde festgestellt, darunter Kopfschüttelnystagmus, Blick-Nystagmus, gestörte Fixationsunterdrückung des VOR, Abweichung des SVV, Kopfneigung, hypermetrische Sakkaden, Rebound-Nystagmus, sakkadisches Smooth Pursuit und DBN. 70 % der Patienten hatten eine abnorme vestibuläre Funktion: zwei Patienten hatten einen pathologischen Kopfimpulstest, der auf ein hochfrequentes Defizit des VOR hinwies, drei Patienten hatten einen pathologischen kalorischen Test, der die niederfrequente Funktion des VOR prüfte, und drei hatten eine abnorme Otolithenfunktion, die mit vestibulär-evozierten myogenen Potenzialen getestet wurde.
Die Patienten hatten nur leichte bis mäßige Kleinhirnzeichen (insbesondere Fingerlaufdysmetrie). Die klinischen Symptome unserer Chiari-Patienten ähnelten denen in anderen Studien (1, 2, 18), mit Ausnahme der stärkeren vestibulären Symptome, die frühere Ergebnisse unterstützen, dass die Erkennung in auf Neurootologie spezialisierten Abteilungen höher ist (6). In einer mehrjährigen Studie mit 77 Chiari-Patienten in einer spezialisierten Abteilung wiesen 55% der Patienten präoperative Auffälligkeiten in den Untersuchungen des okulomotorischen Systems auf, darunter horizontaler Spontannystagmus (27%), sakkadisches Smooth Pursuit (29%), positionell induzierter Nystagmus (21%), sakkadische Dysmetrie (10%) und DBN (7%) (18). Die große Anzahl von Patienten mit spontanem Horizontalnystagmus konnte durch unsere Daten nicht reproduziert werden, obwohl drei Patienten (39 %) einen horizontalen Kopfschüttelnystagmus aufwiesen, was darauf hindeutet, dass die Geschwindigkeitsspeicherung betroffen war.
Zweitens führte ein chirurgischer Eingriff einschließlich Tonsillektomie bei 9/10 der Patienten zu einer subjektiven und objektiven Verbesserung der Symptome. Feinmotorik und Gang, gemessen mit SCAFI, verbesserten sich deutlich. Beeinträchtigte vestibuläre Funktionen (horizontaler Kanal, sakkuläre und utriculäre Funktion) verbesserten sich bei fünf von sieben Patienten, deren Funktion vor der Operation beeinträchtigt war, insbesondere in Bezug auf die hochfrequente VOR-Funktion und die sakkuläre Otolithenfunktion. Die Störungen der Augenmotorik verbesserten sich bei allen betroffenen Patienten in Bezug auf den Kopfschüttelnystagmus, das VOR, die okuläre Kippreaktion und die DBN. Bei einigen Patienten konnte eine weitere Verbesserung in Bezug auf den blickinduzierten Nystagmus und die Fixationsunterdrückung des VOR beobachtet werden.
Die subjektive Verbesserung in unserer Serie übertrifft die von Fallserien und Übersichtsarbeiten, die im Allgemeinen eine Verbesserung von etwa 75 % zeigen (3). In einer Übersichtsarbeit über eine chirurgische Serie zwischen 1965 und 2013 wurde die Resektion der Tonsillen jedoch nur bei 27 % der Patienten mit subokzipitaler Dekompression beschrieben (3). In einer anderen Serie von 177 Patienten, die sich einer Operation an der hinteren Schädelgrube unterzogen, zeigten die 137 Patienten, bei denen eine Tonsillenresektion mit anschließender Vergrößerung der Subarachnoidalzisterne durchgeführt wurde, eine stärkere Verkleinerung der Syringomyelie und in der Folge eine größere Verbesserung ihrer Symptome (1). In einer anderen Beobachtungsstudie an 77 Patienten führte die Resektion der Tonsillen bei 100 % zu guten Ergebnissen im Vergleich zu 64,8 % bei Patienten, die nur eine Dekompression des Foramen magnum erhielten (4). In einer großen Serie von 371 Patienten, bei denen eine Dekompression der hinteren Schädelgrube ohne Tonsillenresektion durchgeführt wurde, wurde eine Verbesserung der präoperativen Symptome nur bei 73,6 % der Patienten beschrieben (19).
Die dritte neuro-ophthalmologische Untersuchung nach subokzipitaler Dekompression, einschließlich Tonsillenreduktion, ergab bei fünf Patienten neue, aber meist asymptomatische okulomotorische Defizite, darunter Defizite beim glatten Verfolgungsspiel, horizontal blickinduzierter Nystagmus, Rebound-Nystagmus und DBN. Die kontralaterale (zur Seite der Tonsillenverkleinerung) Abweichung des SVV war bei 20 % der Patienten vorübergehend und wurde bei der Nachuntersuchung wieder ausgeglichen. Frühere retrospektive Studien über vestibulo-okuläre Manifestationen bei Chiari-Malformation oder Syringomyelie zeigten eine bemerkenswerte Auflösung der okulomotorischen Störungen von 75-100 % nach Dekompression ohne Tonsillektomie (5-7). Das chirurgische Verfahren bestand in diesen Serien aus einer Dekompression des Foramen magnum und einer C1-Laminektomie einschließlich Duroplastie ohne Tonsillenresektion. Andererseits war die okulomotorische Untersuchung, die nicht von spezialisierten Neuro-Ophthalmologen durchgeführt wurde, nicht so detailliert und standardisiert wie in unserer Serie.
Bislang gab es keine Veröffentlichungen über okulomotorische, zerebelläre und vestibuläre Nebenwirkungen der subokzipitalen Dekompression mit einseitiger Verkleinerung der Kleinhirntonsille, die in neuroanatomischen Studien als ein wichtiger Teil des Vestibulocerebellums angesehen wird. Im Tierversuch führten chirurgische Läsionen des Flocculus und Paraflocculus zu einer Beeinträchtigung des Smooth Pursuit, des horizontal blickinduzierten Nystagmus, des Rebound-Nystagmus und der DBN (20).
In unserer Studie beschrieben wir neue okulomotorische Defizite nach subokzipitaler Dekompression mit Verkleinerung einer Kleinhirntonsille, einschließlich Defizite bei der glatten Verfolgung, horizontalem blickinduziertem Nystagmus, Rebound-Nystagmus und DBN sowie kontralateraler Abweichung des SVV. Wie beschrieben, stimmen diese Befunde mit Tierstudien überein. In einem Fallbericht über einen Patienten mit akutem isoliertem einseitigem Infarkt der Kleinhirntonsille wurden eine Beeinträchtigung der glatten Verfolgung, ein ipsilateraler Nystagmus, ein blickinduzierter Nystagmus und eine leichte kontralaterale Neigung des SVV festgestellt (8). Zusammenfassend zeigen unsere Ergebnisse, dass die menschlichen Tonsillen hauptsächlich zur glatten Verfolgung und zum Blickhalte-Netzwerk beitragen (8). Dies wird durch anatomische Konnektivitätsstudien gestützt, da der Paraflocculus hauptsächlich Input von den kontralateralen pontinen Kernen (21), dem kontralateralen Nucleus olivaris inferior und dem paramedianen Trakt erhält, was auf eine wichtige Funktion bei der adaptiven Augenmotorik und dem neuronalen Integratornetzwerk hindeutet (22).
Warum sind die Defizite nach einer unilateralen Tonsillektomie so moderat im Vergleich zu klinischen Befunden selbst nach kleinen Tonsilleninfarkten? Eine wahrscheinliche Erklärung könnte sein, dass die Funktion durch die Kompression bereits beeinträchtigt war und dieses Defizit bereits zentral kompensiert wurde. Außerdem war die Größe der perioperativen Tonsillenläsion geringer.
Wir sind uns der Einschränkungen unserer Studie bewusst. Erstens ist das Design zwar prospektiv, aber nicht kontrolliert. Intraoperative neurochirurgische Entscheidungen, d.h. auf der Seite der reduzierten Tonsille, wurden nicht randomisiert. Die Zahl der Patienten ist im Vergleich zu retrospektiven Studien (6, 18) eher klein (n = 10). Unsere Ergebnisse beruhen auf der Untersuchung durch spezialisierte Orthoptistinnen. Die meisten der neu aufgetretenen okulomotorischen Störungen waren leicht und nur bei einer detaillierten okulomotorischen Untersuchung nachweisbar und könnten daher in anderen Studien übersehen worden sein. Eine weitere Einschränkung ist die Zeitspanne, in der die postoperativen Nachuntersuchungen stattfanden. Da das Kleinhirn bekanntermaßen über eine bemerkenswerte Kompensationsfähigkeit verfügt, könnte dies unsere Ergebnisse beeinflusst haben. Während der ersten postoperativen Untersuchung nahmen zwei Patienten Tilidin als Schmerzmittel ein, von dem bekannt ist, dass es das Smooth Pursuit beeinflusst (23). Daher können medizinische Wechselwirkungen zu diesem Zeitpunkt nicht ausgeschlossen werden. Bei dieser Studie handelte es sich um eine explorative Studie ohne Korrektur für Mehrfachtests, die die Signifikanz des SCAFI-Tests hätten beeinflussen können.
Die subokzipitale Dekompression mit Verkleinerung einer Kleinhirntonsille kann zu ähnlichen okulomotorischen Defiziten führen wie bei ischämischen Infarkten; allerdings waren fast alle unsere Patienten asymptomatisch. Mit einer subjektiven und klinischen Verbesserung bei 9/10 unserer Patienten können wir die Resektion einer Kleinhirntonsille befürworten, wenn die Größe der Tonsille oder das Ausmaß der Verlagerung nach unten dies erforderlich machen. Neuroanatomisch gesehen bestätigen unsere Ergebnisse die Rolle der Tonsillen beim Smooth Pursuit und dem Blickhalte-Netzwerk (8, 24). Allerdings beinhaltet unsere Studie einen komplexen neurochirurgischen Eingriff mit Dekompression der subokzipitalen Region einschließlich Tonsillenreduktion, was eine genaue anatomische Lokalisierung ausschließt. Vestibuläre Defizite weisen auf ein Tonusungleichgewicht für den Bogengang und das Otolithensystem hin, das typischerweise im Flocculus oder Hirnstamm lokalisiert ist (25). Zusammenfassend lässt sich sagen, dass dies die erste prospektive klinische Studie über die Auswirkungen einer unilateralen Kleinhirntonsillenresektion auf die Augenmotorik, den Gleichgewichtssinn und die Kleinhirnfunktion ist. Die chirurgische Dekompression, einschließlich der einseitigen Kleinhirntonsillenreduktion/-resektion, führt zu einem guten klinischen Ergebnis in Bezug auf die Beschwerden der Patienten, die Feinmotorik und den Gang, ohne dass die Seite der resezierten Tonsille eine Rolle spielt.
Allerdings können bei einer eingehenden postoperativen Untersuchung ähnliche Störungen der Augenmotorik wie bei ischämischen Infarkten festgestellt werden (Defizite bei der glatten Verfolgung, horizontal blickinduzierter Nystagmus, Rebound-Nystagmus und DBN sowie Abweichung des SVV), was die anatomische Rolle der Tonsille bei der glatten Verfolgung und dem Blickhalte-Netzwerk bestätigt; allerdings sind die Symptome in unserer Chiari-Patientenkohorte leicht und asymptomatisch.
Ethikerklärung
Diese Studie wurde in Übereinstimmung mit den Empfehlungen des Institutional Review Board der Ethikkommission der Ludwig-Maximilians-Universität München mit schriftlicher Einwilligung aller Probanden durchgeführt. Alle Probanden gaben ihre schriftliche Einwilligung nach Aufklärung gemäß der Deklaration von Helsinki. Das Protokoll wurde durch das Institutional Review Board der Ethikkommission der Ludwig-Maximilians-Universität München genehmigt. Die Indikation zum chirurgischen Eingriff wurde unabhängig von der Teilnahme an dieser Studie gestellt.
Beiträge der Autoren
NG: Forschungsprojekt (Konzeption, Organisation, Durchführung, Interpretation der Daten), statistische Analyse (Design, Durchführung), Manuskriptvorbereitung (Schreiben des ersten Entwurfs, Review). KF: Forschungsprojekt (Konzeption, Organisation, Durchführung), Manuskriptvorbereitung (Durchsicht und Kritik). FI und MK: Forschungsprojekt (Durchführung), Manuskripterstellung (Begutachtung). SK: Forschungsprojekt (Interpretation der Daten), Manuskripterstellung (Begutachtung). JT: Forschungsprojekt (Idee zur Studie, Konzeption, Interpretation der Daten), Manuskripterstellung (Review und Kritik). MS: Forschungsprojekt (Studienidee, Konzeption, Interpretation der Daten), Manuskripterstellung (Review und Kritik), einschließlich medizinisches Schreiben für den Inhalt. AP: Forschungsprojekt (Konzeption, Organisation, Durchführung, Interpretation der Daten), Manuskripterstellung (Überprüfung und Kritik), einschließlich medizinisches Schreiben für den Inhalt.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung ohne jegliche kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Die Autoren danken Katie Göttlinger für das Lektorat dieses Manuskripts, Mona Klemm für die orthoptische Untersuchung der Patienten und Andrea Lehner-Bauer für die kalorischen Tests.
Förderung
Diese Studie wurde vom Bundesministerium für Bildung und Forschung (BMBF) unterstützt, Förderkennzeichen 01EO1401 an das Deutsche Zentrum für Schwindel und Gleichgewichtsstörungen (DSGZ).
Ergänzendes Material
1. Batzdorf U, McArthur DL, Bentson JR. Chirurgische Behandlung der Chiari-Malformation mit und ohne Syringomyelie: Erfahrung mit 177 erwachsenen Patienten. J Neurosurg (2013) 118(2):232-42. doi:10.3171/2012.10.JNS12305
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Arnautovic A, Splavski B, Boop FA, Arnautovic KI. Pädiatrische und erwachsene Chiari-Malformation Typ I chirurgische Serie 1965-2013: ein Überblick über Demographie, operative Behandlung und Ergebnisse. J Neurosurg Pediatr (2015) 15(2):161-77. doi:10.3171/2014.10.PEDS14295
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Guyotat J, Bret P, Jouanneau E, Ricci AC, Lapras C. Syringomyelia associated with type I Chiari malformation. Eine retrospektive Studie aus 21 Jahren über 75 Fälle, die durch Dekompression des Foramen magnum behandelt wurden, mit besonderem Augenmerk auf den Wert der Resektion der Tonsillen. Acta Neurochir (Wien) (1998) 140(8):745-54. doi:10.1007/s007010050175
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Liebenberg WA, Georges H, Demetriades AK, Hardwidge C. Does posterior fossa decompression improve oculomotor and vestibulo-ocular manifestations in Chiari 1 malformation? Acta Neurochir (Wien) (2005) 147(12):1239-40; Diskussion 40. doi:10.1007/s00701-005-0612-5
CrossRef Full Text | Google Scholar
9. Dieterich M, Brandt T. Ocular torsion and tilt of subjective visual vertical are sensitive brainstem signs. Ann Neurol (1993) 33(3):292-9. doi:10.1002/ana.410330311
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Bremova T, Bayer O, Agrawal Y, Kremmyda O, Brandt T, Teufel J, et al. Ocular VEMPs indicate repositioning of otoconia to the utricle after successful liberatory maneuvers in benign paroxysmal positioning vertigo. Acta Otolaryngol (2013) 133(12):1297-303. doi:10.3109/00016489.2013.829922
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jacobson GP, Newman CW. Die Entwicklung des Dizziness Handicap Inventory. Arch Otolaryngol Head Neck Surg (1990) 116(4):424-7. doi:10.1001/archotol.1990.01870040046011
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Zwergal A, la Fougere C, Lorenzl S, Rominger A, Xiong G, Deutschenbaur L, et al. Posturales Ungleichgewicht und Stürze bei PSP korrelieren mit funktioneller Pathologie des Thalamus. Neurology (2011) 77(2):101-9. doi:10.1212/WNL.0b013e318223c79d
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Klekamp J. Chirurgische Behandlung der Chiari-I-Malformation – Analyse der intraoperativen Befunde, Komplikationen und Ergebnisse von 371 Dekompressionen des Foramen magnum. Neurosurgery (2012) 71(2):365-80; discussion 80. doi:10.1227/NEU.0b013e31825c3426
CrossRef Full Text | Google Scholar
20. Zee DS, Yamazaki A, Butler PH, Gucer G. Effects of ablation of flocculus and paraflocculus of eye movements in primate. J Neurophysiol (1981) 46(4):878-99.
Google Scholar
22. Leigh RJ, Zee DS. The Neurology of Eye Movements. New York: Oxford University Press (2006).
Google Scholar
23. Thömke F. Augenbewegungsstörungen – Ein klinischer Leitfaden für Neurologen. 2nd ed. Stuttgart: Thieme (2008).
Google Scholar
24. Nagao S. Unterschiedliche Rollen von Flocculus und ventralem Paraflocculus für die okulomotorische Kontrolle beim Primaten. Neuroreport (1992) 3(1):13-6. doi:10.1097/00001756-199201000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar