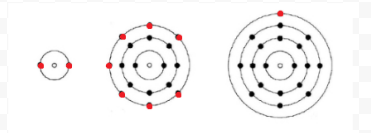
Lewis käytti yksinkertaisia diagrammeja (joita nyt kutsutaan Lewis-diagrammeiksi) pitääkseen kirjaa siitä, kuinka monta elektronia tietyn atomin uloimmassa eli valenssikuoressa oli. Atomin ydin eli ydin yhdessä sisempien elektronien kanssa esitetään kemiallisella symbolilla, ja vain valenssielektronit piirretään pisteinä kemiallisen symbolin ympärille. Siten kuvassa 1 kohdasta Elektronit ja valenssi esitetyt kolme atomia voidaan esittää seuraavilla Lewis-diagrammeilla:

Jos atomi on jalokaasuatomi, kaksi vaihtoehtoista menettelyä on mahdollista. Joko voidaan katsoa, että atomilla ei ole yhtään valenssielektronia, tai voidaan pitää ulointa täytettyä kuorta valenssikuorena. Kolme ensimmäistä jalokaasua voidaan siis kirjoittaa seuraavasti:
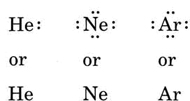
Esimerkki \(\PageIndex{1}\): Lewisin rakenteet
Piirrä Lewisin diagrammit kunkin seuraavan alkuaineen atomille: Li, N, F, Na
Ratkaisu
Kannen etupuolella olevasta jaksollisesta järjestelmästä havaitsemme, että Li:n järjestysluku on 3. Se sisältää siis kolme elektronia, yhden enemmän kuin jalokaasu He. Tämä tarkoittaa, että uloimmassa eli valenssikuoressa on vain yksi elektroni, ja Lewisin diagrammi on
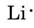
Seuraamalla samaa päättelyä, N:llä on seitsemän elektronia, eli viisi enemmän kuin He:llä, kun taas F:llä on yhdeksän elektronia, eli seitsemän enemmän kuin He:llä, jolloin saadaan
![]()
Na:lla on yhdeksän elektronia enemmän kuin He:llä, mutta kahdeksan elektronia niistä on ytimessä vastaten Ne:n uloimman kuoren kahdeksaa elektronia. Koska Na:lla on vain yksi elektroni enemmän kuin Ne:llä, sen Lewis-diagrammi on
![]()
Huomaa edellisestä esimerkistä, että alkalimetallien Lewis-diagrammit ovat identtisiä lukuun ottamatta niiden kemiallisia symboleja. Tämä sopii hyvin yhteen alkalimetallien hyvin samanlaisen kemiallisen käyttäytymisen kanssa. Samoin kaikkien muiden ryhmien alkuaineiden, kuten emäksisten maametallien tai halogeenien, Lewis-diagrammit näyttävät samalta.
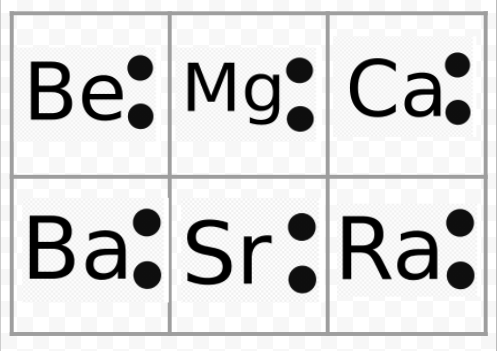
Lewisin diagrammeja voidaan käyttää myös alkuaineiden valenssien ennustamiseen. Lewis esitti, että atomin valenssien lukumäärä vastaa sen valenssikuoren elektronien lukumäärää tai niiden elektronien lukumäärää, joita pitäisi lisätä valenssikuoreen, jotta saavutettaisiin seuraavan jalokaasun elektronikuorirakenne. Esimerkkinä tästä ajatuksesta tarkastellaan alkuaineita Be ja O. Niiden ja jalokaasujen He ja Ne Lewisin diagrammit ovat

Verrattaessa Be:tä ja He:tä havaitaan, että ensin mainitulla on kaksi elektronia enemmän ja siksi sen valenssin pitäisi olla 2. Alkuaine O:n valenssin voisi olettaa olevan 6 tai 2, koska sillä on kuusi valenssielektronia – kaksi vähemmän kuin Ne:llä. Käyttämällä tällä tavoin kehitettyjä valenssisääntöjä Lewis pystyi selittämään yhdisteiden alaindeksien säännöllisen nousun ja laskun taulukossa, joka on Valenssi-osiossa ja joka on toistettu tässä. Lisäksi hän pystyi selittämään yli 50 prosenttia taulukon kaavoista. (Ne, jotka vastaavat hänen ajatuksiaan, on tummennettu taulukossa värillä. Voit halutessasi nyt katsoa tuota taulukkoa ja tarkistaa, että jotkin ilmoitetuista kaavoista noudattavat Lewisin sääntöjä). Lewisin menestys tässä yhteydessä antoi selvän osoituksen siitä, että elektronit olivat tärkein tekijä, joka piti atomeja koossa molekyylejä muodostettaessa.
Näistä onnistumisista huolimatta Lewisin teorioihin liittyy myös vaikeuksia, erityisesti kalsiumin jaksollisen järjestelmän kalsiumin ulkopuolella olevien alkuaineiden osalta. Esimerkiksi alkuaineella Br (Z = 35) on 17 elektronia enemmän kuin jalokaasulla Ar (Z = 18). Tästä voidaan päätellä, että Br:llä on 17 valenssielektronia, minkä vuoksi on hankala selittää, miksi Br muistuttaa niin paljon Cl:ää ja F:ää, vaikka näillä kahdella atomilla on vain seitsemän valenssielektronia.
| Elementti | Atomipaino | Vetoaine. Yhdisteet | Hapen yhdisteet | Kloorin yhdisteet | ||
|---|---|---|---|---|---|---|
| Vety | 1.01 | H2 | H2O, H2O2 | HCl | ||
| Helium | 4.00 | Ei muodostunut | Ei muodostunut | Ei muodostunut | Ei muodostunut | |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl | ||
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 | ||
| Boori | 10.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 | ||
| Typpi | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 | ||
| Happi | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 | ||
| Fluori | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 | ||
| Neon | 20.18 | Ei muodostunut | Ei muodostunut | Ei muodostunut | Ei muodostunut | |
| Natrium | 22.99 | NaH | Na2O, Na2O2 | NaCl | ||
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 | ||
| Alumiini | 26.98 | AlH3 | Al2O3 | AlCl3 | ||
| Silicon | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 | ||
| Fosfori | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 | ||
| Rikki | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 | ||
| Kloori | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 | ||
| Kalium | 39.10 | KH | K2, K2O2, KO2 | KCl | ||
| Argon | 39.95 | Ei muodostunut | Ei muodostunut | Ei muodostunut | Ei muodostunut | |
| Kalsium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 | ||
| Skandium | 44.96 | Suhteellisen epävakaa | Sc2O3 | ScCl3 | ||
| Titaani | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 | ||
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 | ||
| Kromi | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Tekijät
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Minnesotan Rochesterin yliopisto), Tim Wendorff, ja Adam Hahn.