Substances pures et mélanges
Une substance chimique pure est toute matière qui a une composition chimique fixe et des propriétés caractéristiques. L’oxygène, par exemple, est une substance chimique pure qui est un gaz incolore et inodore à 25°C. Très peu d’échantillons de matière sont constitués de substances pures ; la plupart sont des mélanges, c’est-à-dire des combinaisons de deux ou plusieurs substances pures dans des proportions variables, les substances individuelles conservant leur identité. L’air, l’eau du robinet, le lait, le fromage bleu, le pain et la terre sont tous des mélanges. Si toutes les parties d’un matériau sont dans le même état, n’ont pas de limites visibles et sont uniformes, alors le matériau est homogène. L’air que nous respirons et l’eau du robinet que nous buvons sont des exemples de mélanges homogènes. Les mélanges homogènes sont également appelés solutions. Ainsi, l’air est une solution d’azote, d’oxygène, de vapeur d’eau, de dioxyde de carbone et de plusieurs autres gaz ; l’eau du robinet est une solution de petites quantités de plusieurs substances dans l’eau. Les compositions spécifiques de ces deux solutions ne sont cependant pas fixes, mais dépendent à la fois de la source et du lieu ; par exemple, la composition de l’eau du robinet à Boise, Idaho, n’est pas la même que celle de l’eau du robinet à Buffalo, New York. Bien que la plupart des solutions que nous rencontrons soient liquides, elles peuvent également être solides. La substance grise encore utilisée par certains dentistes pour remplir les cavités dentaires est une solution solide complexe qui contient 50 % de mercure et 50 % d’une poudre contenant principalement de l’argent, de l’étain et du cuivre, avec de petites quantités de zinc et de mercure. Les solutions solides de deux métaux ou plus sont communément appelées alliages.
Si la composition d’un matériau n’est pas complètement uniforme, alors il est hétérogène (par exemple, la pâte à biscuits aux pépites de chocolat, le fromage bleu et la terre). Les mélanges qui semblent homogènes se révèlent souvent hétérogènes après un examen microscopique. Le lait, par exemple, semble être homogène, mais lorsqu’on l’examine au microscope, il est clairement constitué de minuscules globules de graisse et de protéines dispersés dans l’eau. Les composants des mélanges hétérogènes peuvent généralement être séparés par des moyens simples. Les mélanges solide-liquide tels que le sable dans l’eau ou les feuilles de thé dans le thé sont facilement séparés par filtration, qui consiste à faire passer le mélange à travers une barrière, telle qu’une passoire, dont les trous ou les pores sont plus petits que les particules solides. En principe, les mélanges de deux ou plusieurs solides, comme le sucre et le sel, peuvent être séparés par une inspection et un tri microscopiques. Cependant, des opérations plus complexes sont généralement nécessaires, comme dans le cas de la séparation des pépites d’or du gravier de la rivière par l’orpaillage. Les matières solides sont d’abord filtrées à partir de l’eau de la rivière, puis les solides sont séparés par inspection. Si l’or est enfoui dans la roche, il peut être nécessaire de l’isoler à l’aide de méthodes chimiques.
-and-Milk-(left).jpg?revision=1)
Figure 1.2.2 : Un mélange hétérogène. Au microscope, le lait entier est en fait un mélange hétérogène composé de globules de graisse et de protéines dispersés dans l’eau. Figure utilisée avec la permission de Wikipédia
Les mélanges hétérogènes (solutions) peuvent être séparés en leurs substances constitutives par des procédés physiques qui reposent sur les différences de certaines propriétés physiques, comme les différences de leurs points d’ébullition. Deux de ces méthodes de séparation sont la distillation et la cristallisation. La distillation utilise les différences de volatilité, une mesure de la facilité avec laquelle une substance se transforme en gaz à une température donnée. Un appareil de distillation simple pour séparer un mélange de substances, dont l’une au moins est un liquide. Le composant le plus volatil bout en premier et est condensé en liquide dans le condenseur refroidi à l’eau, d’où il s’écoule dans le ballon récepteur. Si une solution de sel et d’eau est distillée, par exemple, le composant le plus volatil, l’eau pure, s’accumule dans le ballon récepteur, tandis que le sel reste dans le ballon de distillation.

Figure 1.2.3 : La distillation d’une solution de sel de table dans l’eau. La solution de sel dans l’eau est chauffée dans le ballon à distiller jusqu’à ébullition. La vapeur qui en résulte est enrichie en composant plus volatil (l’eau), qui se condense en liquide dans le condenseur froid et est ensuite recueilli dans le ballon récepteur.
Les mélanges de deux ou plusieurs liquides ayant des points d’ébullition différents peuvent être séparés avec un appareil de distillation plus complexe. Un exemple est le raffinage du pétrole brut en une gamme de produits utiles : carburant d’aviation, essence, kérosène, carburant diesel et huile lubrifiante (dans l’ordre approximatif de volatilité décroissante). Un autre exemple est la distillation de spiritueux alcoolisés tels que le brandy ou le whisky. Cette procédure relativement simple a causé plus que quelques maux de tête aux autorités fédérales dans les années 1920, à l’époque de la Prohibition, lorsque les alambics illégaux ont proliféré dans des régions reculées des États-Unis.
La cristallisation sépare les mélanges en fonction des différences de solubilité, une mesure de la quantité de substance solide qui reste dissoute dans une quantité donnée d’un liquide spécifié. La plupart des substances sont plus solubles à des températures plus élevées, de sorte qu’un mélange de deux ou plusieurs substances peut être dissous à une température élevée, puis laissé refroidir lentement. On peut également laisser le liquide, appelé solvant, s’évaporer. Dans les deux cas, la moins soluble des substances dissoutes, celle qui a le moins de chances de rester en solution, forme généralement des cristaux en premier, et ces cristaux peuvent être retirés de la solution restante par filtration.

Figure 1.2.4 : La cristallisation de l’acétate de sodium à partir d’une solution concentrée d’acétate de sodium dans l’eau. L’ajout d’un petit cristal « germe » (a) entraîne la formation de cristaux blancs par le composé, qui se développent et finissent par occuper la majeure partie du flacon. La vidéo peut être trouvée ici : https://www.youtube.com/watch?v=BLq5NibwV5g
La plupart des mélanges peuvent être séparés en substances pures, qui peuvent être des éléments ou des composés. Un élément, comme le sodium gris, métallique, est une substance qui ne peut pas être décomposée en plus simples par des changements chimiques ; un composé, comme le chlorure de sodium blanc, cristallin, contient deux ou plusieurs éléments et a des propriétés chimiques et physiques qui sont généralement différentes de celles des éléments dont il est composé. À quelques exceptions près, un composé particulier a la même composition élémentaire (les mêmes éléments dans les mêmes proportions), quelle que soit sa source ou son histoire. La composition chimique d’une substance est modifiée dans un processus appelé changement chimique. La transformation de deux éléments ou plus, comme le sodium et le chlore, en un composé chimique, le chlorure de sodium, est un exemple de changement chimique, souvent appelé réaction chimique. Actuellement, environ 115 éléments sont connus, mais des millions de composés chimiques ont été préparés à partir de ces 115 éléments. Les éléments connus sont répertoriés dans le tableau périodique.
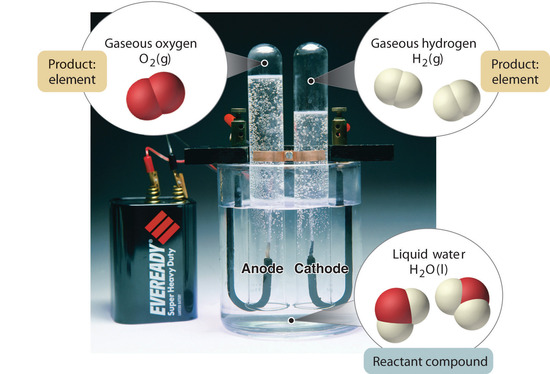
Figure 1.2.5 : La décomposition de l’eau en hydrogène et en oxygène par électrolyse. L’eau est un composé chimique ; l’hydrogène et l’oxygène sont des éléments.
En général, un processus chimique inverse décompose les composés en leurs éléments. Par exemple, l’eau (un composé) peut être décomposée en hydrogène et en oxygène (deux éléments) par un processus appelé électrolyse. Dans l’électrolyse, l’électricité fournit l’énergie nécessaire pour séparer un composé en ses éléments constitutifs (figure 1.2.5). Une technique similaire est utilisée à grande échelle pour obtenir de l’aluminium pur, un élément, à partir de ses minerais, qui sont des mélanges de composés. Comme l’électrolyse nécessite une grande quantité d’énergie, le coût de l’électricité est de loin la plus grande dépense engagée dans la fabrication de l’aluminium pur. Le recyclage de l’aluminium est donc à la fois rentable et écologique. L’organisation générale de la matière et les méthodes utilisées pour séparer les mélanges sont résumées dans la figure 1.2.6.
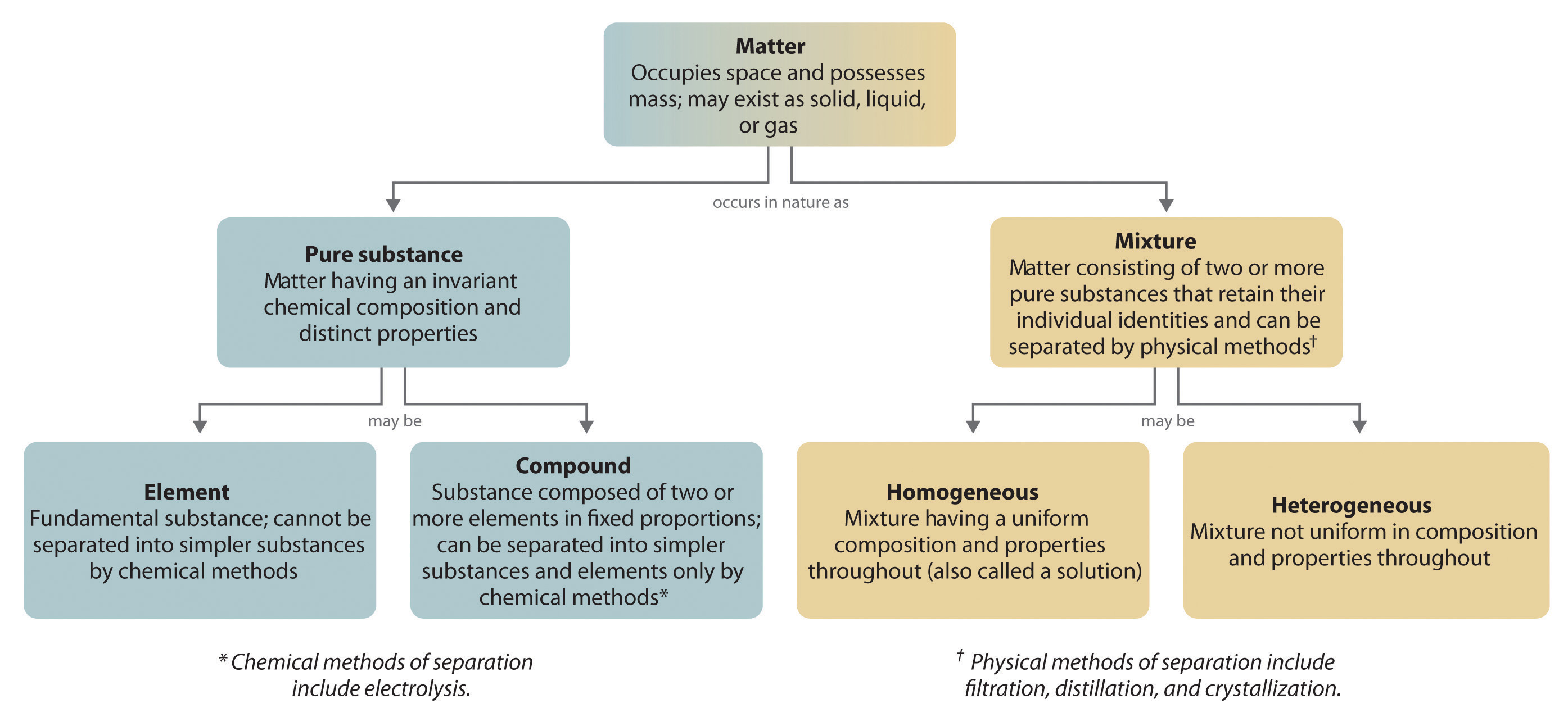
Figure 1.2.6 : Relations entre les types de matière et les méthodes utilisées pour séparer les mélanges
Exemple 1.2.1
Identifiez chaque substance comme un composé, un élément, un mélange hétérogène ou un mélange homogène (solution).
- Thé filtré
- Jus d’orange fraîchement pressé
- Un disque compact
- L’oxyde d’aluminium, une poudre blanche qui contient un rapport de 2 :3 d’atomes d’aluminium et d’oxygène
- sélénium
Donné : une substance chimique
Demandé : sa classification
Stratégie:
- Décider si une substance est chimiquement pure. Si elle est pure, la substance est soit un élément, soit un composé. Si une substance peut être séparée en ses éléments, c’est un composé.
- Si une substance n’est pas chimiquement pure, elle est soit un mélange hétérogène, soit un mélange homogène. Si sa composition est uniforme partout, c’est un mélange homogène.
Solution:
- Un thé est une solution de composés dans l’eau, il n’est donc pas chimiquement pur. On le sépare généralement des feuilles de thé par filtration. B Parce que la composition de la solution est uniforme partout, c’est un mélange homogène.
- A Le jus d’orange contient des particules de solide (pulpe) ainsi que du liquide ; il n’est pas chimiquement pur. B Parce que sa composition n’est pas uniforme partout, le jus d’orange est un mélange hétérogène.
- A Un disque compact est un matériau solide qui contient plus d’un élément, avec des régions de compositions différentes visibles le long de son bord. Par conséquent, un disque compact n’est pas chimiquement pur. B Les régions de composition différente indiquent qu’un disque compact est un mélange hétérogène.
- A L’oxyde d’aluminium est un composé unique, chimiquement pur.
- A Le sélénium est l’un des éléments connus.
Exercice 1.2.1
Identifiez chaque substance comme un composé, un élément, un mélange hétérogène ou un mélange homogène (solution).
- Vin blanc
- mercure
- vinaigrette à la française
- sucre de table (saccharose)
Réponse :
- solution
- élément
- mélange hétérogène
- composé
Résumé
La matière peut être classée selon ses propriétés physiques et chimiques. La matière est tout ce qui occupe de l’espace et possède une masse. Les trois états de la matière sont le solide, le liquide et le gaz. Un changement physique implique la conversion d’une substance d’un état de la matière à un autre, sans changer sa composition chimique. La plupart de la matière est constituée de mélanges de substances pures, qui peuvent être homogènes (composition uniforme) ou hétérogènes (différentes régions possèdent des compositions et des propriétés différentes). Les substances pures peuvent être des composés chimiques ou des éléments. Les composés peuvent être décomposés en éléments par des réactions chimiques, mais les éléments ne peuvent pas être séparés en substances plus simples par des moyens chimiques. Les propriétés des substances peuvent être classées comme physiques ou chimiques. Les scientifiques peuvent observer les propriétés physiques sans modifier la composition de la substance, tandis que les propriétés chimiques décrivent la tendance d’une substance à subir des changements chimiques (réactions chimiques) qui modifient sa composition chimique. Les propriétés physiques peuvent être intensives ou extensives. Les propriétés intensives sont les mêmes pour tous les échantillons, ne dépendent pas de la taille de l’échantillon et comprennent, par exemple, la couleur, l’état physique et les points de fusion et d’ébullition. Les propriétés extensives dépendent de la quantité de matériau et comprennent la masse et le volume. Le rapport de deux propriétés extensives, la masse et le volume, est une propriété intensive importante appelée densité.
Contributeurs
Modifié par Joshua Halpern (Université Howard)
.