- Introduction
- Matériels et méthodes
- Examen clinique des patients
- Approbations de protocoles standards éthiques, enregistrement et consentement des patients
- Intervention neurochirurgicale
- Analyse statistique
- Résultats
- Caractéristiques et symptômes des patients
- Symptômes, signes cliniques et constatations 1 semaine après la chirurgie
- Symptômes, signes cliniques et constatations 3 mois après la chirurgie
- Discussion
- Déclaration d’éthique
- Contributions des auteurs
- Déclaration de conflit d’intérêts
- Remerciements
- Financement
- Matériel supplémentaire
Introduction
La malformation de Chiari comprend un groupe d’entités pathologiques caractérisées par la présence de déformations anatomiques du cervelet et du tronc cérébral. Les symptômes typiques sont des céphalées occipitales, exacerbées par la toux, des troubles moteurs et/ou sensoriels notamment du membre supérieur et une maladresse (1, 2).
Le traitement actuel comprend une décompression de la région sous-occipitale pour élargir le diamètre du foramen magnum et une résection de l’arc postérieur de C1. Mais il y a eu beaucoup de discussions critiques pour savoir si l’on devait ouvrir l’arachnoïde et enlever également les amygdales cérébelleuses (3). Les risques postopératoires de cette procédure semblent être plus élevés, notamment la formation de pseudoméningocèles et d’hygromas, la méningite et les maux de tête (2). D’autre part, une décompression suffisante du tronc cérébral est plus probable lorsque l’arachnoïde et les amygdales sont manipulées (1, 4) (détails dans la fiche S1 du matériel supplémentaire). Les données sur les résultats cliniques après traitement chirurgical varient en raison des différentes méthodes chirurgicales, cohortes de patients et symptômes. Une amélioration clinique et une amélioration de la vie quotidienne ont été décrites dans différentes études chez 50-75% des patients (2, 3). Les dysfonctionnements moteurs oculaires se sont améliorés chez 75 à 100 % des patients (5-7).
L’expérience des lésions cérébelleuses, c’est-à-dire dues à des infarctus ischémiques, nous apprend que les lésions amygdaliennes peuvent entraîner des déficits moteurs oculaires importants provoquant des vertiges invalidants (8). Cependant, l’effet de l’amygdalectomie unilatérale sur la motricité oculaire et la fonction cérébelleuse n’a pas encore été examiné systématiquement. L’objectif principal de notre étude était d’évaluer si la procédure chirurgicale de décompression sous-occipitale, incluant la réduction d’une amygdale cérébelleuse, entraîne des déficits moteurs oculaires, vestibulaires ou cérébelleux chez les patients atteints de malformation de Chiari de type I.
Matériels et méthodes
Examen clinique des patients
Quatorze patients consécutifs présentant des signes radiologiques de malformation de Chiari de type 1 ont été sélectionnés pour cette étude dans les départements de neurologie et de neurochirurgie de l’hôpital universitaire de Munich. Trois patients présentaient des signes cliniques légers et ont été traités de manière conservatrice. Onze ont subi une intervention chirurgicale avec résection ou réduction d’une amygdale cérébelleuse et ont été inclus dans l’étude. Un patient a été perdu de vue.
Les patients ont été examinés avant et à deux moments après l’intervention chirurgicale : un directement après et un en suivi environ 3 mois après la chirurgie. Les patients ont reçu un questionnaire standardisé pour les plaintes typiques. Les patients ont été interrogés sur les maux de tête ou les douleurs cervicales (type et facteurs de provocation), l’instabilité de la démarche, les vertiges ou étourdissements (type et facteurs de provocation), les problèmes visuels, les problèmes audiologiques, les signes moteurs, les déficits sensoriels et les déficits des nerfs crâniens inférieurs.
L’examen consistait en un examen neurologique, neuro-ophtalmologique et neuro-otologique standardisé. Il comprenait le test de poussée de la tête, l’évaluation du nystagmus spontané avec les lunettes de Frenzel en position primaire et pendant la déviation du regard, la poursuite lisse, les saccades, le nystagmus optocinétique, la suppression de la fixation visuelle du réflexe vestibulo-oculaire (VOR), le nystagmus des secousses de la tête et la détermination de la verticale visuelle subjective (SVV). Les déviations supérieures à 2,5° étaient considérées comme pathologiques (9). La fonction cérébelleuse a été évaluée à l’aide d’échelles d’évaluation de l’ataxie, à savoir la Scale for the Assessment and Rating of Ataxia (SARA) (10) et le Spinocerebellar Ataxia Functional Index (SCAFI) (11). Au cours du suivi de 3 mois, la fonction vestibulaire a été examinée sur le plan neurophysiologique par un test calorique bithermique à l’aide du système EyeSeeCam® (différence latérale pathologique selon la formule de Jongkee supérieure à 25 %) et par des potentiels myogéniques provoqués vestibulaires cervicaux et oculaires à conduction aérienne et osseuse (c/oVEMP) à l’aide du système Eclipse d’Interacoustics® (12). Le rapport d’asymétrie doit être inférieur à 35 % (13). Les mesures posturographiques ont été effectuées en position debout selon le protocole standard avec 10 conditions différentes de difficulté croissante (14). L’amélioration subjective a été mesurée par un entretien. Les patients ont été interrogés sur l’ensemble de leurs plaintes pour savoir s’ils avaient une amélioration de leurs symptômes 3 mois après l’intervention. La déficience subjective concernant les vertiges et les étourdissements a été mesurée à l’aide du Dizziness Handicap Inventory (DHI) (15, 16). Le DHI est un inventaire d’auto-évaluation avec un score minimum de 0 et un score maximum de 100 (impact maximum des vertiges sur la vie quotidienne). Le score de changement cliniquement pertinent entre le pré et le post-traitement dans le travail original est de 18 (16). Tous les patients ont subi une IRM postopératoire de routine après 3 mois. En cas de syrinx existant, la taille (longueur et diamètre en millimètres) a été mesurée et comparée aux IRM préopératoires.
Approbations de protocoles standards éthiques, enregistrement et consentement des patients
Cette étude a été réalisée conformément aux recommandations de l’Institutional Review Board du comité d’éthique de l’Université Ludwig-Maximilian de Munich avec le consentement éclairé écrit de tous les sujets. Tous les sujets ont donné leur consentement éclairé par écrit, conformément à la Déclaration d’Helsinki. Le protocole a été approuvé par le comité d’éthique de l’Université Ludwig-Maximilian de Munich. L’indication d’une intervention chirurgicale a été fournie indépendamment de la participation à cette étude.
Intervention neurochirurgicale
Les patients ont fait l’objet d’une surveillance électrophysiologique peropératoire pour les nerfs crâniens inférieurs, les potentiels évoqués moteurs et les potentiels évoqués somatosensoriels afin d’éviter un effet supplémentaire sur le tronc cérébral suite à une inclinaison exagérée de la tête. En position couchée, la tête du patient a été fixée dans une pince de Mayfield. L’intervention chirurgicale a consisté en une dissection médiane sous-occipitale du muscle du cou exposant l’arc de C1 et l’occiput autour du foramen magnum. D’abord, le foramen magnum a été élargi par une craniectomie ostéoclastique d’environ 3 cm × 4 cm, la largeur étant adaptée à la taille du foramen magnum. Ensuite, une laminectomie de l’arc de C1 a été réalisée sur la même largeur du canal rachidien. L’échographie peropératoire permettait de visualiser la pointe des amygdales afin de décompresser aussi bas que nécessaire. Parfois, une laminotomie du bord supérieur de l’arc de C2 était nécessaire. Une laminectomie de C2 n’était jamais réalisée afin d’éviter une instabilité cervicale. Ensuite, la dure-mère était ouverte en « Y » et suturée au périoste de l’occiput. Après une dissection minutieuse de l’arachnoïde, l’amygdale cérébelleuse, plus longue et plus grande, ainsi que le tronc cérébral inférieur et la moelle épinière ont été identifiés. L’amygdale identifiée a d’abord été rétrécie par coagulation de la surface externe et médiane sans affecter les vaisseaux intracrâniens. La pia de l’amygdale coagulée a été incisée et le tissu amygdalien retiré par aspiration douce et coagulation bipolaire. Enfin, l’amygdale réduite a été déposée au niveau du foramen magnum. Le volume moyen du tissu amygdalien réséqué était compris entre 0,6 et 2,7 cm3 (moyenne 1,4 cm3, écart-type 0,6 cm3). Enfin, la région de l’obex a été inspectée pour permettre un écoulement libre du canal central dans la moelle épinière chaque fois que cela était possible sans danger. Pour élargir davantage l’espace craniocervical, un substitut dural (Lyoplant®, B. Braun) a été implanté et suturé de manière étanche. Enfin, la plaie a été méticuleusement refermée en plusieurs couches, par exemple les muscles, le fascia, le subcutis et le cutis pour éviter toute fuite de LCR.
Analyse statistique
L’analyse statistique a été réalisée à l’aide de SPSS Statistics 20 (IBM, Armonk, NY, USA). Les données n’étant pas normalement distribuées, des tests non paramétriques par paires ont été réalisés en utilisant le test des paires appariées de Wilcoxon pour comparer deux échantillons apparentés et le test U de Mann-Whitney pour les comparaisons entre groupes. Les différences ont été considérées comme significatives si p < 0,05. Cette conception d’étude était exploratoire.
Résultats
Caractéristiques et symptômes des patients
Dix patients présentant une malformation de Chiari de type 1 confirmée par IRM (6 femmes, âge moyen 37 ans, fourchette 18-57) ont été inclus dans cette étude. Les valeurs suivantes sont des valeurs moyennes ± l’écart-type. Les participants ont été examinés en préopératoire (27 ± 48 jours avant l’intervention chirurgicale ; intervalle 1 jour-5 mois, n = 10) et à deux moments après l’intervention chirurgicale. Pour plus de détails sur les données cliniques, voir le tableau 1. Dans notre cohorte, la durée moyenne des symptômes était de 4 ± 3 ans (intervalle 3 mois-11 ans). Le délai entre l’apparition des symptômes et le diagnostic correct était de 3 ± 3 ans (de 3 mois à 10 ans). En IRM, la syringomyélie était présente chez 70 % des patients. La descente de l’amygdale variait de 0,7 à 2,2 cm (moyenne 1,4 cm, écart-type 0,6 cm). La longueur de la syringomyélie variait entre un et plus de 10 segments spinaux, la taille entre 1,5 et 0,3 mm en diamètre maximal. La figure 1 montre le patient numéro quatre avec une syringomyélie importante due à une malformation de Chiari de type I en pré et postopératoire.
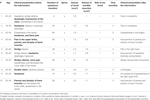
Tableau 1. Présentation clinique et évolution après intervention chirurgicale.
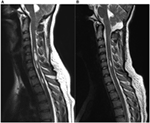
Figure 1. Syringomyélie due à une malformation de Chiari de type I avant (A) et 3 mois après (B) la décompression chirurgicale. (A) Cette femme de 19 ans se plaignait de céphalées occipitales, d’une hypesthésie des membres supérieurs, ainsi que de crises de vertige. Les images RM sagittales préopératoires pondérées en T2 montrent une descente des amygdales jusqu’au bord inférieur de l’arc de C2 et une syringomyélie multi-compartimentale significative dans la moelle épinière cervicale. (B) Les images RM postopératoires mettent clairement en évidence une réduction marquée du syrinx préexistant ainsi qu’une longueur amygdalienne réduite au niveau du foramen magnum. Le patient a rapporté une amélioration remarquable des symptômes après la décompression chirurgicale.
Les principaux symptômes étaient des crises récurrentes de vertiges ou d’étourdissements (60%), de céphalées et de douleurs cervicales, qui s’aggravaient lors de la toux et de mouvements spécifiques de la tête (50%) et des dys-/hypesthésies dans les membres supérieurs (50%).
En termes de caractéristiques clinico-neurologiques, les principales constatations étaient une ataxie des membres supérieurs (dysmétrie de la chasse aux doigts, tremblement d’intention, dysdiadochokinésie) (6/10 patients) et une dys- et hypoesthésie (5/10 patients). Pour plus de détails sur l’examen clinique, voir le tableau 2 (A).
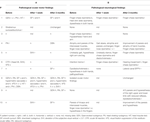
Tableau 2. Résultats moteurs oculaires (A) et neurologiques (B) avant et après l’intervention chirurgicale.
Lors de l’examen neuro-ophtalmologique, cinq patients présentaient des résultats anormaux en matière de motricité oculaire, notamment un nystagmus avec secousses de la tête (n = 3), un nystagmus provoqué par le regard, suppression de la fixation perturbée du VOR, test pathologique de l’impulsion de la tête (chacun n = 2), déviation du SVV, inclinaison de la tête, saccades hypermétriques, nystagmus de rebond, poursuite saccadique lisse et nystagmus à battements descendants (DBN) (chacun n = 1). Pour plus d’informations, voir le tableau 2 (B).
Les patients présentaient des déficits cérébelleux légers dans les scores examinés. Le score total moyen de SARA était de 0,6 ± 0,9 (le score va de 0 = aucune ataxie à 40 = ataxie sévère). Le 8MW moyen était de 5,1 ± 0,5 s. Le 9-Hole peg test (9HPT) de la main dominante était de 20,1 ± 2,2 s et de la main non dominante de 21,3 ± 2,6 s. Le taux moyen de PATA était de 27,9 ± 3,9. Pour plus d’informations, voir le tableau 3.

Tableau 3. Fonction cérébelleuse évaluée par l’échelle d’évaluation et de notation de l’ataxie (SARA) et l’indice fonctionnel de l’ataxie spinocérébelleuse (SCAFI) avant et après l’intervention chirurgicale.
Nine des 10 patients ont subi un test calorique avant l’intervention chirurgicale, huit o/cVEMP. Six patients présentaient une fonction vestibulaire anormale lors de ces tests : trois patients (n° 2, 3 et 7) présentaient une différence latérale pathologique lors du test calorique, suggérant un déficit de la fonction du canal horizontal ; trois autres patients présentaient un test o/cVEMP pathologique, indiquant un déficit de la fonction otolithique (n° 1, 9 et 10).
La moyenne totale du DHI était de 17 (intervalle 0-70), suggérant un handicap léger. Pour plus d’informations, voir le tableau 4.

Tableau 4. Tests vestibulaires du canal horizontal (test calorique), de la fonction sacculaire , et utriculaire ainsi que la déficience subjective, mesurée par le Dizziness Handicap Inventory (DHI), avant et 3 mois après l’intervention chirurgicale.
Les patients avaient une tendance à une moins bonne performance en posturographie par rapport aux contrôles sains publiés dans d’autres études dans notre centre (17). Debout sur un sol ferme, neuf patients sur 10 présentaient un schéma de balancement similaire au vertige postural phobique en réseau artificiel (14). Pour plus d’informations, voir le tableau 5.

Tableau 5. Extrait des données de posturographie avec le balancement total et directionnel, la racine carrée moyenne (RMS), ainsi que la transformation de Fourier rapide (FFT) avant et après l’intervention chirurgicale dans quatre examens sélectionnés.
Symptômes, signes cliniques et constatations 1 semaine après la chirurgie
L’examen neuro-ophtalmologique a révélé une déviation du SVV vers la droite après la résection de l’amygdale gauche (patient n°5 5,2° et patient n°10 4,5°) et de nouveaux déficits de poursuite lisse (n° 1). Pour plus d’informations, voir le tableau 2.
Symptômes, signes cliniques et constatations 3 mois après la chirurgie
Une décompression sous-occipitale suffisante a entraîné une amélioration des symptômes (mesurée par un entretien concernant tous les symptômes avant l’intervention) chez 9/10 des patients en suivi sans influence du côté de l’amygdale réséquée. Deux patients n’avaient plus de plaintes après l’intervention neurochirurgicale (n° 1, 2). Les symptômes se sont améliorés chez sept patients (n° 3-8, n° 10). Un patient a eu des complications majeures dues à une fuite de LCR et à une méningite ultérieure. Il a dû subir une révision chirurgicale pour une fuite durale, et ses symptômes se sont améliorés lentement sur plusieurs semaines (n° 9). Lors du suivi, il présentait une légère hémiparésie résiduelle du côté droit. Il n’y a pas eu d’autres complications chez les autres patients. La taille et la longueur de la syringomyélie préexistante ont diminué chez tous les patients. Pour plus d’informations, voir les tableaux 1 et 2 (B).
Neuro-ophtalmologiquement, le nystagmus des secousses de la tête, le VOR, la réaction d’inclinaison oculaire et le DBN se sont améliorés chez tous les patients affectés. Une amélioration partielle a pu être observée dans le nystagmus provoqué par le regard et la suppression de fixation du VOR.
Les nouveaux troubles de la motricité oculaire après la chirurgie étaient des déficits de poursuite lisse (n° 1, 7, 9, 10), le DBN (n° 4), et le nystagmus provoqué par le regard et le nystagmus de rebond (n° 9). Tous ces patients étaient asymptomatiques. Le patient n° 9, qui présentait des complications postopératoires majeures, a présenté de nouvelles dysfonctions vestibulo-cérébelleuses, notamment un nystagmus provoqué par le regard, un nystagmus de rebond, un déficit de poursuite lisse verticale et un déficit vestibulaire lors de l’épreuve calorique, et a signalé une plus grande altération du DHI. Pour plus d’informations, voir le tableau 2 (A) et le tableau 4.
Les deux patients présentant une cVEMP pathologique se sont améliorés, de même qu’un patient sur trois présentant un test calorique anormal. Le DHI moyen s’est amélioré de 17 à 6 après l’intervention chirurgicale (p = 0,273), en particulier sur la base de deux patients (n° 2, 6), qui ont eu une amélioration significative de la déficience due aux vertiges et aux étourdissements. Pour d’autres résultats, voir le tableau 4.
Dans les mesures posturographiques après la chirurgie, le balancement total (et les valeurs RMS) n’ont pas changé de manière significative. Il n’y avait pas de balancement cérébelleux typique de 3 Hz. Pour plus d’informations, voir le tableau 5.
Discussion
Les principaux résultats de cette étude prospective sont les suivants .
Premièrement, l’examen neuro-opthalmologique préopératoire a révélé des anomalies chez 50 % des patients, notamment un nystagmus des secousses de la tête, un nystagmus provoqué par le regard, une suppression de fixation perturbée du VOR, une déviation du SVV, une inclinaison de la tête, des saccades hypermétriques, un nystagmus de rebond, une poursuite lisse saccadique et un DBN. 70 % des patients avaient une fonction vestibulaire anormale : deux patients avaient un test d’impulsion de tête pathologique indiquant un déficit en haute fréquence du VOR, trois patients avaient un test calorique pathologique testant la fonction basse fréquence du VOR et trois avaient une fonction otolithique anormale testée par des potentiels myogéniques provoqués par le vestibule.
Les patients n’avaient que des signes cérébelleux légers à modérés (notamment une dysmétrie de la poursuite des doigts). Les symptômes cliniques de nos patients Chiari étaient similaires à ceux d’autres études (1, 2, 18), à l’exception de symptômes vestibulaires plus élevés, ce qui confirme les résultats antérieurs selon lesquels la détection est plus élevée dans les services spécialisés en neuro-otologie (6). Dans une étude portant sur 77 patients atteints de Chiari dans un service spécialisé sur plusieurs années, 55% des patients présentaient des anomalies préopératoires dans les examens du système moteur oculaire, y compris le nystagmus spontané horizontal (27%), la poursuite lisse saccadée (29%), le nystagmus induit par la position (21%), la dysmétrie saccadée (10%) et le DBN (7%) (18). Le grand nombre de patients présentant un nystagmus horizontal spontané n’a pas pu être reproduit par nos données, même si trois patients (39%) présentaient un nystagmus horizontal en secouant la tête, ce qui suggère que le stockage de la vitesse était affecté.
Deuxièmement, une intervention chirurgicale incluant une amygdalectomie a conduit à une amélioration subjective et objective des symptômes chez 9/10 des patients. La motricité fine et la démarche mesurée avec le SCAFI se sont améliorées de manière significative. L’altération de la fonction vestibulaire (canal horizontal, sacculaire et utriculaire) s’est améliorée chez cinq des sept patients dont la fonction était altérée avant la chirurgie, en particulier en ce qui concerne la fonction VOR haute fréquence et la fonction otolithique sacculaire. Les troubles de la motricité oculaire se sont améliorés chez tous les patients concernés en termes de nystagmus de secouement de tête, de VOR, de réaction d’inclinaison oculaire et de DBN. Chez certains patients, une amélioration supplémentaire a pu être observée en termes de nystagmus provoqué par le regard et de suppression de fixation du VOR.
L’amélioration subjective dans notre série dépasse celle des séries de cas et des revues qui montrent généralement une amélioration d’environ 75% (3). Cependant, la résection amygdalienne a été décrite chez seulement 27% des patients ayant subi une décompression sous-occipitale selon une revue sur une série chirurgicale entre 1965 et 2013 (3). Dans une autre série de 177 patients, qui ont subi une chirurgie de la fosse postérieure, les 137 patients qui ont subi une résection amygdalienne avec des citernes sous-arachnoïdiennes plus grandes ont montré une réduction plus prononcée de la taille de la syringomyélie et par la suite une plus grande amélioration de leurs symptômes (1). Dans une autre étude d’observation portant sur 77 patients, la résection amygdalienne a donné de bons résultats chez 100 % des patients, contre 64,8 % chez ceux qui n’ont subi qu’une décompression du foramen magnum (4). Dans une grande série de 371 patients utilisant une décompression de la fosse postérieure sans résection amygdalienne, une amélioration des symptômes préopératoires a été décrite chez seulement 73,6% des patients (19).
Troisièmement, l’examen neuro-ophtalmologique après la décompression sous-occipitale, y compris la réduction amygdalienne, a révélé de nouveaux déficits moteurs oculaires, mais le plus souvent asymptomatiques, chez cinq patients, notamment des déficits de poursuite lisse, un nystagmus provoqué par le regard horizontal, un nystagmus de rebond et un DBN. La déviation controlatérale (du côté de la réduction amygdalienne) du SVV était temporaire chez 20 % des patients et a été compensée lors du suivi. Des études rétrospectives antérieures sur les manifestations vestibulo-oculaires dans la malformation de Chiari ou la syringomyélie ont montré une résolution remarquable des troubles moteurs oculaires de 75-100% après décompression sans amygdalectomie (5-7). Dans ces séries, la procédure chirurgicale consistait en une décompression du foramen magnum et une laminectomie C1 incluant une duroplastie sans résection amygdalienne. D’autre part, l’examen oculomoteur, qui n’était pas effectué par des neuro-optalmologistes spécialisés, n’était pas aussi détaillé et standardisé que dans notre série.
À ce jour, il n’y a pas eu de publications sur les effets secondaires oculomoteurs, cérébelleux et vestibulaires de la décompression sous-occipitale avec réduction unilatérale de l’amygdale cérébelleuse, qui est considérée dans les études neuroanatomiques comme une partie importante du vestibulocérébelleux. Dans les expériences animales, les lésions chirurgicales du flocculus et du paraflocculus ont entraîné une altération de la poursuite lisse, du nystagmus provoqué par le regard horizontal, du nystagmus de rebond et du DBN (20).
Dans notre étude, nous avons décrit de nouveaux déficits moteurs oculaires après une décompression sous-occipitale avec réduction d’une amygdale cérébelleuse, y compris des déficits de poursuite lisse, un nystagmus provoqué par le regard horizontal, un nystagmus de rebond et un DBN ainsi qu’une déviation controlatérale du SVV. Comme décrit, ces résultats sont cohérents avec les études animales. Un rapport de cas décrivant un patient souffrant d’un infarctus aigu unilatéral isolé de l’amygdale cérébelleuse a montré une altération de la poursuite lisse, un nystagmus ipsilatéral, un nystagmus provoqué par le regard et une légère inclinaison controlatérale du SVV (8). En résumé, nos résultats démontrent que l’amygdale humaine semble principalement contribuer à la poursuite régulière et au réseau de maintien du regard (8). Ceci est soutenu par des études de connectivité anatomique, car le paraflocculus reçoit principalement des entrées des noyaux pontins controlatéraux (21), du noyau olivaire inférieur controlatéral et du tractus paramédian, ce qui suggère une fonction importante dans le contrôle moteur oculaire adaptatif et le réseau intégrateur neuronal (22).
Pourquoi les déficits après une amygdalectomie unilatérale sont-ils si modérés par rapport aux résultats cliniques, même après de petits infarctus amygdaliens ? Une explication probable pourrait être que la fonction a déjà été altérée en raison de la compression et que ce déficit a déjà été compensé au niveau central. En outre, la taille de la lésion amygdalienne périopératoire était plus petite.
Nous sommes conscients des limites de notre étude. Premièrement, la conception est prospective mais non contrôlée. Les décisions neurochirurgicales peropératoires, c’est-à-dire du côté de l’amygdale réduite, n’ont pas été randomisées. Le nombre de patients est plutôt faible (n = 10) par rapport aux études rétrospectives (6, 18). Nos résultats étaient basés sur des examens effectués par des orthoptistes spécialisés. La plupart des nouvelles dysfonctions oculomotrices étaient légères et uniquement détectables lors d’un examen oculomoteur détaillé, et pourraient donc être manquées dans d’autres études. Une autre limite est la période pendant laquelle les examens de suivi postopératoire ont eu lieu. Comme le cervelet est connu pour avoir une capacité de compensation remarquable, cela pourrait avoir influencé nos résultats. Pendant le premier examen postopératoire, deux patients prenaient de la tilidine comme analgésique, qui est connue pour affecter la poursuite lisse (23). Par conséquent, les interactions médicales ne peuvent être exclues pour le moment. Cette étude était exploratoire sans correction pour les tests multiples, ce qui aurait pu influencer la signification du test SCAFI.
La décompression suboccipitale incluant la réduction d’une amygdale cérébelleuse peut entraîner des déficits moteurs oculaires similaires à ceux des infarctus ischémiques ; cependant, presque tous nos patients étaient asymptomatiques. Avec une amélioration subjective et clinique chez 9/10 de nos patients, nous pouvons promouvoir la résection d’une amygdale cérébelleuse si la taille de l’amygdale ou le degré de déplacement vers le bas le rend nécessaire. Sur le plan neuro-anatomique, nos résultats confirment le rôle de l’amygdale dans la poursuite fluide et le réseau de maintien du regard (8, 24). Cependant, notre étude comprend une procédure neurochirurgicale complexe avec décompression de la région sous-occipitale incluant une réduction de l’amygdale, ce qui exclut une localisation anatomique précise. Les déficits vestibulaires indiquent un déséquilibre du tonus du canal semi-circulaire et du système otolithique, qui est typiquement localisé dans le flocculus ou le tronc cérébral (25). En résumé, il s’agit de la première étude clinique prospective sur l’effet de la résection unilatérale de l’amygdale cérébelleuse sur la motricité oculaire et les fonctions vestibulaire et cérébelleuse. La décompression chirurgicale, y compris la réduction/résection unilatérale de l’amygdale cérébelleuse, conduit à un bon résultat clinique en termes de plaintes des patients, de motricité fine et de marche sans aucun effet du côté de l’amygdale réséquée.
Néanmoins, un examen postopératoire détaillé peut montrer des troubles de la motricité oculaire similaires à ceux résultant d’infarctus ischémiques (déficits de poursuite lisse, nystagmus provoqué par le regard horizontal, nystagmus de rebond et DBN ainsi que déviation du SVV), confirmant le rôle anatomique de l’amygdale dans la poursuite lisse et le réseau de maintien du regard ; cependant, les symptômes sont légers et asymptomatiques dans notre cohorte de patients Chiari.
Déclaration d’éthique
Cette étude a été réalisée conformément aux recommandations de l’Institutional Review Board du comité d’éthique de l’Université Ludwig-Maximilian de Munich avec le consentement éclairé écrit de tous les sujets. Tous les sujets ont donné leur consentement éclairé par écrit, conformément à la Déclaration d’Helsinki. Le protocole a été approuvé par le comité d’éthique de l’Université Ludwig-Maximilian de Munich. L’indication d’une intervention chirurgicale a été fournie indépendamment de la participation à cette étude.
Contributions des auteurs
NG : projet de recherche (conception, organisation, exécution, interprétation des données), analyse statistique (conception, exécution), préparation du manuscrit (rédaction de la première version, révision). KF : projet de recherche (conception, organisation, exécution), préparation du manuscrit (révision et critique). FI et MK : projet de recherche (exécution), préparation du manuscrit (révision). SK : projet de recherche (interprétation des données), préparation du manuscrit (révision). JT : projet de recherche (idée de l’étude, conception, interprétation des données), préparation du manuscrit (revue et critique). MS : projet de recherche (idée de l’étude, conception, interprétation des données), préparation du manuscrit (examen et critique), y compris la rédaction médicale pour le contenu. AP : projet de recherche (conception, organisation, exécution, interprétation des données), préparation du manuscrit (examen et critique) y compris la rédaction médicale pour le contenu.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Les auteurs remercient Katie Göttlinger pour la révision de ce manuscrit, Mona Klemm pour l’examen orthoptique des patients et Andrea Lehner-Bauer pour les tests caloriques.
Financement
Cette étude a été soutenue par le ministère allemand de l’éducation et de la recherche (BMBF), subvention 01EO1401 au centre allemand pour les troubles du vertige et de l’équilibre (DSGZ).
Matériel supplémentaire
1. Batzdorf U, McArthur DL, Bentson JR. Traitement chirurgical de la malformation de Chiari avec et sans syringomyélie : expérience avec 177 patients adultes. J Neurosurg (2013) 118(2):232-42. doi:10.3171/2012.10.JNS12305
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Arnautovic A, Splavski B, Boop FA, Arnautovic KI. Série chirurgicale de malformation de Chiari de type I chez l’enfant et l’adulte 1965-2013 : revue des données démographiques, du traitement opératoire et des résultats. J Neurosurg Pediatr (2015) 15(2):161-77. doi:10.3171/2014.10.PEDS14295
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Guyotat J, Bret P, Jouanneau E, Ricci AC, Lapras C. Syringomyelia associated with type I Chiari malformation. Une étude rétrospective de 21 ans sur 75 cas traités par décompression du foramen magnum en insistant sur l’intérêt de la résection des amygdales. Acta Neurochir (Wien) (1998) 140(8):745-54. doi:10.1007/s007010050175
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Liebenberg WA, Georges H, Demetriades AK, Hardwidge C. Does posterior fossa decompression improve oculomotor and vestibulo-ocular manifestations in Chiari 1 malformation ? Acta Neurochir (Wien) (2005) 147(12):1239-40 ; discussion 40. doi:10.1007/s00701-005-0612-5
CrossRef Full Text | Google Scholar
9. Dieterich M, Brandt T. Ocular torsion and tilt of subjective visual vertical are sensitive brainstem signs. Ann Neurol (1993) 33(3):292-9. doi:10.1002/ana.410330311
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Bremova T, Bayer O, Agrawal Y, Kremmyda O, Brandt T, Teufel J, et al. Ocular VEMPs indicate repositioning of otoconia to the utricle after successful liberatory manoeuvres in benign paroxysmal positioning vertigo. Acta Otolaryngol (2013) 133(12):1297-303. doi:10.3109/00016489.2013.829922
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jacobson GP, Newman CW. The development of the Dizziness Handicap Inventory. Arch Otolaryngol Head Neck Surg (1990) 116(4):424-7. doi:10.1001/archotol.1990.01870040046011
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Zwergal A, la Fougere C, Lorenzl S, Rominger A, Xiong G, Deutschenbaur L, et al. Le déséquilibre postural et les chutes dans la PSP sont corrélés à une pathologie fonctionnelle du thalamus. Neurology (2011) 77(2):101-9. doi:10.1212/WNL.0b013e318223c79d
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Klekamp J. Traitement chirurgical de la malformation de Chiari I – analyse des résultats peropératoires, des complications et du résultat de 371 décompressions du foramen magnum. Neurosurgery (2012) 71(2):365-80 ; discussion 80. doi:10.1227/NEU.0b013e31825c3426
CrossRef Full Text | Google Scholar
20. Zee DS, Yamazaki A, Butler PH, Gucer G. Effects of ablation of flocculus and paraflocculus of eye movements in primate. J Neurophysiol (1981) 46(4):878-99.
Google Scholar
22. Leigh RJ, Zee DS. La neurologie des mouvements oculaires. New York : Oxford University Press (2006).
Google Scholar
23. Thömke F. Augenbewegungsstörungen – Ein klinischer Leitfaden für Neurologen. 2e éd. Stuttgart : Thieme (2008).
Google Scholar
24. Nagao S. Different roles of flocculus and ventral paraflocculus for oculomotor control in the primate. Neuroreport (1992) 3(1):13-6. doi:10.1097/00001756-199201000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
.