- Introduction
- Méthodes
- Inclusion et exclusion des patients
- Approbations du protocole standard et consentements des patients
- Programme d’examen
- Statistiques
- Résultats
- Fréquence de l’IDNA chez les patients atteints de SJSR
- Caractéristiques cliniques des patients souffrant de SJSR avec IDNA par rapport au NID
- Caractéristiques cliniques des patients atteints de SJSR avec IDNA par rapport à IDA
- Marques hématologiques chez les sujets témoins
- Discussion
- Caractéristiques cliniques de l’AID dans le SJSR
- L’IDNA est-il un stade précoce avant l’IDA dans le SJSR ?
- Accéder et diagnostiquer l’IDNA dans le SJSR
- Conclusion
- Data Availability Statement
- Ethics Statement
- Contributions des auteurs
- Funding
- Conflit d’intérêts
- Remerciements
- Matériel supplémentaire
- Abréviations
Introduction
Le syndrome des jambes sans repos (SJSR) est un trouble neurologique fréquent (1), et la carence en fer joue un rôle clé dans sa pathogenèse (2, 3). La carence en fer est fréquente dans le SJSR et l’anémie ferriprive (IDA) est une cause bien connue de SJSR secondaire (4, 5), qui est associée à un risque six fois plus élevé de SJSR dans la population générale (6). La carence en fer sans anémie (IDNA, également carence en fer non anémique) est généralement insidieuse et a récemment attiré l’attention en raison de sa prévalence mondiale et du défi que représentent son diagnostic et sa prise en charge (7). Malgré une relation claire entre l’importance clinique du SJSR dans la population AID (6), la prévalence et les caractéristiques de l’AID dans le SJSR n’ont pas été systématiquement étudiées. On ne sait pas si l’IDNA représente un sous-groupe du SJSR et si l’IDNA est un stade précoce avant l’IDA dans le SJSR. Dans cette étude, nous visons à examiner les caractéristiques cliniques du SJSR avec IDNA par rapport à celles des patients sans carence en fer (NID, également sans carence en fer) et aux patients IDA dans une cohorte consécutive de patients chinois atteints de SJSR.
Méthodes
Inclusion et exclusion des patients
Nous avons recruté en continu des patients de notre clinique spécialisée dans le SJSR et de la clinique des troubles du mouvement du département de neurologie de l’hôpital général de Shanghai, école de médecine de l’université Jiao Tong de Shanghai entre janvier 2017 et octobre 2018. Le SJSR a été diagnostiqué selon les critères diagnostiques du groupe international d’étude du syndrome des jambes sans repos (RLSSG) de 2014 (1). Les patients présentant d’autres troubles neurologiques, une mauvaise coopération ou des troubles cognitifs ont été exclus de l’étude. Des témoins sains appariés en âge et en sexe, sans anémie, ont été recrutés pendant la même période dans le centre d’examen de santé de notre hôpital. Les contrôles étaient exempts de maladie neurologique, y compris le SJSR, par un entretien en face à face.
Approbations du protocole standard et consentements des patients
L’étude a été approuvée par le conseil d’examen institutionnel de l’hôpital général de Shanghai et tous les patients et les contrôles sains inclus dans l’étude ont donné leur consentement écrit.
Programme d’examen
Les patients atteints de SJSR ont été évalués comme nous l’avons décrit précédemment (8). Brièvement, nous avons interrogé les patients en face à face dans notre clinique externe. Les patients considérés comme positifs pour le SJSR ont été diagnostiqués par deux neurologues spécialisés dans le SJSR. Nous avons enregistré les informations démographiques, les antécédents, les symptômes, les médicaments, les examens neurologiques et médicaux généraux et le MMSE de tous les patients recrutés. Un questionnaire semi-structuré a ensuite été évalué, qui comprenait l’âge d’apparition du SJSR, les antécédents familiaux de SJSR (familiarité définie comme « parents au premier degré »), le type et la topographie des sensations, et si les symptômes du SJSR étaient en corrélation avec les variations saisonnières. La sévérité du SJSR pendant la semaine précédant l’entretien a été évaluée à l’aide de l’échelle internationale d’évaluation du SJSR (IRLSRS) (9). Des examens tels que l’échographie vasculaire, les vitesses de conduction nerveuse, l’électromyographie, etc. ont été réalisés si cela était cliniquement indiqué afin d’exclure d’éventuels mimétiques du SJSR comme les polyneuropathies périphériques, la stase veineuse, la claudication vasculaire, la polyarthrite rhumatoïde, etc. Les sujets ayant pris des neuroleptiques ou d’autres médicaments que les auteurs considéraient comme pouvant être liés au SJSR au cours des trois mois précédents ont également été exclus. Nous avons exclu les sujets présentant des comorbidités notables associées au SJSR secondaire comme l’insuffisance rénale chronique, la grossesse, la maladie de Parkinson, la neuropathie périphérique, l’accident vasculaire cérébral et l’ataxie. Les tests sanguins pour l’hémoglobine et le statut ferrique périphérique, y compris la ferritine sérique, le fer, la transferrine et la capacité totale de fixation du fer (TIBC) ont été évalués. La saturation en transferrine (TSAT) a été calculée comme le fer sérique/TIBC × 100. Le taux d’hémoglobine normal a été défini comme suit : femmes ≥ 113 g/L et hommes ≥ 131 g/L selon la valeur normale dans notre hôpital. L’AID est définie comme une ferritine sérique <75 μg/L (ou une ferritine ≥ 75 μg/L mais une TSAT <20 %) avec un taux d’hémoglobine normal (10, 11). L’IDA est diagnostiquée lorsque le taux d’hémoglobine <113 g/L (femmes) ou <131 g/L (hommes), ainsi que la ferritine sérique <75 μg/L (ou ferritine sérique ≥ 75 μg/L mais TSAT <20%).
Statistiques
Les données ont été analysées à l’aide de SPSS 21.0 pour Windows (IBM Co., USA). Toutes les données sont présentées sous forme de moyennes ± écarts types. La plupart des variables n’étant pas normalement distribuées, le test de Kruskal-Wallis a été utilisé pour les comparaisons de variables uniques entre trois groupes, et le test post-hoc de Mann-Whitney lorsque P < 0,05. Les différences de proportions ont été analysées par le test du chi carré de Pearson ou le test exact de Fisher, le cas échéant. Les P < 0,05 ont été considérés comme significatifs. Compte tenu des effets potentiels du traitement médicamenteux sur le symptôme du SJSR et d’autres caractéristiques, nous avons calculé toutes les données deux fois chez les patients SJSR totaux et chez les patients SJSR sans médicament, respectivement.
Résultats
Nous avons recruté en continu un total de 196 patients SJSR primaires sans anémie (SJSR IDNA et SJSR NID) dans cette étude, dont 66 patients de sexe masculin (33,7 %) et 130 patients de sexe féminin (66,3 %). L’âge moyen était de 53,0 ± 13,5 ans. 65,8% (129/196) des patients souffrant de SJSR ne prenaient pas de médicaments pour le SJSR (109 n’en prenaient pas et 20 n’en prenaient pas depuis plus de 2 semaines au moment de l’entretien). Nous avons également inclus 26 patients souffrant de SJSR et présentant une AID (22 n’ayant jamais pris de médicaments). Nous avons exclu cinq patients anémiques du SJSR (Hb <113 g/L pour les femmes et Hb <131 g/L pour les hommes) qui ne présentaient pas de signes de carence en fer (ferritine sérique ≥ 75 μg/L ainsi que TIBC ≥ 20 %, ferritine sérique moyenne comme 236,1 ± 119,3 μg/L). Aucun des patients atteints de SJSR avec IDA ne présentait de signes d’infection, et les causes du SJSR avec IDA ont été répertoriées (tableau 1). En outre, nous avons recueilli 63 sujets témoins sains, dont 22 sujets masculins (34,9 %) et 41 sujets féminins (65,1 %), et l’âge moyen du groupe témoin était de 51,0 ± 12,0 ans (l’âge moyen de 51,0 ± 10,4 et 51,0 ± 12,8 pour les hommes et les femmes, respectivement). Il n’y avait pas de différence significative entre les patients souffrant de SJSR et les témoins, que ce soit au niveau du sexe (SJSR contre témoin : 66,3 contre 65,1 % pour les femmes, P > 0,05) ou de l’âge (SJSR contre témoin : 53,0 ± 13,5 contre 51,0 ± 12,0, P > 0,05). Les informations démographiques détaillées des patients atteints de SJSR dans chaque groupe sont présentées (tableau 2).
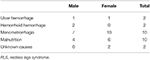
Tableau 1. Causes possibles de la carence en fer chez les patients anémiques du SJR.
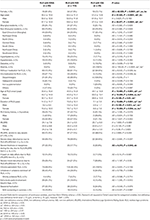
Tableau 2. Informations démographiques et caractéristiques cliniques des patients atteints de SJSR avec IDNA, NID et IDA.
Fréquence de l’IDNA chez les patients atteints de SJSR
Sur les 196 patients atteints de SJSR (130 femmes, 66 hommes) sans anémie ou autres comorbidités, 83 (42,3%) présentaient une carence en fer. La prévalence de l’IDNA chez les femmes (58,5%, 76/130) est beaucoup plus élevée que chez les hommes (10,6%, 7/66) dans cette cohorte de patients atteints de SJSR sans anémie (tableau 2), avec un risque relatif de 5,51 (intervalle de confiance à 95% 2,70-11,27, p < 0,0001).
Caractéristiques cliniques des patients souffrant de SJSR avec IDNA par rapport au NID
Chez les patientes souffrant de SJSR sans anémie, le groupe IDNA avait un âge plus jeune à la fois lors de l’entretien et lors de l’apparition du SJSR par rapport au groupe NID (P < 0,01 ; tableau 2). Bien qu’il n’y ait pas de différence sur la sévérité du SJSR selon l’IRLSRS, nous avons trouvé plus de patients présentant une fatigue ou une somnolence sévère/très sévère pendant la journée dans le groupe IDNA par rapport au groupe NID (32,5 contre 17,7%, P < 0,05 ; Tableau 2). Il n’y avait aucune différence concernant les antécédents familiaux, la sévérité, la latéralité, la localisation et la fluctuation saisonnière du SJSR entre le groupe IDNA et le groupe NID, ni chez les hommes ni chez les femmes. Le groupe SJSR IDNA présentait une ferritine sérique plus faible (hommes et femmes, P < 0,0001) ainsi que des valeurs de transferrine et de TIBC plus élevées (femmes, P < 0,0001) par rapport au groupe SJSR NID (Figure 1, Tableau 3).
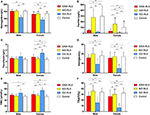
Figure 1. Les paramètres hématologiques et ferriques par groupe et par sexe (A) Hémoglobine. (B) Ferritine. (C) Transferrine. (D) Fer. (E) TIBC. (F) TSAT. **P < 0,01, *P < 0,05, test de Kruskal-Wallis et test post-hoc de Mann-Whitney. Données comparées entre IDNA RLS (n = 83), NID RLS (n = 113), IDA RLS (n = 26) et les contrôles (n = 63). ##P < 0,01, #P < 0,05, test U de Mann-Whitney. Données comparées entre les hommes et les femmes dans chaque groupe de SJSR IDNA, SJSR NID, SJSR IDA, et les contrôles. La carence en fer a été définie comme un taux de ferritine <75 μg/L, ou une ferritine 75 μg/L, mais un TSAT <20%. IDA, anémie ferriprive ; IDNA, carence en fer sans anémie ; NID, non carencé en fer ; SJR, syndrome des jambes sans repos ; TIBC, capacité totale de liaison au fer ; TSAT, saturation de la transferrine.
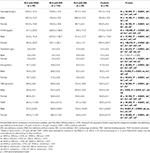
Tableau 3. Données hématologiques des patients atteints de SJSR avec IDNA, NID, IDA et des témoins.
Après avoir exclu les patients atteints de SJSR sous traitement médicamenteux, le groupe SJSR IDNA a encore montré des taux plus élevés de fatigue/somnolence sévère/très sévère pendant la journée par rapport au groupe SJSR NID, bien que ce ne soit pas un niveau significatif (35 vs 18,8%, P = 0,078). Les autres caractéristiques entre le SJSR IDNA et le SJSR NID étaient similaires (tableau supplémentaire 1).
Caractéristiques cliniques des patients atteints de SJSR avec IDNA par rapport à IDA
Le groupe IDA avait des paramètres métaboliques sériques du fer plus sévèrement perturbés que le groupe IDNA, y compris une ferritine plus faible (homme, P < 0.05 ; femme, P < 0,0001), une transferrine plus élevée (femme, P < 0,0001), un fer plus faible (homme, P < 0,05 ; femme, P < 0,0001), un TIBC plus élevé (femme, P < 0,0001) et des valeurs de TSAT plus faibles (homme, P < 0,05 ; femme, P < 0,0001) dans le sérum (Figure 1, Tableau 3). Le SJSR IDNA présentait une durée de la maladie plus longue (P < 0,01 chez les hommes, P < 0,05 chez les femmes) et un âge d’apparition plus jeune (significatif uniquement chez les hommes avec P < 0,05) que le SJSR IDA. Il n’y avait aucune différence concernant les antécédents familiaux positifs, la sévérité (IRLSRS), la latéralité, la localisation et la fluctuation saisonnière du SJSR entre le SJSR IDNA et le SJSR IDA, que ce soit chez les hommes ou chez les femmes (tableau 2). Les résultats étaient similaires après avoir exclu les patients SJSR prenant des médicaments pour le SJSR (tableau supplémentaire 1).
Marques hématologiques chez les sujets témoins
Les critères diagnostiques de la carence en fer sont différents entre la population générale et les patients SJSR (comme discussion ci-dessous). Selon la valeur seuil de notre hôpital pour la carence en fer dans la population générale (20 μg/L), nous avons constaté qu’aucun des sujets masculins du groupe témoin ne présentait de carence en fer, tandis que quatre sujets témoins féminins présentaient une carence en fer (deux sujets avec une ferritine sérique <20 μg/L, et deux sujets avec une ferritine ≥ 20 μg/L mais une TSAT <20%). Il n’y avait pas de différence significative de prévalence de la carence en fer chez les témoins entre les hommes (0 %, 0/22) et les femmes (9,8 %, 4/41 ; P = 0,288). Les tests hématologiques sur l’hémoglobine et les paramètres du fer dans le groupe de contrôle étaient les plus similaires avec le groupe NID RLS par rapport au groupe IDNA ou IDA (Figure 1, Tableau 3).
Discussion
La physiopathologie du SJSR primaire et secondaire est incomplètement comprise. La carence en fer du cerveau joue un rôle fondamental dans la pathogenèse du SJSR, et les conditions caractérisées par une carence en fer systémique, comme l’anémie et la grossesse, sont associées à une prévalence plus élevée des symptômes du SJSR (2, 3, 5, 6). L’IDA est une comorbidité reconnue associée au SJSR secondaire (4-6, 12). L’AID est plus insidieuse et ses caractéristiques sont moins connues chez les patients atteints de SJSR.
Caractéristiques cliniques de l’AID dans le SJSR
En général, les femmes sont plus sensibles au SJSR (1, 13, 14). Les femmes en âge de procréer sont également plus déficientes en fer que les hommes dans la population générale (15). Dans cette étude sur les patients atteints de SJSR sans anémie, nous avons également constaté une discrimination significative en fonction du sexe. Les patients SJSR de sexe féminin présentent un risque beaucoup plus élevé d’IDNA que les patients SJSR de sexe masculin (risque relatif de 5,51, p < 0,0001). Moins de patients masculins souffraient de carence en fer, avec ou sans anémie. Chez les témoins, bien que sans signification statistique, nous avons constaté que 9,8 % des sujets féminins souffraient d’une carence en fer, alors qu’aucun des sujets masculins n’en souffrait. La carence en fer est peu fréquente dans le sexe masculin, donc si les patients masculins atteints de SJSR ont une carence en fer, des enquêtes supplémentaires doivent être menées pour évaluer les causes secondaires telles que les saignements chroniques et la malnutrition due à des troubles gastro-intestinaux.
Par rapport au groupe SJSR « normal » NID, le groupe SJSR IDNA a montré un âge de début du SJSR plus précoce et un âge plus jeune lors de l’entretien chez les femmes, mais pas chez les hommes (tableau 2). Dans une étude antérieure, nous avons constaté que le SJSR à début précoce présentait des antécédents familiaux de SJSR plus positifs et des paramètres ferriques périphériques plus sévèrement perturbés (ferritine sérique plus basse et valeurs de transferrine sérique et de TIBC plus élevées) par rapport au SJSR à début tardif (8). Récemment, nous avons constaté que l’IDNA dans le SJSR prédit certains facteurs génétiques par rapport à l’IDN dans le SJSR (données non publiées). Un sous-type potentiel en association avec le bagage génétique, la carence en fer et le SJSR à début précoce mérite une étude plus approfondie. La fatigue, la faiblesse, les difficultés de concentration, la diminution de la mémoire, ainsi qu’une mauvaise performance au travail sont des symptômes non spécifiques qui sont souvent associés à une carence en fer (7, 16). Allen et al. (6) ont précédemment rapporté que les personnes souffrant d’AID et souffrant de SJSR présentaient plus de fatigue, une moins bonne qualité de sommeil et une diminution de l’énergie diurne par rapport aux patients AID sans SJSR. Nous avons constaté que les patients souffrant de SJSR avec IDNA étaient également plus susceptibles de souffrir de manifestations de fatigue ou de somnolence sévères/très sévères pendant la journée en raison du SJSR par rapport aux patients souffrant de SJSR avec IDNA (point de coupure à 75 μg/L, 32,5 contre 17,7 %, P < 0,05, tableau 2). Lorsqu’on analyse à nouveau uniquement les patients souffrant de SJSR sans traitement, les patients souffrant de SJSR avec IDNA ont encore montré une tendance à être plus sensibles à la fatigue ou à la somnolence sévère/très sévère pendant la journée, bien que n’atteignant pas une signification statistique (35 vs 18,8 %, P = 0,078, tableau supplémentaire 1). Aucune différence de fatigue ou de somnolence diurne sévère/très sévère n’a été trouvée entre le SJSR IDNA et le SJSR IDA dans cette étude (tableau 2). L’appauvrissement des réserves en fer, sur un continuum allant de l’AID à l’IDNA, est associé à une diminution de l’activité des enzymes dépendantes du fer, à une réduction de la capacité d’oxydation cellulaire, ainsi qu’à une diminution de l’efficacité énergétique (17-19). Lorsque nous avons utilisé une définition plus stricte de l’IDNA (valeur seuil de la ferritine sérique fixée à 50 μg/L), nous avons encore constaté que davantage de patients atteints de SJSR IDNA souffraient de fatigue ou de somnolence sévère/très sévère pendant la journée par rapport aux patients atteints de SJSR NID (32,3 contre 19,8 %), mais cela n’était pas significatif (P > 0,05 ; tableau supplémentaire 2). Les mouvements périodiques des jambes pendant le sommeil (PLMS) sont étroitement liés au SJSR, et le locus du gène BTBD9 est corrélé au risque de PLMS et de SJSR (20, 21). Notamment, nous n’avons évalué la qualité du sommeil qu’à l’aide du sous-item 4 de l’IRLSRS, et nous n’avons pas procédé à une évaluation détaillée de l’état du sommeil à l’aide de la mesure par polysomnographie (PSG). Par conséquent, les données du PLMS et d’autres paramètres liés au sommeil n’étaient pas disponibles, ce qui peut contribuer de manière significative à la fatigue ou à la somnolence pendant la journée. Par conséquent, l’association entre la fatigue ou la somnolence diurne et l’IDNA doit être étudiée de manière plus approfondie. Nous n’avons pas trouvé de différence significative dans la sévérité du SJSR entre le groupe IDNA et le groupe NID. La carence en fer périphérique augmente le risque de prévalence du SJSR dans des études cliniques antérieures (6). Des concentrations sériques en fer réduites diminuent globalement les niveaux de fer dans le cerveau, et le traitement par le fer est bénéfique aux patients atteints de SJSR ayant de faibles niveaux de fer périphérique (10). Néanmoins, de nombreux patients atteints de SJSR sans carence en fer systémique présentent un déficit en fer spécifique au cerveau (22). Des études chez les rongeurs ont rapporté que le statut en fer sérique n’était pas corrélé avec les niveaux de fer cérébraux régionaux, donc peut être lié de façon limitée aux caractéristiques du SJSR (23, 24).
L’IDNA est-il un stade précoce avant l’IDA dans le SJSR ?
La carence en fer peut être classée en deux niveaux, l’IDNA et l’IDA, selon la valeur de mesure de l’hémoglobine. Dans cette étude, les patients atteints de SJSR avec IDA présentaient les taux d’hémoglobine, de ferritine et de fer les plus bas, ainsi que les valeurs de transferrine et de TIBC les plus élevées par rapport au SJSR IDNA et au SJSR NID (Figure 1, Tableau 3). Bien qu’il n’y ait pas de différences significatives sur les taux d’hémoglobine entre le SJSR IDNA et le SJSR NID (à la fois chez les patients SJSR masculins et féminins), l’hémoglobine sérique des patients SJSR IDNA était inférieure à celle des témoins (uniquement chez les femmes, P < 0,05, Figure 1, Tableau 3). En outre, les valeurs des paramètres du fer dans le groupe IDNA RLS se situaient entre celles du groupe NID RLS ou du groupe témoin et du groupe IDA RLS (Figure 1, Tableau 3). Ces résultats sont cohérents avec le point de vue selon lequel l’IDNA est une carence en fer plus légère avant le développement de l’anémie. Il convient de noter que les paramètres du fer sérique sont considérés comme reflétant le statut en fer périphérique principalement dans les érythrons (25), tandis que le stockage du fer dans d’autres organes (tels que le foie, le cerveau, etc.) doit être validé chez les sujets IDNA.
Néanmoins, les causes et les caractéristiques du SJSR IDNA et du SJSR IDA ne sont pas entièrement similaires. Dans cette étude, la plupart des patients atteints de SJSR avec AID présentaient des comorbidités notables associées à la malnutrition ou à une perte excessive chronique de sang, notamment une hémorragie du tube digestif, une hémorragie hémorroïdaire et une ménorragie (tableau 1), ce qui est conforme à l’étude précédente (12). Il convient de noter que la ménorragie est une cause fréquente d’AID chez les femmes en âge de procréer, qui peut être consécutive à des fibromes utérins, une adénomyose et d’autres troubles gynécologiques. La malnutrition peut être secondaire à des troubles gastro-intestinaux, à un régime végétarien et à des idées fausses concernant l’image corporelle des jeunes femmes. Ainsi, la carence en fer chez la majorité des patients atteints de SJSR IDA dans cette étude est une « carence en fer absolue ». En revanche, les patients atteints de SJSR avec IDNA ne présentent généralement pas de comorbidités notables. Les causes du SJSR IDNA sont insidieuses et l’IDNA dans le SJSR appartient généralement au champ du SJSR primaire (4) associé à une « carence en fer fonctionnelle ». Cependant, nous ne pouvons pas exclure des causes secondaires insidieuses chez les patients atteints de SJSR à IDNA, qui peuvent conduire à un apport inadéquat de fer dans l’organisme.
Par rapport au SJSR à IDNA, les patients atteints d’IDA avaient un âge plus avancé de début du SJSR, ainsi qu’une durée plus courte du SJSR chez les hommes et les femmes (plus significative chez les hommes ; tableau 2), ce qui était conforme au point de vue selon lequel le SJSR secondaire a généralement un âge de début plus élevé (26). D’après notre expérience, ces patients souffrant de SJSR avec des causes notables (comme une perte de sang aiguë) présentent généralement une durée de maladie plus courte et un rétablissement ou un soulagement plus rapide lorsque les troubles comorbides traitables sont corrigés et que le statut en fer est rétabli. Ils ne nécessitent généralement pas de traitement à long terme du SJSR, ce qui est quelque peu différent des patients atteints de SJSR primaire. De futures études longitudinales sont nécessaires pour confirmer les effets du traitement par supplémentation en fer chez les patients atteints de SJSR avec IDA. D’autres études sur le SJSR comorbide de la grossesse (27) et de l’urémie (28) ont rapporté une amélioration après l’accouchement et la transplantation rénale, suggérant que des changements dans les facteurs métaboliques associés peuvent déclencher le SJSR chez les sujets sensibles (5).
Il existe donc une hétérogénéité dans le SJSR IDA et le SJSR IDNA. Bien que l’IDNA soit généralement considéré comme un stade précoce avant l’anémie (7), il est possible que le SJSR IDNA ne soit pas simplement un stade prodromique avant le SJSR IDA.
Accéder et diagnostiquer l’IDNA dans le SJSR
Bien que la biopsie de moelle osseuse soit considérée comme le meilleur indicateur du statut en fer, elle est rarement réalisée en raison des risques potentiels d’infection ou de saignement au site de la biopsie (29). Les indicateurs de laboratoire du statut ferrique les plus utilisés sont la ferritine, qui reflète soit les réserves tissulaires en fer, soit la quantité de fer disponible pour l’érythropoïèse (30). Bien que la ferritine sérique soit un marqueur sensible pour évaluer les réserves totales de fer de l’organisme, d’autres conditions telles que l’état inflammatoire, l’âge et la fonction rénale peuvent être des facteurs de confusion et augmenter les taux de ferritine sérique (31). La ferritine et la transferrine sont également des réactifs de la phase aiguë, et le taux de ferritine peut augmenter et le taux de transferrine diminuer dans un état inflammatoire (32). Par conséquent, même une ferritine sérique ≥ 75 μg/L et un TSAT <20 % pourraient toujours présenter une carence en fer réelle (11, 33).
Un point de coupure de la concentration de ferritine sérique de <30 μg/L est le plus sensible et le plus spécifique pour identifier une carence en fer potentielle dans la population générale (17, 18), et l’IDNA est classé comme ayant des taux d’hémoglobine normaux avec des taux de ferritine sérique diminués (<20 μg/L) (34, 35). Les laboratoires cliniques fixent généralement la limite inférieure de la plage de référence pour la ferritine sérique à 10-20 μg/L dans la population commune (36) (la limite inférieure est fixée à 20 μg/L dans notre hôpital). Des seuils significativement plus élevés pour la ferritine sérique sont généralement utilisés pour définir la carence en fer dans les troubles chroniques tels que l’insuffisance cardiaque et la maladie rénale chronique (7, 17). Les critères d’évaluation pour définir la carence en fer dans le SJSR sont également différents de ceux des témoins sains, bien que la valeur seuil exacte de la ferritine pour signifier l’IDNA dans le SJSR n’ait pas encore fait l’objet d’un consensus. Des études récentes suggèrent que les patients atteints de SJSR devraient être considérés comme déficients en fer lorsque leur concentration de ferritine est inférieure à 75 μg/L (10, 11, 27). Cependant, les études antérieures ont pour la plupart déterminé une concentration de ferritine inférieure à 50 μg/L comme un » faible statut en fer » dans le SJSR (37, 38). Étant donné qu’aucune donnée sur les descriptions des différents points de coupure n’est disponible, nous avons comparé les caractéristiques du SJSR IDNA et du SJSR NID en utilisant à la fois 75 et 50 μg/L comme valeurs de coupure de la ferritine pour la carence en fer. Nous avons constaté qu’en utilisant 50 μg/L comme seuil inférieur de ferritine, 33,2 % (65/196) des patients atteints de SJSR répondent aux critères de l’IDNA. Les résultats étaient assez similaires pour les deux seuils utilisés, sauf que l’augmentation de la fatigue ou de la somnolence grave/très grave pendant la journée dans le SJSR IDNA par rapport au SJSR NID n’était pas significative lorsque la valeur seuil de la ferritine était fixée à 50 μg/L (tableau 2, tableau supplémentaire 2).
Notre étude présentait certaines limites : Tout d’abord, il s’agissait d’une étude transversale et le manque de données longitudinales a rendu difficile l’identification de l’évolution des symptômes du SJSR et des effets du traitement. En outre, il peut y avoir un biais de rappel. Deuxièmement, il s’agissait d’une étude dans un seul centre, car environ un quart des patients étaient des résidents de Shanghai et la majorité des patients venaient de l’est de la Chine. Compte tenu de l’étendue du territoire chinois et des divers facteurs environnementaux possibles, il peut y avoir un biais de sélection. Troisièmement, nous n’avons pas effectué de mesure PSG pour évaluer l’état détaillé du sommeil chez les patients atteints de SJSR et les témoins. Quatrièmement, environ un tiers des patients atteints de SJSR dans cette étude étaient sous traitement dopaminergique et/ou gabapentine enacarbil (un seul patient recevait un traitement complémentaire en fer), ce qui peut influencer les caractéristiques cliniques. Cependant, nous avons recalculé toutes les données chez les patients atteints de SJSR sans traitement et nous avons tiré la même conclusion. Ceci étant dit, notre étude présente certains avantages. Nous avons étudié en détail le spectre clinique du SJSR et exclu les autres comorbidités ou les mimiques du SJSR. Nous avons interrogé chaque patient en face à face, et nous avons soigneusement exclu les patients atteints de SJSR atypique au cours du suivi. Il y a eu peu d’études sur les caractéristiques de l’IDNA dans le SJSR, nous avons exploré les caractéristiques cliniques détaillées de l’IDNA chez les patients chinois consécutifs du SJSR.
Conclusion
L’IDNA est fréquent chez les patients atteints de SJSR, en particulier chez les femmes, et présente certaines caractéristiques cliniques particulières. L’IDNA avait un âge plus jeune à la fois lors de l’interview et lors de l’apparition du SJSR par rapport au NID chez les patientes atteintes de SJSR. L’IDNA n’est pas très fréquent chez les patients masculins atteints de SJSR et les hommes présentant une carence en fer doivent être évalués pour détecter des troubles comorbides. Les caractéristiques des patients atteints de SJSR avec IDNA sont différentes de celles du SJSR avec IDA. Le SJSR avec IDNA représente un problème de santé publique important et négligé qui mérite une plus grande attention clinique et doit être pris en compte dans la stratégie de traitement. Un dépistage régulier des paramètres périphériques du fer, même chez les patients ayant une numération sanguine normale, est recommandé pour une thérapie appropriée en temps opportun.
Data Availability Statement
Les ensembles de données générés pour cette étude sont disponibles sur demande auprès de l’auteur correspondant.
Ethics Statement
Les études impliquant des participants humains ont été examinées et approuvées par le Shanghai General Hospital Institutional Review Board. Les patients/participants ont fourni leur consentement éclairé écrit pour participer à cette étude.
Contributions des auteurs
X-YZ conception/conception/exécution du projet/rédaction du manuscrit. T-TW : exécution du projet/collecte et interprétation des données/rédaction du manuscrit. H-MW et JS : mesures en laboratoire. XL, L-YN, T-JC, et M-YQ : réalisation du projet/collecte et interprétation des données. TL et WO : révision critique du manuscrit pour le contenu intellectuel important. Y-CW : conception/design/supervision du projet, révision critique du manuscrit pour le contenu intellectuel important. Tous les auteurs : préparation du manuscrit.
Funding
Ce travail a été parrainé par la Commission municipale de planification de Shanghai du Fonds pour la science et la recherche (201740017), le Plan d’innovation en recherche clinique de l’Hôpital général de Shanghai (CTCCR-2018C02), le Programme interdisciplinaire de l’Université Jiao Tong de Shanghai (YG2015QN21), et la Fondation nationale des sciences naturelles de Chine (n °. 81671251).
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions tous les patients et les sujets témoins sains qui ont participé à cette étude. Nous remercions le personnel du centre d’examen physique de l’hôpital général de Shanghai. Nous remercions également le Département de bioinformatique et de biostatistique, École des sciences de la vie et de biotechnologie, Université Jiao Tong de Shanghai, Yue Zhang pour la consultation statistique.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/articles/10.3389/fneur.2020.00298/full#supplementary-material
Abréviations
CI, intervalle de confiance ; IRLSSG, International Restless Legs Study Group ; MMSE, Mini-Mental State Examination ; NID, sans carence en fer ; SJSR, syndrome des jambes sans repos ; IDA, anémie ferriprive ; IDNA, carence en fer sans anémie ; IRLSRS, International Restless Legs Syndrome Rating Scale ; TIBC, capacité totale de liaison au fer ; TSAT, saturation de la transferrine.
1. Allen RP, Picchietti DL, Garcia-Borreguero D, Ondo WG, Walters AS, Winkelman JW, et al. Critères de diagnostic du syndrome des jambes sans repos/maladie de Willis-Ekbom : mise à jour des critères de consensus de l’International Restless Legs Syndrome Study Group (RLSSG) – histoire, justification, description et signification. Sleep Med. (2014) 15:860-73. doi : 10.1016/j.sleep.2014.03.025
CrossRef Full Text | Google Scholar
2. Connor JR, Boyer PJ, Menzies SL, Dellinger B, Allen RP, Ondo WG, et al. L’examen neuropathologique suggère une altération de l’acquisition du fer cérébral dans le syndrome des jambes sans repos. Neurologie. (2003) 61:304-9. doi : 10.1212/01.WNL.0000078887.16593.12
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Allen RP, Earley CJ. Le rôle du fer dans le syndrome des jambes sans repos. Mov disord. (2007) 18(22 Suppl):S440-8. doi : 10.1002/mds.21607
CrossRef Full Text | Google Scholar
4. Trenkwalder C, Allen R, Hogl B, Clemens S, Patton S, Schormair B, et al. Comorbidités, traitement et pathophysiologie du syndrome des jambes sans repos. Lancet Neurol. (2018) 17:994-1005. doi : 10.1016/S1474-4422(18)30311-9
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Trenkwalder C, Allen R, Hogl B, Paulus W, Winkelmann J. Restless legs syndrome associated with major diseases : a systematic review and new concept. Neurology. (2016) 86:1336-43. doi : 10.1212/WNL.0000000000002542
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Allen RP, Auerbach S, Bahrain H, Auerbach M, Earley CJ. La prévalence et l’impact du syndrome des jambes sans repos sur les patients atteints d’anémie ferriprive. Am J Hematol. (2013) 88:261-4. doi : 10.1002/ajh.23397
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Soppi ET. Carence en fer sans anémie – un défi clinique. Clin Case Rep. (2018) 6:1082-6. doi : 10.1002/ccr3.1529
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Zhu XY, Wu TT, Wang HM, Ni LY, Li X, Liu Y, et al. Caractéristiques cliniques et sous-types du syndrome des jambes sans repos dans la population chinoise : une étude de 359 patients. Sleep Med. (2019) 59:15-23. doi : 10.1016/j.sleep.2019.01.053
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP, et al. International Restless Legs Syndrome Study, Validation of the International Restless Legs Syndrome Study Group rating scale for restless legs syndrome. Sleep Med. (2003) 4:121-32. doi : 10.1016/S1389-9457(02)00258-7
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. International Restless Legs Syndrome Study, Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children : an IRLSSG task force report. Sleep Med. (2018) 41:27-44. doi : 10.1016/j.sleep.2017.11.1126
CrossRef Full Text | Google Scholar
11. Trenkwalder C, Winkelmann J, Oertel W, Virgin G, Roubert B, Mezzacasa A, et al. Carboxymaltose ferrique chez les patients atteints du syndrome des jambes sans repos et d’une carence en fer non anémique : un essai randomisé. Mov Disord. (2017) 32:1478-82. doi : 10.1002/mds.27040
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Mehmood T, Auerbach M, Earley CJ, Allen RP. Réponse au fer intraveineux chez les patients atteints d’anémie ferriprive (IDA) et du syndrome des jambes sans repos (maladie de Willis-Ekbom). Sleep Med. (2014) 15:1473-6. doi : 10.1016/j.sleep.2014.08.012
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Thomas K, Watson CB. Le syndrome des jambes sans repos chez les femmes : une revue. J Womens Health. (2008) 17:859-68. doi : 10.1089/jwh.2007.0515
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Ohayon MM, O’Hara R, Vitiello MV. Épidémiologie du syndrome des jambes sans repos : une synthèse de la littérature. Sleep Med Rev. (2012) 16:283-95. doi : 10.1016/j.smrv.2011.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Umbreit J. Iron deficiency : a concise review. Am J Hematol. (2005) 78:225-31. doi : 10.1002/ajh.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Sawada T, Konomi A, Yokoi K. Iron deficiency without anemia is associated with anger and fatigue in young Japanese women. Biol Trace Elem Res. (2014) 159:22-31. doi : 10.1007/s12011-014-9963-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Camaschella C. L’anémie ferriprive. N Engl J Med. (2015) 372:1832-43. doi : 10.1056/NEJMra1401038
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Iron deficiency anaemia. Lancet. (2016) 387:907-16. doi : 10.1016/S0140-6736(15)60865-0
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Haas JD, Brownlie T. Iron deficiency reduced work capacity : a critical review of the research to determine a causal relationship. J Nutr. (2001) 131:676S-88S ; discussion 688S-90S. doi : 10.1093/jn/131.2.676S
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Stefansson H, Rye DB, Hicks A, Petursson H, Ingason A, Thorgeirsson TE, et al. A genetic risk factor for periodic limb movements in sleep. N Engl J Med. (2007) 357:639-47. doi : 10.1056/NEJMoa072743
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Li G, Tang H, Wang C, Qi X, Chen J, Chen S, et al. Association of BTBD9 and MAP2K5/SKOR1 with restless legs syndrome in Chinese population. Sleep. (2017) 40:zsx028. doi : 10.1093/sleep/zsx028
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Earley CJ, Connor J, Garcia-Borreguero D, Jenner P, Winkelman J, Zee PC, et al. Altered brain iron homeostasis and dopaminergic function in Restless Legs Syndrome (Willis-Ekbom Disease). Sleep Med. (2014) 15:1288-301. doi : 10.1016/j.sleep.2014.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Erikson KM, Pinero DJ, Connor JR, Beard JL. Concentrations régionales de fer, de ferritine et de transferrine dans le cerveau pendant la carence en fer et la réplétion en fer chez les rats en développement. J Nutr. (1997) 127:2030-8. doi : 10.1093/jn/127.10.2030
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Yin L, Unger EL, Jellen LC, Earley CJ, Allen RP, Tomaszewicz A, et al. Systems genetic analysis of multivariate response to iron deficiency in mice. Am J Physiol Regul Integr Comp Physiol. (2012) 302:R1282-96. doi : 10.1152/ajpregu.00634.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hallberg L, Hulthen L. Perspectives sur l’absorption du fer. Cellules sanguines Mol Dis. (2002) 29:562-73. doi : 10.1006/bcmd.2002.0603
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Shukla G, Gupta A, Pandey RM, Kalaivani M, Goyal V, Srivastava A, et al. Quelles sont les caractéristiques qui différencient le syndrome des jambes sans repos unilatéral du bilatéral ? A comparative observational study of 195 patients. Sleep Med. (2014) 15:714-9. doi : 10.1016/j.sleep.2014.01.025
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Picchietti DL, Hensley JG, Bainbridge JL, Lee KA, Manconi M, McGregor JA, et al. International Restless Legs Syndrome Study, Consensus clinical practice guidelines for the diagnosis and treatment of restless legs syndrome/Willis-Ekbom disease during pregnancy and lactation. Sleep Med Rev. (2015) 22:64-77. doi : 10.1016/j.smrv.2014.10.009
CrossRef Full Text | Google Scholar
28. Winkelmann J, Stautner A, Samtleben W, Trenkwalder C. Long-term course of restless legs syndrome in dialysis patients after kidney transplantation. Mov Disord. (2002) 17:1072-6. doi : 10.1002/mds.10231
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Bain BJ. Morbidité de la biopsie de la moelle osseuse : revue de l’année 2003. J Clin Cathol. (2005) 58:406-8. doi : 10.1136/jcp.2004.022178
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Baynes RD. Évaluation du statut en fer. Clin Biochem. (1996) 29:209-15. doi : 10.1016/0009-9120(96)00010-K
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Wish JB. Évaluation du statut ferrique : au-delà de la ferritine sérique et de la saturation de la transferrine. Clin J Am Soc Nephrol. (2006) 1(1 Suppl):S4-8. doi : 10.2215/CJN.01490506
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Tietz NW, Rinker AD, Morrison SR. Quand un fer sérique est-il vraiment un fer sérique ? Le statut des mesures du fer sérique. Clin Chem. (1994) 40:546-1. doi : 10.1093/clinchem/40.4.546
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Mackie S, Winkelman JW. Ferritine normale chez un patient présentant une carence en fer et un SJSR. J Clin Sleep Med. (2013) 9:511-3. doi : 10.5664/jcsm.2680
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Comparaison de deux doses de fer élémentaire dans le traitement de la carence en fer latente : efficacité, effets secondaires et capacités d’aveuglement. Nutriments. (2014) 6:1394-405. doi : 10.3390/nu6041394
PubMed Abstract | CrossRef Full Text | Google Scholar
35. D’Adamo CR, Novick JS, Feinberg TM, Dawson VJ, Miller LE. Un complément alimentaire dérivé des aliments contenant une faible dose de fer a amélioré les marqueurs du statut ferrique chez les femmes non anémiques déficientes en fer. J Am Coll Nutr. (2018) 37:342-9. doi : 10.1080/07315724.2018.1427158
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Goodnough LT, Nemeth E, Ganz T. Détection, évaluation et gestion de l’érythropoïèse restreinte en fer. Sang. (2010) 116:4754-61. doi : 10.1182/blood-2010-05-286260
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Lee CS, Lee SD, Kang SH, Park HY, Yoon IY. Comparaison des efficacités du fer oral et du pramipexole pour le traitement des patients atteints du syndrome des jambes sans repos avec une faible ferritine sérique. Eur J Neurol. (2014) 21:260-6. doi : 10.1111/ene.12286
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Tilma J, Tilma K, Norregaard O, Ostergaard JR. Early childhood-onset restless legs syndrome : symptoms and effect of oral iron treatment. Acta Paediatr. (2013) 102:e221-6. doi : 10.1111/apa.12173
PubMed Abstract | CrossRef Full Text | Google Scholar
.